应用液相芯片检测空肠弯曲菌
2015-12-15刘建丽陈进会王振国
赵 丽,蔡 阳,黄 伟,邱 杨,刘建丽,陈进会,王振国
(1.东莞出入境检验检疫局,广东东莞 523072;2.吉林出入境检验检疫局,吉林长春 130000)
应用液相芯片检测空肠弯曲菌
赵 丽1,蔡 阳2,黄 伟1,邱 杨1,刘建丽1,陈进会1,王振国2
(1.东莞出入境检验检疫局,广东东莞 523072;2.吉林出入境检验检疫局,吉林长春 130000)
[目的] 建立空肠弯曲菌液相芯片检测方法。[方法] 本研究将空肠弯曲菌HIP蛋白单克隆抗体与聚苯乙烯微球偶联,结合双抗体夹心技术建立空肠弯曲菌液相芯片检测方法,测定不同浓度的抗体与微球偶联率。通过L9(34)正交设计试验优化方法的反应条件,并进行灵敏度和特异性试验。[结果] 较优实验条件即多克隆抗体工作浓度为1∶100、生物素标记的羊抗兔IgG工作浓度为1∶500、SA-PE的工作浓度为10ug/mL、生物素标记的抗体与SA-PE反应时间为90min。该方法灵敏度可达103CFU/mL,与其他常见食源性致病菌无交叉反应。[结论] 该方法灵敏度高、特异性强、重复性好,可快速检测食品中的空肠弯曲菌。
空肠弯曲菌;双抗体夹心免疫学检测;液相芯片检测
空肠弯曲菌是1973年Butzler等首先自腹泻病人粪便中分离,是人类腹泻的主要致病菌之一[1]。空肠弯曲菌病世界各地均有发生,而且逐年有增加的趋势。多次报道由污染食物、奶品和水源引起的空肠弯曲菌肠炎暴发,每次累及数百人,甚至数千人[2]。在发展中国家如南非、孟加拉等幼儿腹泻中检出率高达40%,呈散发或地方流行。在欧美等发达国家,C. jejuni 是造成腹泻的主要病原体,有时甚至超过沙门氏菌和志贺氏菌,居首位[3]。因此,建立快速而有效的空肠弯曲菌的检测方法一直以来是食品安全的研究热点之一。
虽然空肠弯曲菌的传统检测方法可操作性强,但操作繁琐复杂,特异性、敏感度均低,不能适应
卫生应急检测的需要[4]。当今,分子生物学技术的迅猛发展,基因诊断与分型方法因其敏感性、特异性、分型率和分辨力极高而备受重视。基因芯片是在多种微生物基因组序列被确定之后出现的一种新兴检测技术[5]。基因芯片技术虽然有多方面的优越性,但在实际应用中存在检测成本高、设计要求严格等的局限性,所以不能广泛用于基层单位的检测工作[6]。
本研究将空肠弯曲菌HIP蛋白单克隆抗体与聚苯乙烯微球偶联,结合双抗体夹心免疫学检测模式,建立了空肠弯曲菌液相芯片检测方法并进行初步应用,为今后研究及检测工作提供参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株。空肠弯曲杆菌(33560、ATCC33291)、大肠杆菌O157(54144172)、金黄色葡萄球菌(ATCC25923)、单核细胞增生性李斯特氏菌(ATCC33090、 ATCC54002)、产气荚膜梭菌(ATCC13124)、肠炎沙门氏菌(50041-14)、绵羊李斯特氏菌(ATCC19111)、伤寒沙门氏菌(50071-7)、大肠埃希菌(44102-20)、蜡样芽胞杆菌(63301-14)、霍乱弧菌(JL080118)、沙门氏菌(ATCC9150)、绿脓杆菌(ATCC27853)、志贺氏菌(JL08036)、阪崎杆菌(JL08106)、粪肠球菌(ATCC14506)、变形杆菌(ATCC35659)均由吉林出入境检验检疫技术中心生物实验室保存。
1.1.2 生物试剂(抗原抗体)。捕获抗体:空肠弯曲菌单克隆抗体(Ca.j mAb);检测抗体:空肠弯曲菌多克隆抗体(Ca.j pAb);生物素标记抗抗体:经活化的生物素标记的羊抗兔IgG(biotin-羊抗兔IgG);biotin-羊抗鼠IgG:用于测定偶联效果,确定单抗最佳偶联浓度
1.1.3 化学试剂。牛血清白蛋白(BSA),购自北京鼎国生物有限公司;1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐(EDC)、N-羟基琥珀酰亚胺(NHS)、链霉亲和素-藻红蛋白(SA-PE),购自北京晶美有限公司;活化缓冲液:0.1 M的磷酸盐缓冲液(pH 6.2),0.2μL 滤器过滤;偶联缓冲液:50 mmol/L、pH 6.2的2-(N-吗啡啉)乙磺酸[2-(N-Momphdino)ethanesulfonicacid,MES] ,0.2 μL 滤器过滤;封闭终止液:磷酸盐缓冲酸盐缓冲液(pH7.4)Tween-20(0.05% v/v),0.2 μL 滤器过滤;鞘液,购自美国QIAGEN公司;聚苯乙烯荧光微球,编号为25,内标荧光素,直径5.5μm,购自美国Luminex公司。
1.1.4 仪器设备。液相芯片仪(QIAGEN,Luminex 100 IS)、悬浮芯片检测仪、酶标仪平台、超声波清洗器、漩涡震荡器、离心机、恒温培养箱、纯水机等。
1.2 方法
1.2.1 单克隆抗体最佳工作浓度确定。将35号微球原液室温放置30min,超声10min,漩涡震荡30s,使微球均匀分布。按照Luminex推荐的单克隆抗体与微球偶联步骤进行操作,其中将空肠弯曲菌单克隆抗体稀释成25、50、75、100、125、150、175、200、225、250μg/mL。偶联后加入500μL PBS(1%BSA,0.05%叠氮钠,0.01mol/ LPBS,pH=7.4),重悬微球,37℃,摇床孵育2h进行封闭。每个浓度样品取2 μL加入10 μL500倍稀释的生物素标记羊抗鼠IgG,37℃,120 r/ min,摇床1h。然后14000r/min,离心5min,弃上清,用PBS-TBN洗涤。加入10μL终浓度为8 μg/mL SA-PE,37℃摇床120r/min,30min。离心弃上清,洗涤,重悬于PBS-TBN中,使用Luminex100测定荧光强度中值(MFI)。其中MFI值最大的浓度为单克隆抗体最佳工作浓度。
1.2.2 单克隆抗体与微球的偶联。根据上述实验确定单克隆抗体最佳工作浓度,将单克隆抗体用500μL偶联液稀释至最佳浓度与微球偶联,最后重悬于500μL1%BSA PBS中,37℃水浴摇床孵育2h进行封闭。应用Luminex 100进行计数,封闭后取出4℃保存。
1.2.3 检测方法的建立。将已偶联微球混合液室温放置30min后震荡3min,取约5000个微球,加入10μL空肠弯曲菌(108CFU/mL),再加PBSTBN至100μL。37℃,120r/min,摇床1h。离心弃上清,洗涤。加入稀释的空肠弯曲菌多克隆抗
体10μL,加PBS-TBN至100μL。37℃,120 r/ min,摇床1h。离心弃上清,洗涤。然后加入稀释的生物素标记羊抗兔IgG 10 μL,加PBS-TBN至 100 μL。摇床37℃,1 h。离心弃上清,洗涤。加入SA-PE,加PBS-TBN至100 μL,37℃摇床,取出后离心弃上清,洗涤。重悬于PBS-TBN,使用Luminex100测定MFI。
L9(34)正交设计试验筛选出对实验影响显著的四个因素即多克隆抗体浓度,生物素标记二抗浓度,SA-PE浓度,生物素标记二抗与SA-PE反应时间,并把每个因素设置3个水平,设计因素水平级表通过正交表L9(34)来设计实验,确定最优条件。
1.2.4 灵敏度检测。用PBS缓冲液将纯培养的金葡菌以10倍梯度稀释,取108~102CFU/mL应用已建立的方法进行检测。每组试验重复3次,将三次都检出的细菌浓度作为灵敏度。
1.2.5 特异性检测。通过检测9种常见食源性致病菌评价方法检测目标菌的特异性,每组试验重复3次。
1.2.6 人工添加样品的检测。取样本25g加入225mL的LB培养基中,分别加入100、101、102、103CFU/mL空肠弯曲菌悬液1mL,37℃微需氧培养6h。培养后,取2mL上清,煮沸灭菌,各取10μL用于检测。每组试验重复3次。
2 结果与讨论
2.1 捕获抗体最佳工作浓度的确定
从图1可以看出,当单克隆抗浓度为250ug/ mL时,其MFI值达到最大,故最佳单克隆抗体工作浓度为250ug/mL。
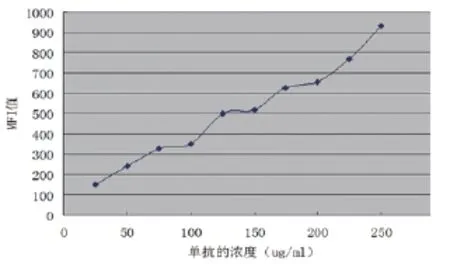
图1 偶联优化结果图
2.2 正交实验结果—确定反应较优条件
根据表1结果可知实验条件A1B1C5D5为较优实验条件,即多克隆抗体工作浓度为1∶100,生物素标记的羊抗兔IgG工作浓度为1∶500,SA-PE工作浓度为10ug/ml,生物素标记的抗体与SA-PE反应时间为90min。
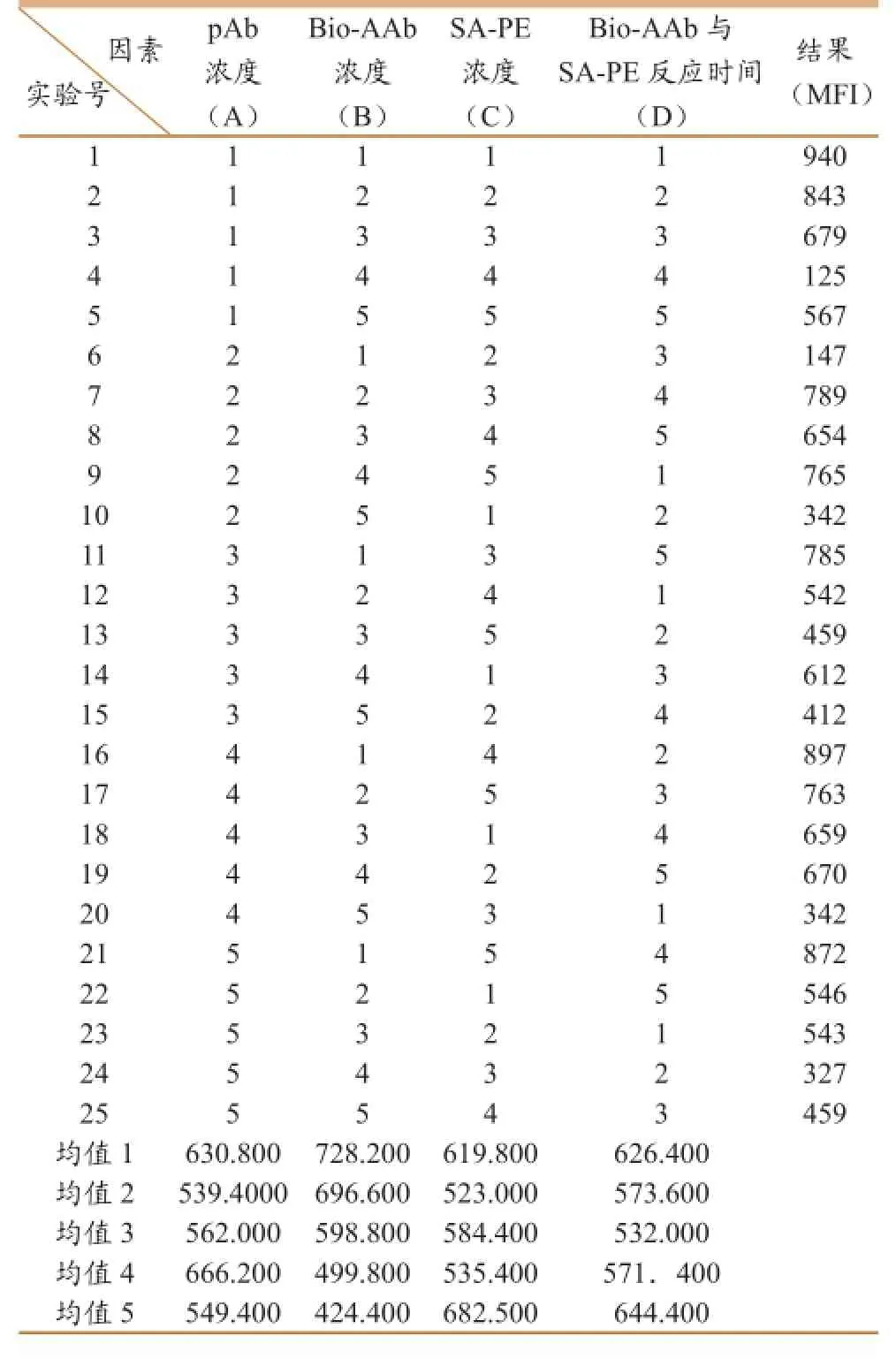
表1 正交试验优化结果表
2.3 灵敏度检测结果
由图2可以看出,在细菌浓度达到103CFU/ mL时仍可被检出。因此本方法灵敏度较高,达103CFU/mL。
2.4 特异性检测结果
用所建立的方法分别检测空肠弯曲杆菌(ATCC33291)、单增李斯特菌(ATCC54002)、霍乱弧菌(JL080118)、沙门氏菌(ATCC9150)、绿脓杆菌、志贺氏菌(JL08036)、阪崎杆菌
(JL08106)、粪肠球菌(ATCC14506)、大肠杆菌O157、金黄色葡萄球菌,从图3可看出此方法特异性良好,与其它细菌无交叉反应。

图2 灵敏度检测结果
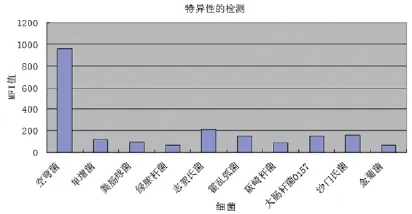
图3 液相芯片检测Ca.j与其他细菌交叉试验结果
2.5 重复性试验
分别在第1、5、7天,用此方法检测阳性菌和阴性菌,由图4可见,阳性菌和阴性菌MFI值上下浮动都不大,证明本方法重复性较好。
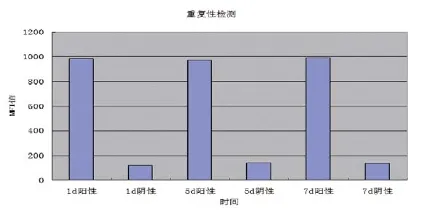
图4 重复性试验结果
2.6 实物样品添加空肠弯曲菌的检测结果
分别在绿豆和兔肉中添加空肠弯曲菌、沙门氏菌,并做空白对照。由表2可见用本方法检出了添加空肠弯曲菌实物样品中的空肠弯曲菌。

表2 液相芯片方法对样品实测结果
3 讨论
当前对食源性病原菌的检测已经有多种方法,如传统的生化检测方法、免疫学检测方法、PCR技术及核酸探针等。这些方法虽然是可提供相对敏感特异的定量方法,但一次仅能检测一种病原菌,当用于多种病原菌检测时变得繁琐费时。液相芯片技术,与其它几种检测方法相比,优势在于检测样品数量和检测项目数量双向高通量、灵活性好、灵敏度高、信噪比好、操作简便、标准曲线范围宽和应用范围广等方面,现已应用于抗原检测、抗体检测和核酸检测领域[6]。作为生物信息学先进的操作平台,在临床诊断、兽医传染病诊断、食品微生物检测等领域具有广阔的应用前景。
本文以空肠弯曲菌为检测对象,对空肠弯曲菌液相芯片的检测条件进行了优化。运用优化的反应体条件进行特异性试验,空肠弯曲菌的荧光值高达12000,而其他细菌的荧光值则不足2000,说明其特异性强,能很好的避免交叉性反应。液相芯片仪每次使用50 μL菌液,检测最低限为103CFU/mL,而VIDAS检测仪最低限为107CFU/mL,说明液相芯片仪检测的线性范围更大。为大量检测食品中的病原菌打下坚实的基础。
本研究对空肠弯曲菌液相芯片的制备条
件进行了优化,获得了与目前常用的常规检测方法相同的检测结果,且检测范围更广,为进一步研究其他食源性病原菌的液相芯片提供了实验依据。
[1]Nachamkin I. Chronic effects of Campylobacter infection[J]. Microbes and Infection,2002,4( 4):399-403.
[2]Humphrey T,O’Brien S,Madsen M. Campylobacters as zoonotic pathogens:A food production perspective [J]. International Journal of Food Microbiology,2007,117( 3 ):237-257.
[3] Altekruse S F ,Stern N J ,Fields P I ,et al. Campylobacter jejuni an emerging food borne pathologen[ J] . Emerg Infect Dis,1999,5(1):28-35 .
[4] GB/T4789.1-2003食品卫生微生物学检验总则[S]. 北京:中国标准出版社,2003:3-5.
[5] Bang J,Beuchat L R,Song H. Development of a random genomic DNA microarray for the detection and identification of Listeria monocytogenes in milk[J]. International Journal of Food Microbiology,2013,161(2):134-141.
[6]胡元庆,李凤霞. 食品中空肠弯曲菌检测技术最新进展[J].食品工业科技,2014,35(13):392-395
[7] 李斌,朱晓光,张仁舟,等.基因芯片技术在微生物学研究中的作用[J].中国病原生物学杂志,2011,6(9):704-706.
The Establishment of Liquid Chip Technique for Detection of Camplobacter jejuni
Zhao Li1,Cai Yang2,Huang Wei1,Qiu Yang1,Liu Jianli1,Chen Jinhui1,Wang Zhenguo2
(1.Dongguan Entry-Exit Inspection and Quarantine Bureau,Dongguan,Guangdong 523072;
2.Jilin Entry-Exit Inspection and Quarantine Bureau,Changchun,Jilin 130000)
[Objective] The aim of the study is to establish liquid chip method for detection of Camplobacter jejuni. [Method] HIP protein monoclonal antibody against Camplobacter jejuni was coupled with polystyrene microspheres and a liquid chip method was established for detection of Camplobacter jejuni in combination with double antibody sandwich technique. The coupling rate of different antibody concentration with the microsphere was determined. The reaction conditions were optimized through L9(34)orthogonal design test,and the developed method was evaluated for its sensitivity and specificity. [Result] The results showed that the optimal test conditions were:the working polyantibody concentration was 1∶100,the working concentration of biotin labeled goat anti rabbit IgG was 1∶500,the working concentration of SA-PE was10ug/mL and the reaction time of biotin labeled antibody and SA-PE was 90min. The sensitivity of the assay reached 103CFU/mL,without cross reaction with other common food borne pathogenic bacteria. [Conclusion] The method was of high sensitivity,specificity and reproducibility and could be used for rapid detection of Camplobacter jejuni in food.
Camplobacter jejuni;double antibody sandwich immunoassay;liquid phase chip detection
R378.3
A
1005-944X(2015)04-0079-05
广东出入境检验检疫局科技计划项目(2013GDK02)
蔡 阳
