多重荧光RT-PCR技术检测猪流感病毒、猪乙型脑炎病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒方法的建立
2015-12-15梁晓艳万东山郭兰英
梁晓艳,万东山,2,郭兰英
(1.华美生物工程有限公司,河南洛阳 471003;2.郑州大学,河南郑州 450001)
多重荧光RT-PCR技术检测猪流感病毒、猪乙型脑炎病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒方法的建立
梁晓艳1,万东山1,2,郭兰英1
(1.华美生物工程有限公司,河南洛阳 471003;2.郑州大学,河南郑州 450001)
[目的] 建立能同时鉴测猪流感病毒(SIV)、猪乙型脑炎病毒(JEV)、猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)的多重荧光RT-PCR方法。[方法] 根据4种病原体的高度保守基因序列,设计相应引物和探针,并对引物和探针浓度进行优化,检测48例疑似样本。[结果] 建立了多重荧光RT-PCR方法,检测48例临床样本中,4种病毒均未感染的1例,SIV与JEV混合感染占2.1 %,CSFV与PRRSV混合感染为31.3 %。[结论] 多重荧光RT-PCR对四种病原体的检测准确性好,具有快速的特点。
多重荧光RT-PCR;猪流感病毒;猪乙型脑炎病毒;猪瘟病毒;猪繁殖与呼吸综合征病毒
1 前言
随着养猪业规模化和集约化发展,猪繁殖障碍疫病已成为大中型猪场最重要的疫病之一。在引起猪繁殖与呼吸障碍的诸多病原中,猪瘟病毒、猪流感病毒、猪繁殖与呼吸综合征病毒和猪乙脑病毒是较为常见的RNA病毒,猪在这四种病毒感染后发病早期,均有发热、食欲减少等症状,根据症状很难区分感染病原体的类别,而且近年来呈现混合感
染的特点,给养猪业造成了巨大的经济损失[1]。目前,对于病毒病的诊断一般采用病原分离鉴定和血清学方法[3],但这些方法存在操作复杂、费时费力、敏感性较差等不足,特别是当猪群混合感染多种病原时,确切诊断还需进行分子生物学检测[4]。本试验依据SIV、CSFV、PRRSV和JEV的保守区基因序列,参考国内外相关文献设计并合成四对特异性引物及探针,建立了可以同时检测SIV、CSFV、PRRSV和JEV四种RNA病毒混合感染的多重荧光RT-PCR检测方法,并对临床48例疑似病料进行初步检测。
2 材料与方法
2.1 仪器
Qiagen分离柱、LR10 2.4A高速冷冻离心机、ABI7500荧光分析仪、JY02S紫外分析仪、HM-I多功能水平电泳槽。
2.2 毒株
猪流感病毒(SIV)、猪乙型脑炎病毒(JEV)、猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)均由本实验室采集、分离保存。
2.3 临床样本
收集自2013年河南省洛阳市周边不同地区养殖场疑似猪流感、猪乙型脑炎、猪瘟、猪繁殖与呼吸综合征病猪48例,取心、肝、脾、肾、淋巴结、大脑、肺脏等,分别装入不同的封口带内,-70 ℃冻存备用。
2.4 引物与探针

表1 用于4种猪病毒的荧光RT-PCR的引物及探针
根据Genebank公布的序列设计4对引物和探针,由上海生工生物工程有限公司合成。
2.5 试验方法
2.5.1 病毒增殖及模板制备
SIV和JEV采用BHK-21细胞增殖,CSFV用PK-15细胞增殖,PRRSV用MARC-145细胞增殖,37 ℃分别培养,当出现细胞病变达90%以上时收毒,将收获的细胞液置于-20 ℃冷冻,37 ℃解冻,如此反复冻融3次,3000 r/min离心25 min,分别吸取含SIV、CSFV、PRRSV和JEV的上清液100 μL,加入600 μL裂解液,充分颠倒,室温静置5 min,将离心管中液体吸入吸附柱中,13000 r/ min 离心30 s,弃去收集管中液体,向吸附柱中加入600 μL 洗液,13000 r/min 离心30s,弃去收集管中液体,重复洗涤一次,13000 r/min,离心2 min。将吸附柱移入新的离心管中,加入25μL洗脱液,室温静置1 min,13000 r/min 离心30 s,置-20℃保存备用。
2.5.2 多重荧光RT-PCR的建立
建立荧光PCR反应体系,在50 μL的反应体系中分别依次加入:10×RT-PCR缓冲液5 μL,MgCL23 mmol/L,dNTPs浓 度 为 200 μm/L,25×RT-PCR酶混合物2 μL,四对引物浓度均为0.5 μmol/L,RNase Inhibitor 40 U/μL,探针浓度0.2 μmol/L,模板5 μL,最后用DEPC-H2O补足50 μL。反应条件为:50 ℃ 15 min;95 ℃ 10 min;40个循环:95 ℃ 8 s,60 ℃ 34 s,充分混匀并短暂离心后放入扩增仪进行扩增。扩增结束后,用1 %琼脂糖凝胶电泳验证结果。
2.5.3 多重荧光RT-PCR的优化
在其他条件不变的情况下,四对引物浓度从 0.4 μmol/L、
0.6 μmol/L、0.8 μmol/L、1.0 μmol/L递增,荧光探针浓度从0.1 μmol/L、0.15 μmol/L、0.2 μmol/L、0.25 μmol/L递增,根据Ct值及曲线形态选择最佳的浓度及配比。
2.5.4 阴、阳性结果判定
反应结束后记录样品的Ct值,如果反应曲线呈对数增长,而且Ct<33,则表明为阳性,否则判为阴性。
2.5.5 临床试验
取收集的心、肝、脾、肾、淋巴结、大脑、肺脏等各2 g,放入研磨器内并且加入5mL PBS,充分研磨混匀,超声波破碎5 min,2000 r/min离心5 min,取上清液提取RNA作为反应模板,按照前面所建里的反应体系依次加入各反应物,进行多重荧光RT-PCR检测,并对结果进行分析。
3 结果
3.1 多重荧光RT-PCR的优化
经过反复试验确立最终SIV引物浓度为:0.45 μmol/L;PRRSV引物浓度为0.66 μmol/L;CSFV引物浓度为0.55 μmol/L;JEV引物浓度为0.75 μmol/L;探针浓度分别为0.1 μmol/L、0.25 μmol/L、0.2 μmol/L、0.15 μmol/L,按照优化后的反应体系同时检测4种猪病毒,结果如图1所示。
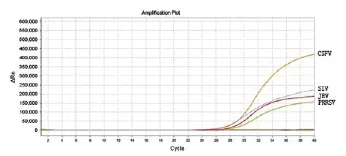
图1 多重荧光RT-PCR检测4种猪病毒
3.2 多重荧光RT-PCR的鉴定
将扩增产物用1 %琼脂糖凝胶进行电泳,4条目的条带均在100 bp左右,与预期结果相符 (图2)。
3.3 临床样本检测
48例临床样本经用所建立的多重荧光PCR检测,发现PRRSV单独感染12例,感染率为25 %,SIV单纯感染7例,感染率为14.6%, CSFV单纯感染6例,感染率为12.5%,JEV单独感染4例,感染率为8.3%,SIV与JEV混合感染1例,CSFV与PRRSV混合感染15例,感染率为31.3%,SIV与JEV混合感染有1份,感染率为2.1%。四种病毒均未检感染的有1例,4种病毒都感染的有2份,占比达4.2 %,这两份样本的多重荧光RT-PCR检测结果如图3所示。
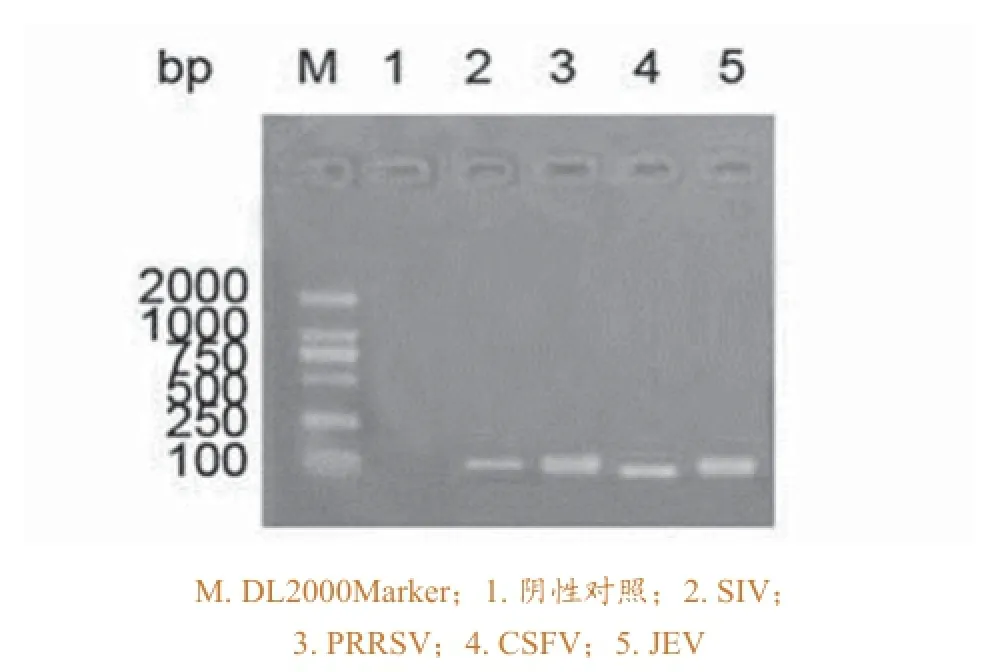
图2 多重荧光RT-PCR的鉴定
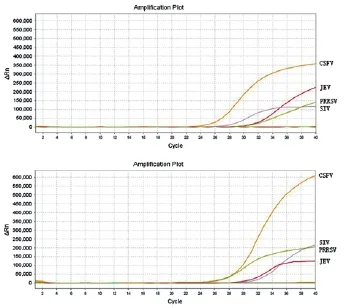
图3 4种病毒都感染的两份样本的荧光RT-PCR检测结果
4 讨论
多重荧光RT-PCR是临床混合感染病原体的重要鉴别诊断方法,通过分析软件能直观详细记录整个RT-PCR过程,且整个检测过程只打开一次试管,有效减少假阳性和污染发生的机会[1]。多重荧光RT-PCR成功的关键在于引物与探针设计,选择高度保守的基因序列,设计多对特异性高的引物和
探针,经过反复筛选调整,最终确定各个引物探针的浓度。
本文采用一步法RT-PCR进行RNA病毒的扩增,不断的摸索条件,采用独有的反应条件:50℃ 15 min;95℃ 10 min;40个循环:95℃ 8 s,60℃ 34 s,事实证明,这种反应模式方便,快捷,可操作性强。王英[9]采用一步法RT-PCR同时扩増DNA和RNA混合模板,在一步法检测上又有创新。
本文检测的48例临床样本中,PRRSV感染率高达56 %,占到一半以上,且CSFV与PRRSV常呈混合感染的态势,这与陈光达的报告大体一致[10],而SIV与JEV常呈散发态势。
目前,对于猪病毒的多重荧光RT-PCR检测技术没有报道,本文通过多重荧光RT-PCR检测猪4种常见病毒,并进行了临床样本检测,可真实反应猪群带毒状况,为后续科研及荧光定量RT-PCR技术开发奠定基础。
[1]饶品彬. EvaGreen多重实时荧光定量PCR同时检测多种猪病毒研究[D]. 浙江 杭州:浙江理工大学,2014.03.
[2] Moennig V,Floegel-Niesmann G and Greiser-Wilke I. Clinical signs and epidemiology of classical swine fever:a review of new knowledge[J]. The Veterinary Journal,2003.165(1):11-20.
[3] Batonick M,Loeffen W,Metwally S A,et al. Identification and characterization of mimotopes of classical swine fever virus E2 glycoprotein using specific anti-E2 monoclonal antibodies[J]. Virus research,2013,175 (1):12-19.
[4]严伟东,李文洁,李文涛,等. 猪瘟病毒的分离鉴定及优化培养[J]. 动物医学进展,2012,4:125-128.
[5] Wilhelm J,Pingoud A. Real-time polymerase chain reaction[J]. Chembiochem,2003,4 (11):1120-1128.
[6] Agindotan B O,Shiel P J,Berger P H. Simultaneous detection of potato viruses,PLRV,PVA,PVX and PVY from dormant potato tubers by TaqMan real-time RT-PCR[J]. J Virol Methods,2007,142 (1):1-9
[7] Arvidsson S,Kwasniewski M,Ria o-Pachón D M,et al. QuantPrime-a flexible tool for reliable high-throughput primer design for quantitative PCR[J]. BMC bioinformatics,2008,9(1):465-479.
[8] Polz M F,Cavanaugh C M. Bias in template-to-product ratios in multitemplate PCR[J]. Applied and Environmental Microbiology,2008,64 (10):3724-3730.
[9]王英. 一步法多重RT-PCR检测猪圆环病毒2型和猪繁殖与呼吸道综合征病毒的方法建立与应用[D]. 江苏 南京:南京农业大学.2009.12.
[10]陈光达.猪六种病毒多重PCR检测方法的建立及初步应用[D]. 陕西 杨陵:西北农林科技大学.2012.05.
Development of a Multiplex Fluorescent RT-PCR for Detection of 4 Swine Viruses
Liang Xiaoyan1,Wan Dongshan1,2,Guo Lanying1
(1.Sino-American Biotechnology Co,LTD,Luoyang,Henan 471003;2. Zhengzhou University,Zhengzhou,Henan 450001)
[Objective] To develop a multiplex fluorescent RT-PCR assay to detect swine influenza virus(SIV),Japanese encephalitis virus(JEV),classical swine fever virus(CSFV),and porcine reproductive and respiratory syndrome virus(PRRSV). [Method] Specific primers and probe were designed based on the highly conserved gene sequences of the four swine pathogens and their working concentrations and the amplification conditions were optimized. The multiplex fluorescent RT-PCR assay was evaluated with 48 suspected clinical samples. [Result] The multiple fluorescent RT-PCR assay was established for 4 swine viruses. Only one out of 48 samples was negative to the four viruses;the positive rate of SIV and JEV mixed infection was 2.1 %;the positive rate of CSFV and PRRSV mixed infection was 31.3 %.[Conclusion] The development of the multiplex fluorescent RT-PCR provided a sensitive,specific and rapid method to detect SIV,CSFV,PRRSV and JEV.
multiplex fluorescent RT-PCR assay;swine influenza virus(SIV);Japanese encephalitis virus(JEV);classical swine fever virus(CSFV);porcine reproductive and respiratory syndrome virus(PRRSV)
S854.4+4
B
1005-944X(2015)04-0068-04
洛阳市科技发展计划项目,编号:1301068A
郭兰英
