71例胸腺癌的临床预后因素分析
2015-05-18艾星浩顾康生
徐 凌,艾星浩,顾康生
胸腺癌来源于胸腺上皮细胞,是生物学特性及预后完全有别于胸腺瘤的一类疾病,其发病率低,仅占原发纵隔肿瘤的2.7%[1];临床少见,治疗模式的争议较多,关于此类疾病的临床研究不多,治疗经验有限。该文通过回顾性分析71例胸腺癌患者诊疗情况,旨在进一步了解胸腺癌的临床特点及影响胸腺癌的预后因素。
1 材料与方法
1.1 病例选择 符合下列标准纳入研究:① 所有患者行手术治疗,包括完全切除、不完全切除;② 术后均经组织病理学诊断为胸腺癌;③所有入组患者按照WHO(2004)组织学分型重新分类;④ 所有入组患者按照Masaoka分期标准进行重新分期;⑤ 有完整的临床资料及随访资料;⑥既往无其他恶性肿瘤史。
1.2 病例资料 收集2000年1月~2011年12月间在上海市胸科医院接受外科治疗的有病理学证据的71例胸腺癌患者的病历资料,其中男38例,女33例,年龄15~80岁,中位年龄54岁。首发症状表现为咳嗽、胸痛42例,重症肌无力3例,体检21例,上腔静脉压迫症3例,其他2例。
1.3 临床分期 所有患者术后病理经Masaoka分期[2]标准进行分期,Ⅰ期:大体包膜完整,镜下无包膜浸润;Ⅱ期:大体有周围脂肪或胸膜侵犯,或镜下包膜浸润;Ⅲ期:侵犯临近器官(心包、大血管、肺);IVA期:胸膜或心包播散;IVB期:淋巴或血道转移。该组患者Ⅱ期7例,Ⅲ期33例,Ⅳ期31例。
1.4 组织学病理分型 所有患者的病理诊断经由上海胸科医院病理科医师复核,组织学分型按照WHO(2004)标准[3]确定为胸腺癌。其中鳞癌49例(69.0%),腺癌 7例(9.9%),小细胞癌 7例(9.9%),腺鳞癌3例(4.2%),类癌5例(7.0%)。低分化癌 21例(29.6%),分化好的 50例(70.4%)。
1.5 治疗方式 71患者均行手术治疗,其中完整切除25例,部分切除46例,全组患者无手术相关死亡。3例重症肌无力患者术前均接受药物治疗;术中所切除肿瘤最大径3.5~17.0 cm,其中≥8 cm的41例,<8 cm的30例;术前行放化疗9例,术后放疗37例。
1.6 统计学处理 采用SPSS 17.0软件进行分析,全组患者随访率100%,相关数据均通过电话随访获得,随访时间至死亡或本研究结束,评价指标为总生存。单因素预后分析采用Kaplan-Meier法计算,组间生存率差异采用Log-rank法检验,采用Cox回归比例风险模型进行多因素预后分析。
2 结果
2.1 生存结果 本研究共入组71例患者,生存时间从手术时间开始计算,中位生存期57.2个月,总体5年生存率47.9%。根据Masaoka分期Ⅱ、Ⅲ、Ⅳ期5年生存率分别为57.1%、69.7%、29.0%;完整切除的5年生存率为68%,部分手术的5年生存率为36.9%;肿块最大径≥8 cm的5年生存率为53.6%,肿块最大径<8的5年生存率为40%。
2.2 生存期与手术方式的关系 本研究中,25例患者接受完整切除手术,46例患者接受部分切除,完整切除的5年生存率为68%,部分切除的5年生存率为36.9%,两组生存期差异有统计学意义(P=0.023),提示可接受根治性手术的患者预后较好。两组间生存曲线见图1A。
2.3 肿瘤最大径与生存期的关系 71例患者均行手术治疗,术中切除肿瘤最大径3.5~17 cm,其中≥8 cm的41例,<8 cm的30例,肿块最大径≥8 cm的5年生存率为53.6%,肿块最大径<8 cm的5年生存率为40%,两组数据之间差异有统计学意义(P=0.031),提示肿瘤大小为预后影响因素,生存曲线见图1B。
2.4 Masaoka分期与生存期的关系 71例患者中,按Masaoka分期标准进行分期,其中Ⅱ期7例,Ⅲ期32例,Ⅳ期32例,5年生存率分别为57.1%、69.7%、29.0%,各期别生存期差异有统计学意义(P=0.001),生存曲线见图1C。
2.5 WHO分型与生存期的关系 将两种分类分别做单因素分析,提示分化好坏不是预后影响因素,但具体病理类型之间差异有统计学意义(P=0.047),提示患者的病理类型是影响预后的因素之一。生存曲线见图1D。
2.6 多因素分析分析影响胸腺癌预后的因素 将单因素分析具有显著性差异的变量:手术方式、Mssaoka分型、WHO分型、肿瘤大小等因素建立COX回归模型,进行多因素分析,显示完整切除和肿块最大径是否>8 cm是胸腺癌患者的预后影响因素。见表1。
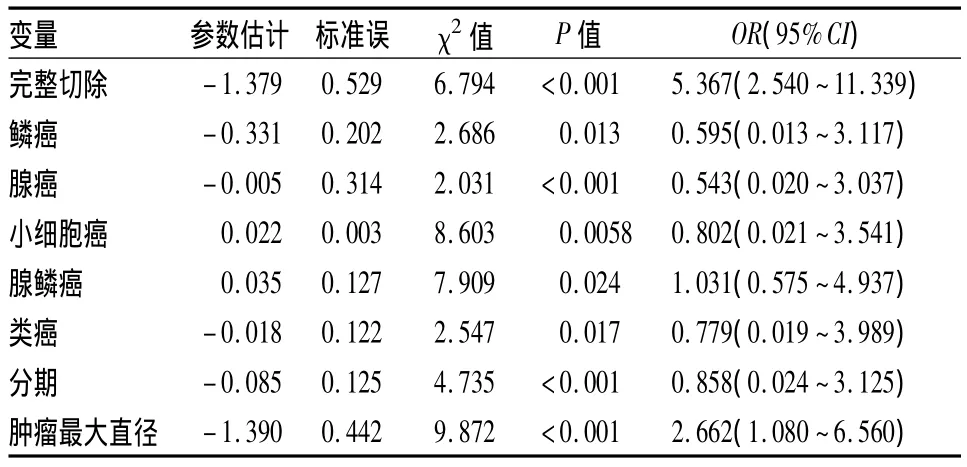
表1 71例胸腺癌患者多变量Cox回归分析结果
3 讨论
原发性胸腺癌是侵袭性较高的胸腺上皮恶性肿瘤,临床少见,国外文献[4]报道胸腺癌发病率占胸腺上皮肿瘤的18%;胸腺癌临床表现不典型,诊断时多为晚期,总体预后差。Ogawa et al[5]报道40例胸腺癌的治疗结果,5、10年总生存率分别为38%、28%。姬巍 等[6]发现,初诊时胸腺癌Ⅲ、Ⅳ期占99%,Ⅲ期5年生存率45%,而Ⅳ期仅为17%。而本研究中总的5年生存率为47.9%,原因可能与入组病例数较少有关。
关于胸腺癌病理类型对预后的影响国内外并无大宗临床研究,本研究中单因素分析提示分化程度对预后影响不大,但病理类型之间的生存存在显著性差异,提示鳞癌及类癌预后好于其他分型。但本研究鳞癌数据较多,病理类型偏少且集中,数据分析结果意义不明确;胸腺癌临床分期采用的是Masaoka 分期系统,Kondo et al[7]认为 Masaoka 分期无论对胸腺瘤还是胸腺癌都是明确的预后因素。本研究中Ⅱ、Ⅲ、Ⅳ期5年生存率分别为57.1%、69.7%、29.0%,各期别生存期差异有统计学意义。研究[8]表明Masaoka分期与胸腺癌的预后无关,而与肿瘤大小及淋巴结转移情况有关。本研究中对肿瘤大小进行分析,其中≥8 cm 41例,<8 cm 30例,单因素分析显示肿瘤大小对预后有影响,两组之间差异有统计学意义,提示肿瘤直径小的患者预后较好。
胸腺癌标准的治疗模式尚未建立,新成立的国际胸腺恶性肿瘤小组(ITMIG)及相关学者推荐胸腺癌按照Masaoka分期的分期治疗[9]:Ⅰ、Ⅱ期首选手术完全切除,Ⅲ、ⅣA期行完全切除或扩大切除,术后给予辅助治疗;ⅣB期行全身系统性化疗。吴开良等[10]回顾性总结30年间胸腺癌治疗的经验和治疗结果,认为综合治疗,特别是完全切除加术后放疗,是其治疗模式。
手术切除是根治性手段,早期发现和完全切除是提高胸腺癌生存率的可行途径。但由于胸腺癌的恶性度高,侵袭性明显,易侵犯心包、大血管及重要器官,切除率低,故对手术方式争议较多,完全切除不能改善胸腺癌的生存,甚至更有研究[7]表明,不完全切除的胸腺癌患者对比不行手术只给予放化疗的患者,5年生存率差异无统计学意义。但本研究中,25例患者接受了根治性手术,46例患者接受姑息性手术,两组生存期差异有统计学意义,提示能够完整切除的患者生存期较长。但本研究入组对象均为接受手术的患者,因而未能对非手术治疗的胸腺癌患者的治疗机预后做进一步分析,此思路可在以后的工作中加以补充和完善。
胸腺癌初诊时晚期比例较大,完整切除机会不多,因此放化疗成为其重要治疗手段。对于胸腺癌,关于根治术后放疗的必要性分歧较多,研究[5]表明对于根治术后的放疗可以减少胸腺癌局部复发和转移。2014年胸腺瘤的NCCN指南中明确指出:无法手术切除(或是肿瘤在诱导化疗后进展)或未完整切除的侵袭性胸腺瘤或胸腺癌患者应当给予放疗,而对根治术后的放疗未做规定。本组研究中71例全部接受手术治疗,对术后放疗的37例患者的分析得出是否行术后放疗并差异无统计学意义。上述争议还需要前瞻性随机对照临床实验进一步加以研究及证实。
胸腺癌对药物治疗不敏感。多项研究[11-12]显示,紫杉醇+卡铂方案在胸腺癌的药物治疗中相对有效率高。ADOC方案因毒副反应过大,因此尽管有接近的疗效,临床使用仍不作为推荐。近年NCCN指南推荐紫杉醇+卡铂方案为胸腺癌化疗的一线方案。
[1]Girard N,Mornex F,Van Houtte P,et al.Thymoma:a focus on current therapeutic management[J].J Thorac Oncol,2009,4(1):119-26.
[2]Masaoka A,Monden Y,Nakahara K,et al.Follow-up study of thy-momas with special reference to their clinical stages[J].Cancer,1981,48(11):2485 -92.
[3]Travis W D,Brambilla E,Muller-Hermelink H K,et al.WHO classification of tumours.Pathology and genetics of tumours of the lung,pleura,thymus and heart[M].Lyon:IARC Press,2004:46.
[4]Chen G,Marx A,Chen W H,et al.New WHO histologic classification predicts prognosis of thymic epithelial tumors:a clinicopathologic study of 200 thymoma cases from China[J].Cancer,2002,95(2):420-9.
[5]Ogawa K,Toita T,Uno T,et al.Treatment and prognosis of thymic carcinoma:a retrospective analysis of 40 cases[J].Cancer,2002,94(12):3115-9.
[6]姬 巍,冯勤富,周宗玫,等.73例胸腺癌的治疗与预后分析[J].中华放射肿瘤学杂志,2006,15(2):98 -9.
[7]Kondo K,Monden Y.Therapy for thymic epithelial tumors:a clinical study of 1 320 patients from Japan[J].Ann Thorac Surg,2003,76(3):878 -84.
[8]Weissferdt A,Moran C A.Thymic carcinoma,part 1:a clinicopathologic and immunohistochemical study of 65 cases[J].Am J Clin Pathol,2012,138(1):103 -14.
[9]Lamarca A,Moreno V,Feliu J.Thymoma and thymic carcinoma in the target therapies era[J].Cancer Treat Rev,2013,39(5):413 -20.
[10]吴开良,蒋国梁,茅静芳,等.51例胸腺癌治疗结果及影响预后因素分析[J].中华放射肿瘤学杂志,2006,15(1):19 -22.
[11]Lemma G L,Lee J W,Aisner S C,et al.Phase II study of carboplatin and paclitaxel in advanced thymoma and thymic carcinoma[J].J Clin Oncol,2011,29(15):2060 -5.
[12]Furugen M,Sekine I,Tsuta K,et al.Combination chemotherapy with carboplatin and paclitaxel for advanced thymic cancer[J].Jpn J Clin Oncol,2011,41(8):1013 -6.
