黄芪多糖对高糖环境下MC3T3-E1细胞活性影响的研究
2015-05-18柳忠豪
滕 腾,孙 鑫,张 冉,柳忠豪
(滨州医学院附属烟台市口腔医院,山东 烟台 264000)
糖尿病患者体液环境中长期存在的高血糖,可影响成骨细胞的分布,引起钙磷代谢异常,增加炎症浸润的程度和持续时间[1-2],是阻碍种植体周围骨组织生成和牙槽骨缺损的愈合、加剧牙周疾患及引起种植修复失败的主要原因[3-5]。
黄芪多糖(Astragalus polysaccharides,APS)是黄芪中主要的功能成分之一,为均一的多糖成分,其生物安全性已在多水平得到证实[6]。黄芪多糖不仅可保护肝肾功能,同时还具有抗氧化、减低体内毒性脂质代谢,以及预防和治疗骨质疏松、糖尿病等多种功效,有着广泛的应用前景[7]。本实验采用不同浓度黄芪多糖(伯恩)对MC3T3-E1进行干预,以了解其在高糖环境下对MC3T3-E1细胞增殖、分化、矿化活性、细胞超微骨架结构和表达Runx-2、OPN、OCN 的影响。
1 材料和方法
1.1 主要材料、试剂和仪器
黄芪多糖(伯恩,天津赛诺制药有限公司);小鼠胚胎成骨前体细胞(MC3T3-E1 subclong14,中科院上海细胞库提供);α-MEM高糖培养基、胎牛血清(Hyclone,美国);胰蛋白酶、碱性磷酸酶试剂盒(南京建成生物工程研究所);MTT(北京索莱宝公司);茜素红(上海源叶生物科技有限公司);罗丹明-鬼笔环肽(CytosKeleton,美国);Trizol(Invitrogen,美国);逆转录试剂盒(Prime ScriptTM RT Reagent Kit)、RT-PCR试剂盒(SYBR Prime Ex TaqTM)(Takara,日本);病理图像分析仪(Olympus,日本);激光共聚焦显微镜(TCS SPE,Leica,德国);定量酶标仪(Multiskan MS-352,芬兰雷勃);RT-PCR仪器(Corbett,澳大利亚)。
1.2 黄芪多糖(APS)培养液的配制
将9 g葡萄糖与50 mL超纯水混合成高糖母液后,取0.58 mL高糖母液加入50 mL正常培养基配置成浓度为16.5 mmol/L的高糖培养基;然后在每100 mL高糖培养中各加入500、50、5 mg注射级黄芪多糖,分别配制成含黄芪多糖浓度为5 mg/mL(高浓度黄芪多糖,High-dose APS,HDA)、0.5 mg/mL(中浓度黄芪多糖,Medium-dose APS,MDA)、0.05 mg/mL(低浓度黄芪多糖,Low-dose APS,LDA)的高糖培养基。
1.3 MC3T3-E1细胞的培养
将小鼠胚胎成骨前体细胞(MC3T3-E1 Subclone 14)接种于含100 g/L胎牛血清的α-MEM培养基中,置于37℃、50 mL/L CO2、饱和湿度条件条件下进行培养。2~3 d换液,待细胞汇合达90%以上时进行传代培养。
1.4 高糖环境下APS对MC3T3-E1增殖影响的观察
取对数生长的MC3T3-E1细胞以2×104/孔的密度接种于96孔板 (200 μL/孔),并将细胞随机分为4组(1个对照组和3个实验组),每组复5孔。其中对照组加入单纯高糖培养基(High-glucose,HG),3个实验组分别加入含黄芪多糖浓度为5 mg/mL(HDA 组)、0.5 mg/mL(MDA 组)、0.05 mg/mL(LDA组)的高糖培养基(200 μL/孔),置于 50 mL/L CO2、饱和湿度的恒温(37℃)培养箱中进行培养。分别于培养后1、3、5 d,每孔加入20 μL MTT继续孵育4 h;然后弃孔内上清,并于每孔各加入150 μL二甲基亚砜,继续恒温孵育30 min至结晶完全溶解后,酶标仪检测各孔570 nm波长处的吸光度值(A值)。
1.5 高糖环境下APS对MC3T3-E1中ALP活性影响的观察
取对数生长的MC3T3-E1细胞以1×105/孔密度接种于24孔板,按1.4的方法将细胞随机分为4组,并相应加入含不同浓度黄芪多糖的高糖培养基后,置于37℃、50 mL/L CO2细胞培养箱中进行培养。分别于培养后1、3、5、7 d取各组细胞(每组3孔),PBS冲洗后每孔加入500 mL细胞裂解液(1 mg/mL Triton X-100)裂解细胞。40 min后10 000 r/min离心5 min,弃上清,沉淀部分用ALP工作液溶解后,置于50 mL/L CO2恒温(37℃)培育箱中继续孵育40 min;然后用酶标仪检测各孔400 nm波长下的吸光度值(A值)。
1.6 高糖环境下APS对MC3T3-E1矿化能力影响的观察
将对数生长期MC3T3-E1细胞以1×105/孔的密度接种于12孔板,并制作细胞爬片。按1.4的方法将细胞爬片随机分为4组(每组复3孔),并相应加入含不同浓度黄芪多糖的高糖培养基后,置于37℃、50 mL/L CO2、饱和湿度条件下进行贴壁培养;12 h后分别更换成骨诱导液(含10 mmol/L β-甘油磷酸钠、50 μmol/mL 维生素 C、0.1 μmol/L地塞米松)继续培养,每 3 d换液 1次。分别于成骨诱导培养14、21 d各时间点取各组细胞,弃培养液,并经PBS冲洗3次、40 g/L多聚甲醛室温固定10 min后,用茜素红(pH=4.2)进行染色。然后在体视显微镜下分别观察各组钙化结节形成情况,并通过Image-Pro Plus 6.0图像分析软件计算钙结节的A值。
1.7 高糖环境下APS对MC3T3-E1表达Runx-2、OPN、OCN影响的观察
将对数生长期MC3T3-E1细胞以2×105/孔的密度接种于24孔板,按1.4的方法将细胞随机分为4组,并相应加入含不同浓度黄芪多糖的高糖培养基后,置于37℃、50 mL/L CO2、饱和湿度条件下进行培养。分别于培养后3、7 d取各组细胞,并用Trizol裂解液提取细胞总RNA。用紫外分光光度计(OD260/OD280)检测 RNA的纯度(1.8~2.0)和含量后,将其分别逆转录合成 Runx-2、OPN、OCN的cDNA。然后以cDNA为模板,GAPDH作为内参照,用实时荧光定量PCR仪分别检测各组细胞中各骨活性功能基因(Runx-2、OPN、OCN)的表达,并进行定量分析。PCR反应体系,反应条件均严格按相关试剂盒说明;所用引物由上海生工生物工程公司完成,其具体序列见表1。

表1 骨活性功能基因及其相关引物序列
1.8 高糖环境下APS对MC3T3-E1细胞骨架影响的观察
取对数生长期MC3T3-E1细胞以4×103/孔的密度接种于6孔板,并制作细胞爬片。按1.4的方法将细胞爬片随机4组,并相应加入含不同浓度黄芪多糖的高培养基后,置于37℃、50 mL/L CO2、饱和湿度条件下进行培养。分别于培养3、6、9、12 h取各组细胞(每组每个时间点各3孔),弃培养液,PBS清洗3次后,用40 g/L多聚甲醛室温下固定10 min;PBS清洗30 s,5 mg/mL Triton X-100 透膜5 min;PBS清洗30 s,室温避光环境下滴加200 μL罗丹明-鬼笔环肽,继续孵育30 min;PBS再次清洗30 s后,将各细胞爬片置于滴加有抗荧光猝灭液的载玻片上,激光共聚焦显微镜观察并拍照。
1.9 统计学分析
2 结果
2.1 各组细胞增殖情况比较
MTT数据显示,LDA组和MDA组细胞随培养时间变化,均呈明显的上升趋势(P<0.05);实验各时间点,LDA、MDA组的细胞增殖量均大于HDA组和对照组,差异有统计学意义(P<0.05),但LDA组与MDA组相比,细胞增殖量无显著性差异(P>0.05)(表 2)。
表2 各组MC3T3-E1细胞增殖活性比较()
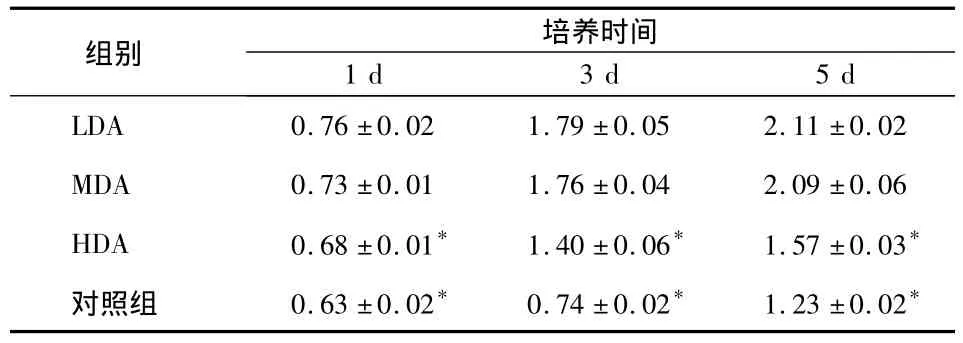
表2 各组MC3T3-E1细胞增殖活性比较()
* 与LDA、MDA组相比P<0.05
组别 培养时间1 d 3 d 5 d LDA 0.76 ±0.02 1.79 ±0.05 2.11 ±0.02 MDA 0.73 ±0.01 1.76 ±0.04 2.09 ±0.06 HDA 0.68 ±0.01* 1.40 ±0.06* 1.57 ±0.03*对照组 0.63 ±0.02* 0.74 ±0.02* 1.23 ±0.02*
2.2 各组细胞的ALP活性比较
ALP检测结果显示,LDA、MDA组细胞的ALP活性随培养时间变化均呈明显上升趋势(P<0.05),但各时间点内两组间相比差异不明显(P>0.05);实验各时间点,LDA、MDA 组细胞的ALP活性均高于HDA组和对照组,差异具有统计学意义(P <0.05)(表3)。
表3 各组MC3T3-E1细胞的ALP活性比较()
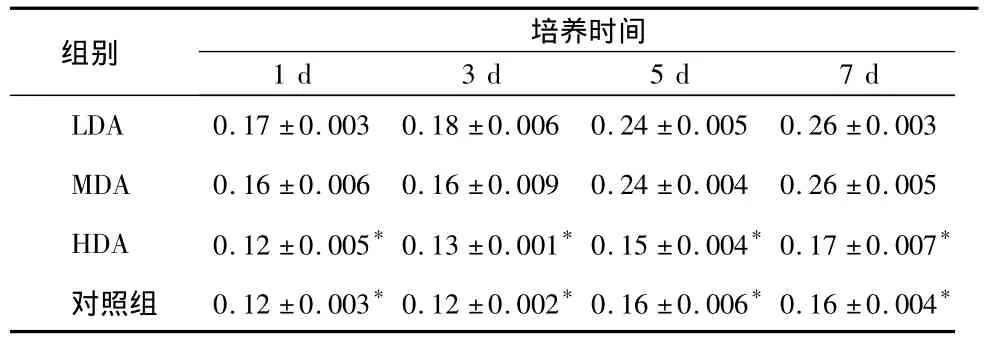
表3 各组MC3T3-E1细胞的ALP活性比较()
* 与LDA、MDA组相比P<0.05
组别 培养时间1 d 3 d 5 d 7 d LDA 0.17 ±0.003 0.18 ±0.006 0.24 ±0.005 0.26 ±0.003 MDA 0.16 ±0.006 0.16 ±0.009 0.24 ±0.004 0.26 ±0.005 HDA 0.12 ±0.005*0.13 ±0.001*0.15 ±0.004*0.17 ±0.007*对照组 0.12 ±0.003*0.12 ±0.002*0.16 ±0.006*0.16 ±0.004*
2.3 各组细胞的矿化能力比较
茜素红染色结果显示,LDA、MDA组细胞钙结节的吸光度值随培养时间变化而呈增加趋势(P<0.05);实验各时间点均以LDA组钙结节的吸光度值最高,由高到低依次为:LDA组>MDA组>HDA组>对照组;各组间两两相比,除HAD组和对照组无统计学差异(P>0.05)外,其余各组间相比均有显著性差异(P<0.05)(表4)。
表4 各组MC3T3-E1细胞的钙结节吸光度值比较()

表4 各组MC3T3-E1细胞的钙结节吸光度值比较()
不同字母组间相比P<0.05
培养时间14 d 21 d LDA 50.06 ±3.38a 83.19 ±1.95组别a MDA 39.21 ±3.62b 52.16 ±2.54b HDA 24.97 ±1.72c 21.57 ±1.64c对照组 16.22 ±0.53c 18.49 ±2.94c
2.4 各组MC3T3-E1中各骨活性基因表达水平
RT-PCR检测结果显示,LDA组Runx-2、OPN、OCN的表达量均随培养时间的延长而明显增加(P<0.05),其他各组各基因的表达量则变化不明显(P>0.05),或呈降低趋势;培养3、7 d各时间点内,LDA组Runx-2、OPN、OCN的表达量均高于MDA、HDA组和对照组,除其OPN的表达量在培养3 d时与MDA组相比无统计学差异(P>0.05)外,其他各时间点各基因的表达量分别与MDA、HAD组和对照组相比,差异均有统计学意义(P<0.05)(图1)。

图1 各组MC3T3-E1细胞中Runx-2、OPN、OCN的mRNA表达量比较
2.5 各组MC3T3-E1细胞骨架结构的比较
LDA组在培养3 h时,细胞呈多角形,肌动蛋白纤维束排列良好;6 h时,细胞呈短梭形不规则分化,纤维结构清晰,有足突状伸展;9 h时,肌纤维结构清晰,细胞长梭形伸展;12 h时,细胞继续伸展,肌纤维贯穿胞体并交织成网状排列(图2)。
MDA组在培养3 h时,细胞呈多角形,纤维束不规则排列;6 h时,细胞形态不规则,可见足突状伸展;9 h时,细胞长梭形变,纤维束规则排列,细胞出现伸展;12 h时,细胞生长,纤维束结构清晰,并贯穿胞体呈平行排列(图3)。
HDA组和对照组在培养3 h时,细胞形态均不规则,纤维排列紊乱;6 h时,细胞分化不明显,纤维结构呈环形排列;9 h时,细胞短梭形分化,纤维结构不规则;12 h时,细胞出现伸展和多角形分化,细胞内肌动蛋白纤维排列相对规则(图4~5)。
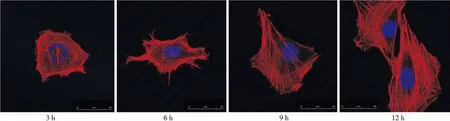
图2 培养3、6、9、12 h时LDA组ME3T3-E1细胞骨架形态(激光共聚焦显微镜,×400)
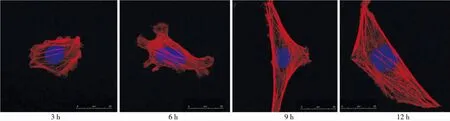
图3 培养3、6、9、12 h时MDA组ME3T3-E1细胞骨架形态(激光共聚焦显微镜,×400)
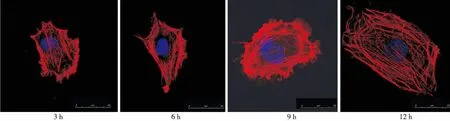
图4 培养3、6、9、12 h时HDA组ME3T3-E1细胞骨架形态(激光共聚焦显微镜,×400)
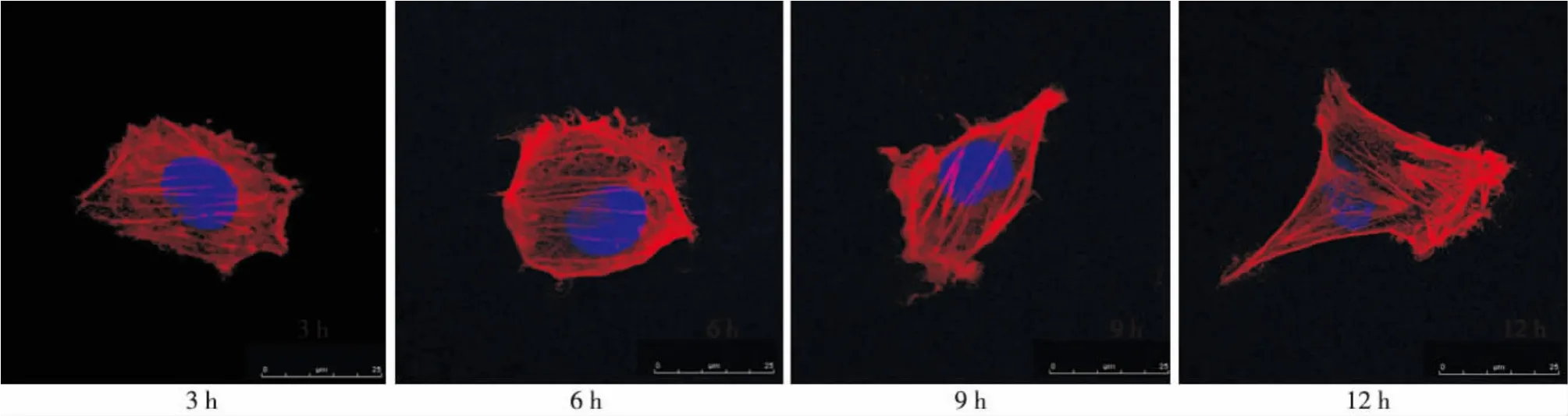
图5 培养3、6、9、12 h时对照组ME3T3-E1细胞骨架形态(激光共聚焦显微镜,×400)
3 讨论
成骨细胞的增殖、分化和矿化活性是影响骨愈合的关键[8]。邹丽宜等[9]发现,黄芪多糖能预防肝纤维化小鼠的骨丢失,提示黄芪多糖是中药抗骨丢失的有效成分之一。王拥军等[10]报道,黄芪多糖对成骨细胞的活性具有双向调节能力,低浓度时对成骨细胞的生物活性具有促进作用,反之则起抑制作用。体外研究证实[11],10 ~100 μg/mL 浓度范围的黄芪多糖可通过调节BMP-2的表达,上调ERK-MAPK、P38-MAPK的磷酸化水平而促进成骨细胞的增殖和分化。短期低浓度APS(0.005 mg/mL)能促进诱导培养BMSCs的代谢和蛋白质的合成[12],有利于细胞的增殖和成骨分化。除此之外,100 μg/mL浓度范围的黄芪多糖还可增强粒-单核祖细胞的抗凋亡能力[13]。王庭祥等[6]报道,黄芪多糖可有效减轻高血糖环境下细胞代谢脂质的毒性作用,并能降低IL-1的表达水平、抑制IL-1诱导的基质金属蛋白酶及相关蛋白的表达。另有研究发现,黄芪多糖不仅可降低糖尿病大鼠血清中TNF-α的水平,同时还可降低IL-1、IL-6的表达,并进而抑制基质金属蛋白酶 2、9的活性[14-15]。
由此可见,黄芪多糖有治疗糖尿病及增加多种类细胞活性的双重作用,应用潜力巨大。故本实验分别通过MTT、ALP、茜素红、RT-PCR和细胞骨架等方法,观察体外高糖环境下不同浓度黄芪多糖对MC3T3-E1细胞的增殖、分化及相关信号基因表达的影响,以期了解黄芪多糖的作用机制及其发挥作用的适宜浓度。
MTT可反映细胞的能量代谢和增殖情况,ALP水平可反映细胞的分化活性,而通过茜素红染色测定细胞钙结节的吸光度值则可了解细胞的矿化能力。MTT和ALP检测结果显示,实验观察第1天时,LDA、MDA组和对照组仅有少量的差异,但第3、5天时,LDA、MDA组细胞的增殖和分化活性则显著升高。钙结节吸光度值结果显示,不同时间点内LDA组细胞钙结节吸光度值均明显高于其他各实验组。以上数据充分说明,0.05~0.5 mg/mL的黄芪多糖是促进MC3T3-E1细胞增殖分化较好的浓度范围,但仅有低浓度的APS(0.05 mg/mL)才能增强高糖环境下成骨细胞的矿化活性。这也与部分学者对犬骨髓基质干细胞的研究结果具有一定程度的一致性[12]。
Runx-2、OPN、OCN的表达与骨的发生、生长及改建等过程均有着密切的关系[16]。Runx-2的表达是成骨细胞开始分化的重要标志,也是成骨过程中最早最特异性的标记基因;高表达的Runx-2可以激活OCN和OPN的转录及表达,并进而促进骨成熟[17]。成骨细胞分泌的OPN在骨吸收、骨基质的矿化和维持骨组织完整性方面,均有非常重要的作用,其介导的细胞粘附是连接细胞与基质的桥梁。OPN的出现,是成骨细胞基质形成和进入矿化成熟阶段的标志[18]。在成骨细胞分泌基质的矿化阶段,机体OPN和OCN表达均显著增加,OCN出现即标志着成骨分化成熟[19]。本结果显示,高糖环境下,LDA组MC3T3-E1细胞中Runx-2、OPN和OCN的表达量均随时间变化而显著增加,且明显高于MDA、HDA组和对照组。以上数据证实,低浓度的APS(0.05 mg/mL)可有效逆转高糖环境下成骨活性基因的低表达情况,可通过提高Runx-2、OPN和OCN的表达,而促进相关信号转导通路的活化。基因表达的变化规律与低浓度APS组MC3T3-E1细胞在增殖、分化和矿化活性方面的变化规律相一致,进一步证实了低浓度的APS对MC3T3-E1细胞活性的促进作用。
细胞骨架可反映APS对成骨细胞超微结构的影响,并进而了解低浓度的APS在高糖环境下对MC3T3-E1细胞活性产生促进作用的机制。细胞骨架系统(cytoskeleton system)是由纤维蛋白质相互搭建起的骨架网状结构,其可以维持细胞形态、帮助细胞游走、辅助细胞粘附、促进细胞伸展和细胞内物质运输。细胞骨架系统主要包括微管(microtubule)、微丝(micro-filament)和中间纤维(intermediate filament)[20]。微丝是由肌动蛋白单体链(G-actin)形成的右手螺旋状的骨架纤维,其中的G-actin不仅是组成F-actin的基础纤维单位,也是构成细胞骨架结构的主要组分。F-actin结构的变化对细胞粘附、伸展有直接影响,并进一步影响细胞的增殖和分化。体外研究证实[21],在成骨细胞附着的早期,F-actin便开始表达。成骨细胞的粘附、增殖、分化是形成骨整合的前提,而细胞的粘附活性则与细胞骨架有着紧密的联系。本结果显示,细胞培养3 h时,LDA、MDA组的细胞分化程度即出现少量差异,其效果均明显优于HDA组和对照组;6 h时,LDA组细胞呈多角形变化,细胞骨架清晰,效果显著优于其他各组细胞,说明细胞在分化方面的差异明显;9 h时,LDA组的细胞出现伸展,细胞内纤维相互平行,提示细胞的增殖活性及附着能力均有所增强,具其效果明显优于其他各组;12 h时,LDA组的细胞骨架交织呈网状,较其他各组细胞骨架结构更为清晰。以上结果提示,高糖环境下 0.05 mg/mL的黄芪多糖能显著促进MC3T3-E1细胞内肌蛋白纤维骨架的伸展和成熟,提高细胞的粘附能力,并进一步促进MC3T3-E1的增殖、分化活性,促进骨整合。
综上所述,低浓度(0.05 mg/mL)的黄芪多糖可通过促进细胞肌动蛋白纤维骨架的成熟和伸展以及增加Runx-2、OPN、OCN的表达水平,逆转高糖环境对MC3T3-E1细胞的不利影响,从而增强MC3T3-E1细胞的增殖、分化和矿化活性。虽然本次实验在黄芪多糖分子机制方面的研究仍存在一定的局限性,但可进一步推断,通过黄芪多糖的缓释、控释,可以有效提高糖尿病患者种植体的骨结合能力和牙周、牙槽骨缺损的愈合效果。其具体缓释控释效果和促进骨愈合的分子机制仍待于进一步研究与证实。
[1]Wang TF,Jen IA,Chou C,et al.Effects of Periodontal Therapy on Metabolic Control in Patients With Type 2 Diabetes Mellitus and Periodontal Disease:a meta-analysis[J].Medicine(Baltimore),2014,93(28):e292
[2]De Morais JA,Trindade-Suedam IK,Pepato MT,et al.Effect of diabetes mellitus and insulin therapy on bone density around osseointegrated dental implants:a digital subtraction radiography study in rats[J].Clin Oral Implant Res,2009,20(8):796-801.
[3]Anner R,Grossmann Y,Anner Y,et al.Smoking,diabetes mellitus,periodontitis,and supportive periodontal treatment as factors associated with dental implant survival:a long-term retrospective evaluation of patients followed for up to 10 years[J].Implant Dent,2010,19(1):57-64.
[4]Freude T,Braun KF,Hang A,et al.Hyperinsulinemia reduces osteoblast activity in vitro via upregulation of TGF-β[J].J Mol Med,2012,90(11):1257-1266.
[5]Erdogan O,Charudilaka S,Tatli U,et al.A review on alveolar bone amgmentation and dental implant success in diabetic patients[J].Oral Surgery,2010,3(1):115-119.
[6]王庭祥,杨贺,钟丽英,等.黄芪多糖毒性试验研究[J].现代预防医学,2009,36(23):4518-4519.
[7]金玺,卞蓉荣,沈山梅.黄芪多糖治疗糖尿病作用机制的研究进展[J].医学综述,2013,19(11):2026-2028.
[8]Ma Y,Zheng Y,Huang X,et al.Mineralization behavior and interface properties of BG-PVA/bone composite implants in simulated body fluid[J].Biomed Master,2010,5(2):1-8.
[9]邹丽宜,吴铁,崔燎.黄芪多糖对肝纤维化小鼠骨丢失的防治作用[J].中西医结合肝病杂志,2002,12(2):95-98.
[10]王拥军,宋莉君,孙爱贞.黄芪多糖的提取及对体外培养成骨细胞成骨能力的影响[J].中国中医骨伤科杂志,1999,7(6):1-4.
[11]He X,Shu J,Xu L,et al.Inhibitory effect of Astragalus polysaccharides on lipopolysaccharide-induced TNF-α and IL-1β production in THP-1 cells[J].Molecules,2012,17(3):3155-3164.
[12]许春姣,翦新春,郭峰,等.黄芪多糖对犬骨髓基质干细胞增殖及超微结构的影响[J].华西口腔医学杂志,2007,25(5):432-436.
[13]Xiao B,Xu Y,He H,et al.Anti-apoptotic effect of Astragalus Polysaccharide on myeloid cells[J].Zhongguo Shi Yan Xue Ye Xue Za Zhi,2013,21(5):1243-1247.
[14]Schrauwen P,Mensink M,Schaart G,et al.Reduced skeletal muscle uncoupling protein-3 content in prediabetic subjects and type 2 diabetic patient:restoration by rosiglitazone treatment[J].J Clin Endocrinol Metab,2006,91(4):1520-1525.
[15]Chen W,Li Y,Yu M,et al.Astragalus polysaccharides:an effective treatment for diabetes prevention in NOD mice[J].Exp Clin Endocrinol Diabetes,2008,116(8):468-474.
[16]Coelho PG,Takayama T,Yoo D,et al.Nanometer-scale features on micrometer-scale surface texturing:a bone histological,gene expression,and nanomechanical study[J].Bone,2014,65(18),25-32.
[17]Kim HJ,Park JW,Lee KH,et al.Plant homeodomain finger protein 2 promotes bone formation by demethylating and activating Runx-2 for osteoblast differentiation [ J].Cell Res,2014,24(10):1231-1249.
[18]Viale-Bouroncle S,Gosau M,Morsczeck C,et al.Collagen 1 induces the expression of alkaline phosphatase and osteopontin via independent activations of FAK and ERK signaling pathways[J].Arch Oral Biol,2014,59(12):1249-1255.
[19]Son JH,Cho YC,Sung IY,et al.Melatonin promotes osteoblast differentiation and mineralzation of MC3T3-E1 cells under hypoxic conditions thromgh activation of PKD/p38 pathway[J].J Pineal Res,2014,57(4):385-392.
[20]Tsai JC,Wu CL,Chien HF,et al.Reorganization of cytoskeleton induced by 5-aminolevulinic acid-mediated photodynamic therapy and its correlation with mitochondrial dysfunction [J].Lasers Surg Med,2005,36(5):398-408.
[21]Nebe B,Finke B,Luthen F,et al.Improved initial osteoblast functions on amino-functionalized titanium surfaces[J].Biomol Eng,2007,24(5):447-454.
