流体静压力调控下Rac1信号通路在大鼠BMSCs成软骨响应中的作用
2015-05-18易飞舟赵寅华
易飞舟,赵 萤,赵寅华,张 旻
(1.解放军第105医院,安徽 合肥 230001;2.军事口腔医学国家重点实验室,陕西省口腔医学重点实验室,第四军医大学口腔医院急诊与综合临床科,陕西 西安 710032)
关节软骨缺损修复是临床医学中的难点,首先软骨组织缺乏血液供应及神经调控,且细胞代谢缓慢,损伤后很难自行修复;其次,修复后的软骨组织结构和功能与正常软骨组织存在差异,极易发生退化,最终影响关节的正常功能。目前采用组织工程软骨成为了修复软骨缺损的新希望。骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)是从骨髓中分离出的纤维样非造血成体干细胞,具有分化为成骨细胞、成软骨细胞、脂肪细胞等潜能[1];加之其易于分离、无免疫原性及可塑性强等特点,目前已成为软骨组织工程的理想种子细胞[2]。而软骨组织为机体的承重组织,需要具备一定的机械性能以承受外界力学作用。因此,近年来关于力学刺激对组织工程细胞的影响引起了广泛的关注。有研究发现,在不同类型的力学刺激下,BMSCs可表现为成脂、成骨及成软骨等多向分化的潜能,但其机理尚不明确[3-4]。
Rac1为Rho家族小G蛋白的成员,其主要功能为调节细胞骨架装配、细胞内基因转录调控及细胞的增殖与凋亡[5]。Rac1在力学刺激下细胞形成板状伪足的过程中,对细胞骨架的装配有重要的调节作用[6-8]。有研究发现,当激活Rac1的活性时,不仅能使BMSCs中钙粘蛋白的表达升高,同时还会提高SOX9、Aggrecan和Col-ⅡmRNA的转录水平;从而促进细胞的软骨向分化[9]。以上研究结果均表明,Rac1可参与介导力学信号的传递,并同时调节细胞的增殖及骨架装配,进而调控BMSCs向成软骨方向分化。因此,根据前期研究结果推测,Rac1可能参与调控流体静压力诱导的BMSCs增殖、骨架装配及软骨向分化的过程。本实验采用流体静压力作用于体外培养的BMSCs,同时给予Rac1激动剂PDGF和拮抗剂NSC23766作用细胞,观察流体静压力对BMSCs周期、骨架及成软骨分化的影响,并探讨Rac1在其中发挥的作用。
1 材料和方法
1.1 主要材料和仪器
SD大鼠(第四军医大学实验动物中心);PDGF(PeproTech,美国);NSC23766(Santa Cruz,美国);FITC-鬼笔环肽(Sigma,美国);α-MEM培养基、2.5 g/L 胰蛋白酶、100 U/mL青霉素、100 U/mL 链霉素(Hyclone,美国);胎牛血清(杭州四季青公司);成软骨诱导液(Cyagen Biosciences,美国);流式细胞仪(BD,美国);激光共聚焦显微镜(Leica,德国);Real-time PCR检测仪(BIO-RAD,美国);可控细胞静态液压加载装置(本课题组自制)。
1.2 大鼠BMSCs体外分离培养和鉴定
1.2.1 大鼠BMSCs的分离培养
采用密度梯度离心法分离培养大鼠BMSCs。取3~4周龄SD大鼠,脱颈椎处死后解剖出股骨,并冲洗出骨髓。所取骨髓经200目筛网过滤后,1 000 r/min离心5 min;然后将细胞重悬于α-MEM培养基(含100 mL/L胎牛血清,100 U/mL青、链霉素)中,37℃、50 mL/L CO2条件下进行培养。3~4 d换液,待细胞融合达80%时,胰酶消化,以1∶2的比例传代培养。
1.2.2 大鼠BMSCs表面标志物鉴定
取生长状态良好的P3代BMSCs,制成密度为1×105/mL的细胞悬液后,取100 μL细胞悬液分别加入 FITC 标记的 CD29、CD44、CD34、CD45;37℃孵育20 min后,将细胞重悬于0.5 mL预冷PBS中,流式细胞仪(FCM)进行检测。
1.3 实验分组设计和力学刺激条件
实验设置空白对照组(C),常规条件下培养;Rac1激动剂组(Rac1+):20 nmol/L PDGF作用细胞 1 h,不加载;Rac1拮抗剂组(Rac1-):100 nmol/L NSC23766作用细胞1 h,不加载;压力组(P):加载90 kPa静压力1 h;Rac1激动剂+压力组(Rac1+/P):20 nmol/L PDGF预处理1 h后,加载90 kPa静压力1 h;Rac1拮抗剂+压力组(Rac1-/P):100 nmol/L NSC23766预处理1 h后,加载90 kPa静压力1 h。
力学刺激采用可控细胞液压加载装置,刺激条件为:90 kPa压强下加载1 h。该压力加载装置的具体特性、操作及压力加载条件的筛选见参考文献[10-12]。
1.4 不同处理对BMSCs细胞周期影响的观察
取生长状态良好的P3代BMSCs,按上述分组进行处理后,胰酶消化并收集各组细胞;调整细胞密度为1×105/mL后,置于预冷的700 mL/L乙醇、4℃下固定24 h。测定前30 min加入PI染液,振荡混匀并避光染色后,用流式细胞仪(FCM)测定各组细胞的周期。
1.5 不同处理对BMSCs细胞骨架影响的观察
取生长状态良好的P3代BMSCs,胰酶消化后用α-MEM培养液重悬,并调整细胞密度为1×104/mL。将细胞悬液接种于含有盖玻片的24孔板中制成细胞爬片后,按上述分组进行处理。分组处理结束后,取各组细胞爬片,分别经40 g/L多聚甲醛液固定、5 μg/mL FITC-鬼笔环肽室温避光染色后,激光共聚焦显微镜下观察并拍照。
1.6 不同处理对 BMSCs成软骨基因表达影响的观察
取生长状态良好的P3代BMSCs,用α-MEM培养液重悬并调整细胞密度为5×105/mL后,置于无菌离心管中室温下150 r/min离心5 min;然后按上述分组加入相应的培养液,并置于37℃、50 mL/L CO2的条件下进行静置培养。培养24 h后,换用成软骨诱导液(含100 nmoL/L地塞米松、10 ng/mL TGF-β3、50 mg/mL 维生素 C、acid 2-phosphate、100 mg/mL丙酮酸钠、40 mg/mL脯氨酸的高糖DMEM培养基),并同时加入ITS-plus(含 6.25 mg/mL 牛胰岛素、6.25 mg/mL 转铁蛋白、6.25 mg/mL 亚硒酸、5.33 mg/mL 亚油酸、1.25 mg/mL牛血清白蛋白)继续静置培养以诱导其分化。诱导期间按分组每天加载90 kPa的静压力1 h,并且始终保持相应组培养基中的Rac1激动剂或拮抗剂的浓度。
于诱导4周后取各组细胞,分别在甲苯胺蓝染色后,光学显微镜下观察并拍照。同时采用Real-time PCR检测成骨标志基因表达:取诱导培养4周的各组细胞用Trizol法提取总RNA,紫外分光光度计测定其浓度和纯度后,采用PrimeScript TMRT-PCR Kit试剂盒合成cDNA。然后以cDNA为模板、β-actin为内参,采用MJ Research DNA Engine Opticon TM2荧光定量PCR仪进行实时定量PCR 反应,分别检测 Sox-9、Aggrecan、COL-Ⅱ各基因的表达情况;并根据所检测Ct值,以2-△△ct法计算各组各基因的mRNA表达水平。PCR反应体系、反应条件严格按试剂盒说明;所用引物序列见表1。

表1 PCR引物序列
1.7 统计学分析
2 结果
2.1 大鼠BMSCs体外培养及形态观察
原代培养3 d时可见BMSCs集落,细胞为三角形或长梭形,呈辐射状排列(图1a);培养7~9 d时,细胞迅速生长且集落出现融合;培养10~12 d时,细胞融合达80%以上,即可进行传代。传代后的BMSCs呈长梭状且形状均一,当细胞融合达80%以上时,细胞排列紧密并旋涡状(图1b)。
2.2 大鼠BMSCs鉴定结果
流式细胞仪检测结果显示,P3代大鼠BMSCs中有 95.8% 表达 CD29,96.4% 表达 CD44,2.1%表达CD34,2.5%表达CD45(图2)。表明所培养的细胞为间充质来源的干细胞,而非造血干细胞。
2.3 各组大鼠BMSCs的细胞增殖活性比较
细胞增殖活性指标包括DNA合成期细胞比例(S-phase fraction,SPF)及增殖指数(proliferation index,PI),计算公式为:SPF=S/(G0/1+S+G2/M)×100%;PI=(S+G2/M)/(G0/1+S+G2/M)×100%。检测结果显示,在Rac1+、P、Rac1+/P组中 DNA合成期的 SPF、PI均显著高于 C组(P<0.05),而 Rac1-组则显著低于C组(P<0.05),说明 Rac1通路的激活及压力都可促进细胞周期的启动和增殖,若Rac1通路被抑制则可阻碍该过程;与 P组相比,Rac1-/P组中的SPF、PI均显著降低(P <0.05),提示 Rac1 通路抑制可阻断压力引起的细胞DNA合成及细胞增殖(图3)。
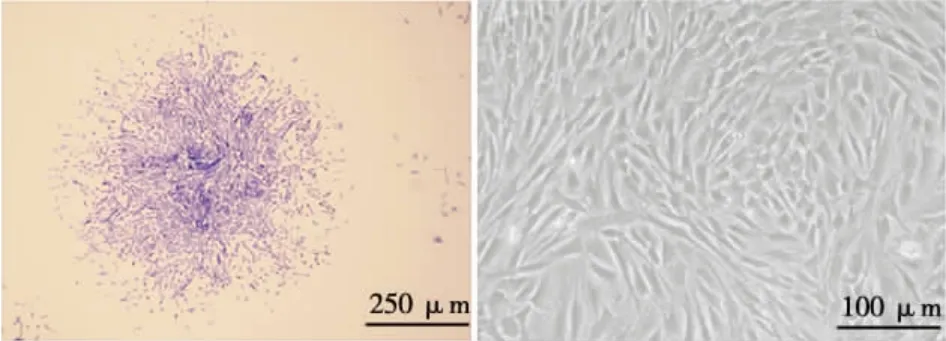
图1 BMSCs细胞形态
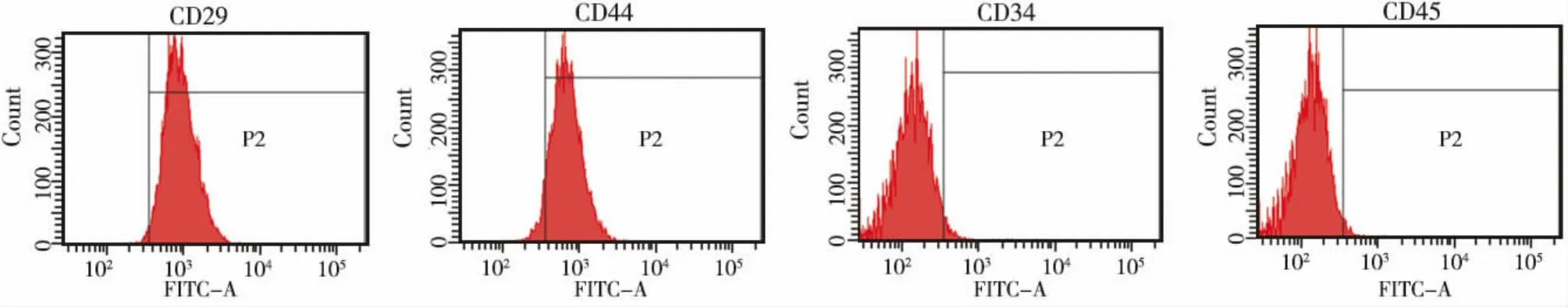
图2 BMSCs细胞表面标记分子检测
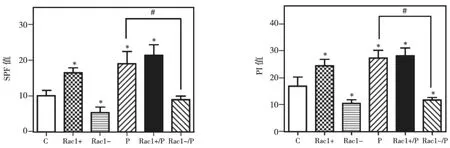
图3 BMSCs细胞增殖活性(*与C组相比P<0.05;#两组相比P<0.05)
2.4 各组大鼠BMSCs的细胞骨架检测结果
激光共聚焦显微镜下可见,C组中F-actin呈丝状,并主要沿细胞长轴排列,贯穿整个细胞;Rac1+组中BMSCs后边缘突起,并形成很多板状伪足;对BMSCs加载压力后,除Rac1-/P组外,其他各组的F-actin纤维束均紧密排列并且明显变粗(图4)。
采用Image-pro plus 6.0软件对各组图像的荧光光密度值(Mean Density)分析显示,P、Rac1-、Rac1-/P组中平均光密度值均明显高于C组(P <0.05),而Rac1+、Rac1+/P组的平均光密度值显著低于C组(P<0.05)(图5)。提示,Rac1通路抑制及流体静压力均可促进BMSCs的细胞骨架装配,而Rac1通路的激活则对细胞骨架的装配有阻碍作用。
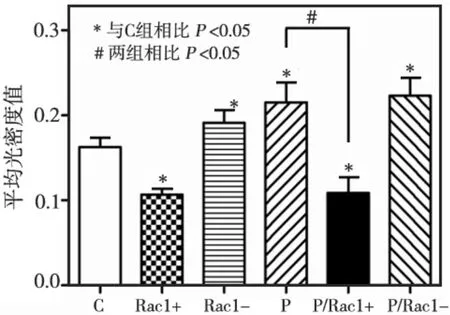
图5 各组BMSCs细胞骨架的光密度值
2.5 各组大鼠BMSCs成软骨标志基因表达水平的比较
成软骨诱导4周后,各组BMSCs均形成细胞团块;甲苯胺蓝染色显示,细胞团块可见蓝色异染颗粒(图6)。BMSCs成软骨诱导4周后RT-PCR检测结果显示,Rac1+、P、Rac1+/P组中成软骨标志基因Sox9、Aggrecan、Col-Ⅱ的表达量均高于C组(P<0.05);与P组相比,Rac1+/P组中各成软骨标志基因的表达量均显著增高(P<0.05),而Rac1-/P组中各成软骨标志基因的表达量均显著降低(P<0.05)(图7)。以上结果提示,Rac1参与流体静压力诱导的BMSCs成软骨向分化的调控,且主要为正向调控。
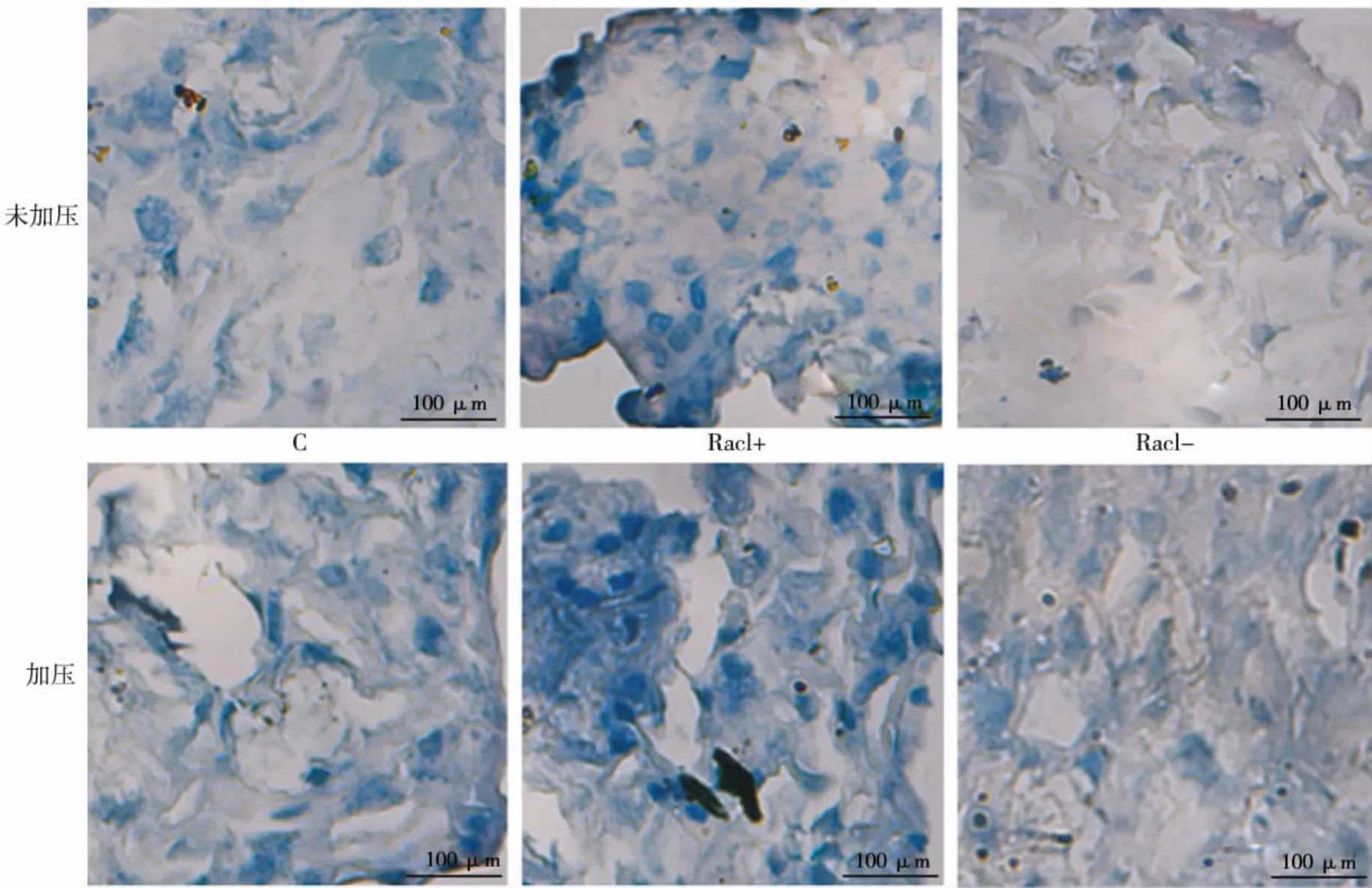
图6 各组BMSCs成软骨诱导4周后甲苯胺蓝染色观察结果
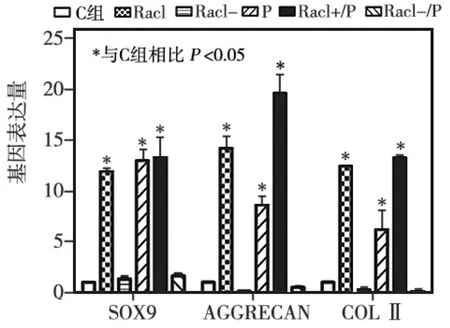
图7 各组各成软骨标志基因表达水平的比较
3 讨论
力学刺激可促进BMSCs增殖,但其机理尚不明确。有研究发现,细胞的G1期启动主要是由细胞周期依赖激酶(CDK)与cyclinD结合以及cyclin E的激活[13-15]。因此,G1周期的启动主要依赖细胞内cyclin蛋白及CDK抑制剂的浓度。另有研究发现,RAC通路可通过整合蛋白启动cyclinD mRNA 翻译[16]及 cyclinD 前体蛋白的表达[17]。本实验中发现,抑制Rac1的活性后可促使压力引发的细胞周期启动发生停滞,提示压力可能通过整合蛋白-Rac-cyclinD通路控制细胞周期的启动,而抑制Rac1的活性则可影响cyclinD蛋白的表达,并最终促使细胞周期发生停滞。
细胞骨架(cytoskeleton)是细胞中纤维组成的网架结构,可为细胞形态的维持、细胞内物质的运输、细胞的黏着及运动等提供支持[18]。而细胞骨架体系是一种受各种因素调控的动态结构,机械信号传导主要依赖F-actin肌动蛋白骨架[19]。本结果显示,激活Rac1可导致板状伪足的形成[20],说明细胞板状伪足的形成主要依赖Rac的活化。而抑制Rac1活性后细胞形态发生明显的变化,且其光密度值显著高于对照组,说明抑制Rac的活性有助于压力作用下应力纤维的装配。
流体静压力作为模拟软骨关节腔中受力的一种力学加载方式[21],对BMSCs向成软骨细胞分化有促进作用[22],并可提高 BMSCs中 Sox9、Aggrecan及ColⅡmRNA的表达量,甚至在缺乏成软骨分化诱导因子(如TGF-β3)的条件下,仍可促进BMSCs向软骨细胞分化[23]。有研究显示,激活Rac1可促进 N-cadherin表达,最终上调 Sox5、Sox6、Sox9、collagenⅡ、Aggrecan mRNA 的转录水平[9]。本结果显示,流体静压力可促进大鼠BMSCs中各成软骨标志基因的表达量显著升高;当在压力条件下激活Rac1时,这种可促进作用更明显,Rac1+/P组中各成软骨标志基因Sox9、Aggrecan及Col-ⅡmRNA的表达量均显著高于P组;而在加压条件下抑制Rac1的活性时,各成软骨标志基因的表达量均较P组显著降低,该结果提示,在压力促BMSCs成软骨分化的过程中部分依赖于Rac1的活性。
本结果提示,在流体静压力导致的细胞周期启动中需依赖Rac1的活性;Rac1在压力引发的细胞骨架装配过程中主要为负向调控作用,而在流体静压力诱导的BMSCs成软骨分化过程中则发挥正向调控作用。
[1]Dezawa M,Kanno H,Hoshino M,et al.Specific induction of neuronal cells from bone marrow stromal cells and application for autologous transplantation[J].J Clin Invest,2004,113(12):1701-1710.
[2]Wei HW,Sun SS,Jao SH ,et al.The influence of mechanical properties of subchondral plate,femoral head and neck on dynamic stress distribution of the articular cartilage[J].Med Eng Phys,2005,27(4):295-304.
[3]Arnsdorf EJ,Tummala P,Jacobs CR.Non-canonical Wnt signaling and N-cadherin related beta-catenin signaling play a role in mechanically induced osteogenic cell fate[J].PLOS One,2009,4(4):e5388.
[4]Miyanishi K,Trindade MC,Lindsey DP,et al.Dose-and time dependent effects of cyclic hydrostatic pressure on transforming growth factor-beta3-induced chondrogenesis by adult human mesenchymal stem cells in vitro[J].Tissue Eng,2006,12(8):2253-2262.
[5]Jaffe AB,Hall A.Rho GTPases:biochemistry and biology[J].Annu Rev Cell Dev Biol,2005,21:247-269.
[6]Masuda M,Fujiwara K.Morphological responses of single endothelial cells exposed to physiologicallevels of fluid shear stress[J].Front Med Biol Eng,1993,5(2):79-87.
[7]Masuda M,Fujiwara K.The biased lamellipodium development and microtubule organizing center position in vascular endothelial cells migrating under the influence of fluid flow [J].Biol Cell,1993,77(3):237-245.
[8]Hu YL,Li S,Miao H,et al.Roles of microtubule dynamics and small GTPaseRac in endothelial cell migration and lamellipodium formation under flow[J].J Vasc Res,2002,39(6):465-476.
[9]Woods A,Wang G,Dupuis H,et al.Rac1 signaling stimulates N-cadherin expression,mesenchymal condensation,and chondrogenesis[J].J Biol Chem,2007,282(32):23500-23508.
[10]Zhang M,Wang JJ,Chen YJ.Effects of mechanical pressure on intracellular calcium release channel and cytoskeletal structure in rabbit mandibular condylar chondrocytes[J].Life Sci,2006,78(21):2480-2487.
[11]Zhang M,Chen YJ,Ono T,et al.Crosstalk between integrin and G protein pathways involved in mechanotransduction in mandibular condylar chondrocytes under pressure[J].Arch Biochem Biophys,2008,474(1):102-108.
[12]Chen YJ,Zhang M,Wang JJ.Study on the effects of mechanical pressure to the ultrastructure and secretion ability of mandibular condylar chondrocytes[J].Arch Oral Biol,2007,52(2):173-181.
[13]Matsushime H,Quelle DE,Shurtleff SA,et al.D-type cyclin-dependent kinase activity in mammalian cells[J].Mol Cell Biol,1994,14(3):2066-2076.
[14]Dulic V,Lees E,Reed SI.Association of human cyclin E with a periodic G1-S phase protein kinase[J].Science,1992,257(5078):1958-1961.
[15]Koff A,Giordano A,Desai D,et al.Formation and activation of a cyclin E-cdk2 complex during the G1 phase of the human cell cycle[J].Science,1992,257(5077):1689-1694.
[16]Mettouchi A,Klein S,Guo W,et al.Integrin-specific activation of Rac controls progression through the G(1)phase of the cell cycle[J].Mol Cell,2001,8(1):115-127.
[17]Welsh CF,Roovers K,Villanueva J,et al.Timing of cyclin D1 expression within G1 phase is controlled by Rho[J].Nat Cell Biol,2001,3(11):950-957.
[18]Ingber DE.The architecture of life[J].Sci Am,1998,278(1):48-57.
[19]Sen B,Guilluy C,Xie Z,et al.Mechanically induced focal adhesion assembly amplifies anti-adipogenic pathways in mesenchymal stem cells[J].Stem Cells.2011,29(11):1829-1836.
[20]Etienne-Manneville S,Hall A.Rho GTPases in cell biology[J].Nature.2002,420(6916):629-635.
[21]Carter DR,Wong M.The role of mechanical loading histories in the development of diarthrodial joints[J].J Orthop Res,1988,6(6):804-816.
[22]Angele P,Yoo JU,Smith C,et al.Cyclic hydrostatic pressure enhances the chondrogenic phenotype of human mesenchymal progenitor cells differentiated in vitro[J].J Orthop Res,2003,21(3):451-457.
[23]Miyanishi K,Trindade MC,Lindsey DP,et al.Effects of hydrostatic pressure and transforming growth factor-beta 3 on adult human mesenchymal stem cell chondrogenesis in vitro[J].Tissue Eng,2006,12(6):1419-1428.
