牙本质支架促进人牙髓干细胞体外增殖与分化能力的研究
2015-05-18杨雪超李晓宁王伟东吕孝帅
杨雪超,李晓宁,王伟东,吕孝帅
(1.广州医科大学附属口腔医院·广州口腔疾病研究所·口腔医学重点实验室,广东 广州 510140;2.烟台市口腔医院牙体牙髓科,山东 烟台 264000)
诱导牙髓干细胞向成牙本质细胞分化是牙本质再生组织工程的关键因素。牙本质与牙髓组织密切接触,是成牙本质细胞产生的胞外基质矿化产物,由于牙本质组织结构具有多孔性,以及脱矿后可以释放生物活性分子的特点,使牙本质成为一种较理想的生物支架。有研究表明,脱矿牙本质覆盖在牙髓表面可诱导其分化为骨样牙本质和管状牙本质[1];经过酸处理的牙本质种植人牙髓干细胞(human dental pulp stem cells,hDPSCs)移植入裸鼠背部8周后,观察到有修复性牙本质样组织生成及陷窝样细胞形成[2];Huang等用EDTA和柠檬酸处理的牙本质片上接种hDPSCs体外培养时发现,有成牙本质细胞突起伸入到牙本质小管内[3]。以上研究提示,经酸处理的牙本质片具有成骨潜能,可作为牙本质支架;但牙本质片经酸处理后常表现出过度脱矿而结构疏松。因此,本实验运用不同根管冲洗剂处理牙本质片,并在其上接种hDPSCs,比较hDPSCs在不同牙本质片增殖分化的能力,以评估何种根管冲洗剂处理能为hDPSCs的粘附和增殖提供较为理想的微环境,并诱导hDPSCs向成牙本质细胞转化。对这种生物学治疗方法的研究,将为临床治疗提供理论依据。
1 材料和方法
1.1 主要试剂和仪器
胎牛血清(FBS)、庆大霉素、α-MEM培养基、2.5 g/L 胰蛋白酶(Gibco,美国);PicoGreen双链DNA定量试剂盒(Molecular Probes,美国);Qiagen RNA提取试剂盒、SYBR Green聚合酶链反应(PCR)试剂盒(Qiagen,美国);四甲基硅烷(Merck,德国);噻唑蓝(MTT)、二甲基亚砜(DMSO)(Sigma,美国);碱性磷酸酶(ALP)活性测定试剂盒(南京建成);手用ProTaper锉、不锈钢K锉(Dentsply,美国);酶标仪(Bio-Tek,美国);荧光定量PCR仪(Bio-Rad,美国);扫描电子显微镜(Tescan,捷克)。
1.2 细胞培养
按照本课题组先前建立的实验方案[4],使用本实验室保存的成人牙髓干细胞作为研究对象。细胞复苏后,用含100 mL/L胎牛血清的α-MEM培养基在常规条件下培养,备用。
1.3 牙本质片的制备
收集年龄在18~20岁因正畸而拔除的完整无龋前磨牙,浸泡于含1 000 U/mL青霉素及1 000 mg/L链霉素的生理盐水中,超声清洁震荡3次×5 min(每次更换生理盐水)。用金刚砂钻或裂钻沿釉牙骨质界磨除牙冠,去除牙髓后,室温下用胰酶消化1 h,去除残存牙周膜及牙髓组织。将牙根浸泡于生理盐水中,超声清洁震荡3次×5 min(每次更换生理盐水)。
将所有牙根随机分成A、B、C组,按逐步深入法进行根管预备:依次使用#10、#15 K锉、手用ProTaper(SX、S1、F1、F2、F3)扩大根管。每次更换器械时,A组用52.5 g/L NaClO冲洗(阴性对照组);B组用30 mL/L过氧化氢液和52.5 g/L Na-ClO交替冲洗;C组用170 g/L EDTA和52.5 g/L NaClO交替冲洗。3组预处理结束后,超声冲洗3次×1 min,PBS冲洗。所有操作均由同一位医生独立完成。选择X线片示预备达到根管工作长度的牙齿作为实验样品。培养的hDPSCs生长于培养板,作为空白对照组(D组)。
用高速裂钻将A、B、C组牙根沿根管长轴纵向磨开,制成纵断牙本质片,暴露根管纵断面,超声冲洗3次×1 min后,转移到EP管中,用含1 000 U/mL青霉素及1 000 mg/L链霉素的PBS浸泡,4℃低温贮存待用。
1.4 hDPSCs与牙本质片复合培养
取第 5代 hDPSCs,弃培养基,PBS冲洗,2.5 g/L胰蛋白酶37℃消化5 min,用含血清培养基终止消化,制成2×105/样本的单细胞悬液。将细胞分别接种于3组牙本质片的根管内壁上;D组细胞直接种于培养液。然后置于含100 mL/L胎牛血清的α-MEM培养基中,在37℃、50 mL/L CO2、饱和湿度条件下常规培养,每2 d换液1次。
1.5 细胞增殖能力的检测
体外培养 hDPSCs第 2、4、7、14天时,各时间段分别经PBS洗涤后,每孔加MTT液(5 mg/mL,用PBS配制,pH为7.4)500 μL继续孵育4 h后终止培养,然后小心吸弃孔内培养液。每孔加200 μL DMSO,振荡10 min,使结晶物充分融解。用酶标仪测定各孔490 nm波长处的吸光度值,以时间为横坐标,吸光度值为纵坐标绘制细胞生长曲线。
1.6 ALP活性的检测
体外培养 hDPSCs第4、7、14天时,冷 PBS洗涤培养复合物3遍,每孔加入200 μL细胞裂解液,室温振荡10 min,并收集上清液。按照试剂盒说明检测标本的ALP活性,酶活性单位为样品中每克蛋白在37℃与基质作用15 min产生1 mg酚为1个金氏单位。
1.7 RT-PCR检测各矿化基因的表达
RT-PCR检测骨钙蛋白(Osteocalcin,OC)、牙本质涎磷蛋白(Dentin sialophosphoprotein,DSPP)及牙本质基质蛋白 -1(dentin matrix protein-1,DMP-1)的表达水平,以评估hDPSCs向成牙本质细胞方向分化的能力。使用Qiagen RNA提取试剂盒提取总RNA,用1 g总RNA进行反转录,以cDNA为模板,GAPDH为内参。人特异性引物根据GenBank中已发布的基因序列设计见表1。25 μL反应条件为:95℃、3 min预变性;40个反应循环设定为95℃、15 s变性,60℃、30 s退火;延伸温度为65℃,反应时间为60 s(反应在荧光定量PCR仪中进行)。反应结束后,各样本获得相应的Ct值,表示达到一个固定的荧光强度需要的PCR反应循环数,Ct值与样本待检测的基因表达水平成反比关系。基因的扩增效率通过GAPDH内参进行标准化(ΔCt=Ct基因-CtGAPDH);不同样本之间基因表达水平差异通过 ΔΔCt(ΔCt基因-ΔCt对照)来评估,每个检测均重复3次。

表1 Real-Time PCR引物序列
1.8 SEM 观察
培养第7、14天时,培养复合物用 PBS漂洗3次,20 mL/L戊二醛液固定5 min,梯度乙醇脱水至1 000 mL/L,滴加四甲基硅烷于室温无尘环境下干燥,常规喷金后SEM观察。
1.9 统计学分析
采用SPSS 11.0软件对数据进行统计分析,组间两两比较用one way-ANOVA(post-hoc Tukey检验),检验水准 α =0.05。
2 结果
2.1 不同根管冲洗剂对hDPSCs增殖能力的影响
hDPSCs冻存复苏后,皆以单细胞方式贴壁生长,细胞呈梭形、纤维样。传代后细胞呈放射状集落生长,形态稳定,生长旺盛(图1)。实验组第2~7天,3组细胞都处于不同程度的增殖状态;第7~12天,3组细胞则表现为增殖停滞,且数量有减少的趋势。组间比较发现,C组细胞增殖速度最快,表明其细胞活力状态最好,增殖能力最强(P<0.05)(图2)。

图1 倒置光学显微镜下第5代hDPSCs(×20)

图2 不同根管冲洗剂处理后3组牙本质片上hDPSCs的生长曲线
2.2 SEM 观察结果
机械预备结合3种不同冲洗方法处理的根管内壁存在明显差异:A组牙本质小管未完全打开,大量玷污层未去除;B组牙本质小管打开,玷污层基本去除;C组可明显看出牙本质小管成漏斗状敞开,玷污层完全去除(图3)。hDPSCs分别接种于牙本质片复合培养后第7天,A、B、C组细胞均伸展充分、粘附良好,交叠生长呈网状覆盖根管内壁(图4)。第14天,C组细胞增殖较快,数量明显多于A、B组,且细胞呈梭形、形状规则、排列整齐、胞体紧贴根管内壁(图5)。
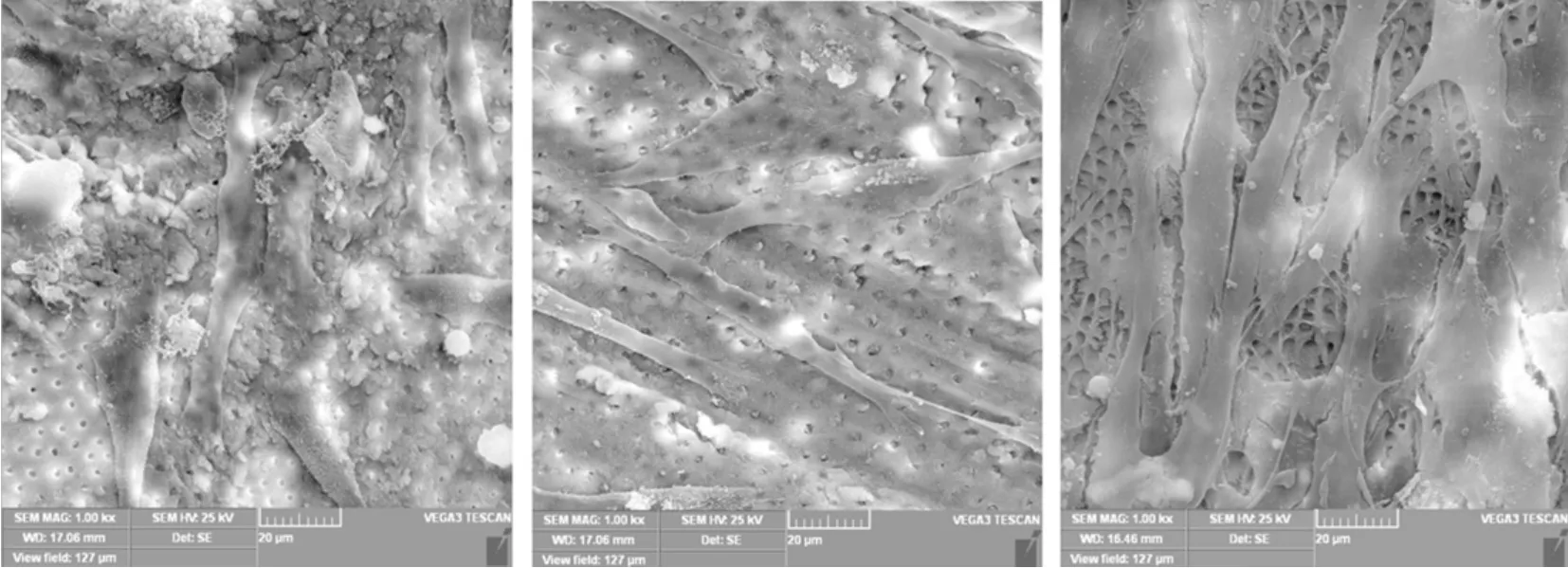
图4 hDPSCs分别接种于3组牙本质片复合培养第7天(SEM,×1 000)

图5 hDPSCs分别接种于3组牙本质片复合培养第14天(SEM,×1 000)
2.3 不同根管冲洗剂对细胞ALP活性的影响
A、B、C组hDPSCs的ALP活性在培养期间均呈现出逐渐升高的趋势。培养第14天时,各组ALP活性均高于其他各时间点(P<0.05)。组间比较显示,培养第4天时,3组细胞的ALP活性无显著性差异;但从第7天开始,C组细胞的ALP活性显著高于A、B、D组,差异具有统计学意义(P<0.05)。与D组相比,3个处理组细胞的ALP活性在培养期间均显著升高(P<0.05)(图6)。
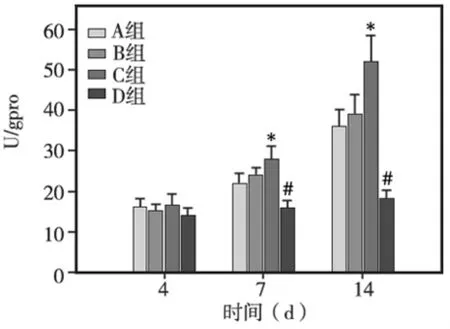
图6 各组细胞的ALP活性
2.4 不同根管冲洗剂对hDPSCs各矿化基因表达的影响
以D组细胞第4天的mRNA表达水平为基线值(相对的表达水平为100%),A、B、C组矿化基因OC、DSPP、DMP-1 mRNA的表达水平显示出相似的变化趋势:第7天时,A、B、C组基因表达水平显著高于D组(P<0.05);第14天时,C组各基因表达水平显著高于A、B、D组(P<0.05)(图7)。
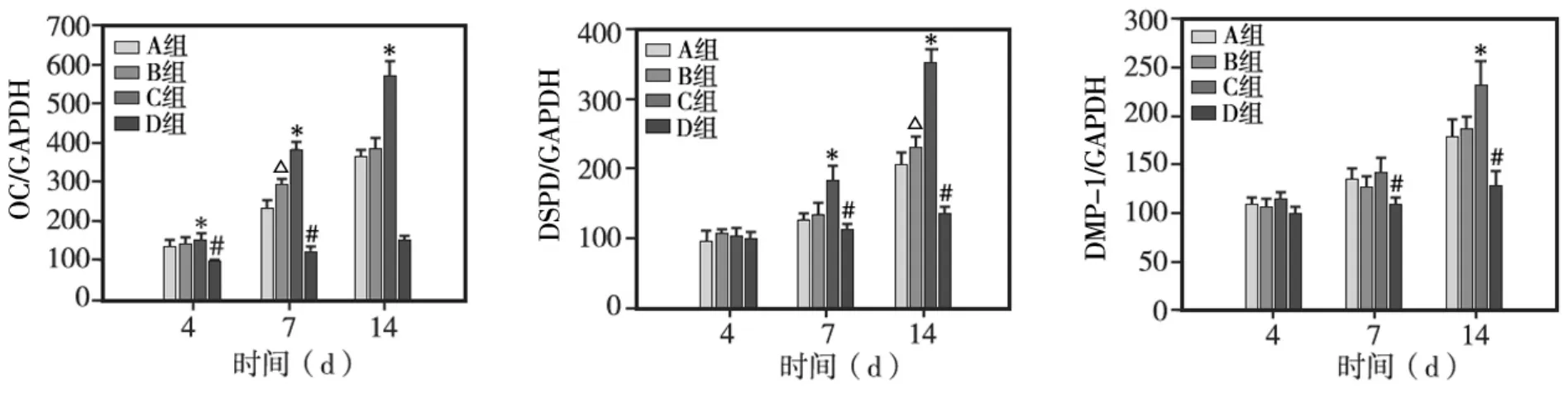
图7 各组hDPSCs各矿化相关基因的表达
3 讨论
诱导牙髓干细胞向成牙本质细胞分化是牙本质再生组织工程的关键因素。而与牙髓干细胞分化方向有关的主要因素之一是细胞生长所处的环境。牙本质与牙髓组织密切接触,是一种富含细胞外基质(约90%胶原蛋白,主要为Ⅰ型胶原蛋白)的无细胞矿化组织。牙本质非胶原蛋白(Dentin non-collagenous proteins,DNCP)主要由牙本质特异性蛋白、非特异性蛋白、生长因子、蛋白多糖及少量脂质等组成;牙本质特异性蛋白包括牙本质磷蛋白(DPP)、牙本质涎蛋白(DSP)及牙本质基质蛋白 -1(DMP-1)等[5]。有研究表明,DNCP对于骨骼、牙齿等硬组织的形成,重要细胞表型分化及生物力学性能都有重要的调控作用,高浓度的DNCP可显著上调大鼠骨髓间充质干细胞的ALP活性和矿化能力[6]。同时牙本质小管的多孔结构可为细胞的粘附、增殖与分化提供结构和机械支持。Smith等发现龋损可导致牙本质脱矿,并能促进与牙本质再生有关生物因子的释放[7]。郭维华等[8]将大鼠牙囊干细胞接种于EDTA处理过的健康牙本质片上,能够分化成牙本质细胞,植入裸鼠体内后,可再生并形成牙本质。Huang等发现,经过弱酸处理的牙本质片,能够支持干细胞的增殖与分化[3]。本实验选择牙本质片作为细胞粘附生长材料,并用不同根管冲洗液冲洗根管壁,使根管壁内形成不同的微环境,研究不同环境下的牙本质对hDPSCs增殖与分化的影响。
临床上常用的根管冲洗液包括52.5 g/L Na-ClO、170 g/L EDTA、30 mL/L过氧化氢等。NaClO具有较强的组织溶解与抑菌消毒作用,但对玷污层中的无机成分无效。NaClO的浓度越高,其组织溶解能力及抗菌性越强,但高浓度的NaClO能刺激或影响正常组织。过氧化氢具有发泡作用,有利于根管内杂质和牙本质碎屑冲出根管。EDTA是一种螯合剂,能与羟基磷灰石中的钙离子形成可溶性络合物,使牙本质软化,有效去除根管壁玷污层中的无机成分,但对玷污层中的有机成分无效且抗菌性能弱。EDTA和NaClO联合应用不仅可以有效去除玷污层中的无机和有机成分,还具有开放牙本质小管的功能,为NaClO向牙本质小管和侧副根管的深入杀菌作用奠定基础[9]。Dogan等发现,EDTA和NaClO的联合使用可改变根管牙本质的矿物质含量,而单独使用EDTA时则不能显著改变矿物质的含量[10],提示EDTA和牙本质的有机物均在脱矿作用中扮演重要角色。本实验采用不同根管冲洗剂预备根管,用处理后的根管内壁牙本质作为支架,在体外与hDPSCs进行复合培养。SEM结果显示A、B、C组上均有牙髓干细胞粘附生长,且C组细胞数目最多,呈梭形,形态似成牙本质细胞,排列较规则。MTT实验结果显示,相同培养时间下,C组细胞数量高于A、B组,也证明了EDTA和NaClO交替冲洗产生的细胞毒性最弱。Ring等[11]通过比较几种根管冲洗剂对DPSCs粘附生长的影响,结果也表明EDTA与NaClO组细胞毒性要弱于单独使用NaClO组。
微环境中存在的生物活性分子对干细胞的分化起重要作用。牙本质被称为“化石”分子的储存库,这些分子具有生物活性,并且他们的释放影响牙髓的反应[12]。通过充分的机械预备、化学处理,牙本质小管完全打开,暴露出大量活性分子位点,释放出可溶性的生物活性分子,形成利于细胞增殖分化的局部诱导微环境。通过检测ALP活性及分化相关特异性基因的表达水平,EDTA与NaClO交替冲洗处理的牙本质更能促进hDPSCs向成牙本质细胞方向分化。其原因可能是本实验中3组不同的处理方式,为牙髓干细胞提供不同的诱导微环境。EDTA能较彻底去除牙本质表面玷污层,充分暴露牙本质小管及胶原纤维,并改善牙本质的渗透性,释放活性因子诱导牙髓干细胞向成牙本质细胞方向分化。
本实验结果显示,经过EDTA和NaClO交替冲洗后的牙本质壁为牙髓干细胞的粘附和增殖提供了较为理解的微环境,并能诱导牙髓干细胞向成牙本质细胞方向分化,为组织工程牙髓再生提供了新思路。此实验方法与临床紧密联系,更适合于临床应用,为一种有效、实用的组织再生牙本质支架处理方法。
[1]李成林,岑远坤,李文,等.脱钙牙本质基质在肌肉中诱导成骨现象的观查[J].中国口腔种植学杂志,1998,3(2):59-61.
[2]Batouli S,Miura M,Brahim J,et al.Comparision of stem-cellmediated osteogenesis and dentinogenesis [J].J Dent Res,2003,82(12):976-981.
[3]Huang GT,Sonoyama W,Chen J,et al.In vitro characterization of human dental pulp cells:various isolation methods and culturing environments[J].Cell Tissue Res,2006,324(2):225-236.
[4]杨雪超,樊明文.成体人牙髓干细胞的分离与鉴定[J].中华口腔医学杂志,2005,40(3):182-185.
[5]Hao J,Ramachandran A,George A.Temporal and spatial localization of dentin matrix proteins during dentin biomineralization[J].J Histochem Cytochem,2009,57(3):227-237.
[6]刘晨晨,雷港,俞艳,等.牙本质非胶原蛋白对大鼠骨髓间充质干细胞增殖活性和矿化能力的影响[J].牙体牙髓牙周病学杂志,2010,20(7):255-259.
[7]Smith AJ,Murray PE,Sloan AJ,et al.Trans-dentinal stimulation of tertiary dentinogenesis[J].Adv Dent Res,2001,15:51-54.
[8]Guo W,He Y,Zhang X,et al.The use of dentin matrix scaffold and dental follicle cells for dentin regeneration[J].Biomaterials,2009,30(35):6708-6723.
[9]Sayin TC,Serper A,Cehreli ZC,et al.Calcium loss from root canaldentin following EDTA, EGTA, EDTAC, and Tetracycline-HCl treatment with or without subsequent NaOCl irrigation[J].J Endod,2007,33(5):581-584.
[10]Do ĝan H,Qalt S.Effects of chelating agents and sodium hypochlorite on mineral content of root dentin[J].J Endod,2001,27(9):578-580.
[11]Ring KC,Murray PE,Namerow KN,et al.The comparison of the effect of endodontic irrigation on cell adherence to root canal dentin[J].J Endod,2008,34(12):1474-1479.
[12]Demarco FF,Casagrande L,Zhang Z,et al.Effects of morphogen and scaffold porogen on the differentiation of dental pulp stem cells[J].J Endod,2010,36(11):1805-1811.
