曲普瑞林兴奋试验评价多囊卵巢综合征患者性腺轴功能
2015-05-17茅江峰徐洪丽伍学焱
茅江峰,聂 敏,徐洪丽,伍学焱
中国医学科学院 北京协和医学院 北京协和医院内分泌科卫生部内分泌重点实验室,北京100730
多囊卵巢综合征 (polycystic ovary syndrome,PCOS)是以排卵异常 (月经稀发或闭经)、雄激素水平升高(生化改变或临床表现)和卵巢多囊改变为特征的一组异质性疾病,常伴有肥胖、胰岛素抵抗和促性腺激素分泌异常[1]。有研究通过12 h或24 h连续监测血黄体生成素 (luteinizing hormone,LH)的方法,证实PCOS患者存在更高频率和更高幅度的LH分泌[2]。但这类检查费时费力,限制了对PCOS患者下丘脑-垂体-性腺轴功能紊乱的研究。曲普瑞林 (triptorelin)是促性腺激素释放激素 (gonadotropin-releasing hormone,GnRH)类似物。它能结合促黄体生成素释放激素(luteinizing hormone releasing hormone,LHRH)受体而促进垂体分泌LH和卵泡刺激素 (follicular stimulating hormone,FSH),用来全面评价下丘脑-垂体-性腺轴的功能,为性腺功能异常疾病的诊治提供更多重要依据。因此,本研究对20例确诊的PCOS患者进行曲普瑞林兴奋试验,探索PCOS患者下丘脑-垂体-性腺轴功能异常的特点和临床意义。
对象和方法
研究对象
2010年5月至2012年5月北京协和医院内分泌科新确诊的多囊卵巢综合征患者20例。诊断须满足以下3个条件[1]:(1)月经稀发或闭经;(2)高雄激素血症的临床或生化改变;(3)B超提示多囊卵巢改变。对照组30例,为北京协和医院体检中心参加体检的月经规律女性。
生化检测和曲普瑞林兴奋试验
所有受试者均签署知情同意书。对照组测定身高、体重、基础状态促性腺激素和性激素水平、空腹血糖和胰岛素水平;进行曲普瑞林兴奋试验:空腹8AM肌肉注射曲普瑞林100μg后,测定0、15、30、45、60和90 min血LH和FSH。PCOS组在完成以上检查同时,行3 h口服糖耐量试验 (3-hour oral glucose tolerance test,3hOGTT)评价胰岛素抵抗和糖代谢异常的程度,行17α羟孕酮和硫酸化脱氢表雄酮检测除外21羟化酶缺陷症 (先天性肾上腺皮质增生症的主要类型)。LH、FSH、雌二醇和睾酮通过第三代化学发光法测定。LH和FSH最小测定值为0.1 U/L。FSH的批内和批间的变异系数分别为3.5%和3.6%,LH的批内和批间变异系数为3.5%和3.7%。
结 果
一般资料
对照组和PCOS 组的睾酮水平分别为 (1.9±0.5)和 (3.5±1.4)nmol/L,PCOS组明显高于对照组 (P=0.012)。PCOS组的体重指数明显高于对照组 [(29.3±2.5)kg/m2比 (24.1 ±2.3)kg/m2,P=0.001];两组在体重、空腹胰岛素水平之间差异也具有统计学意义 (P<0.05);而年龄、身高、空腹血糖的差异无统计学意义 (表1)。
两组LH水平变化
PCOS组的基线LH水平显著高于对照组 [(11.3±6.6)U/L比 (3.7±2.7)U/L,P=0.028]。在曲普瑞林兴奋试验中,PCOS组LH的升高幅度明显大于对照组:在第15分钟,PCOS组和对照组的LH分别为(41.4±28.0)和 (24.7±19.0)U/L(P=0.036)。在第60分钟,PCOS组和对照组的LH分别为 (64.0±34.8)和 (44.8±22.5)U/L(P=0.060)。
两组FSH水平变化
基线状态PCOS组和对照组的FSH分别为 (4.6±2.0)和 (4.9±1.6)U/L(P=0.467)。在曲普瑞林兴奋试验中,PCOS组FSH水平升高幅度小于对照组,在第60分钟,两组FSH水平分别为 (9.9±4.0)和(17.3±5.6)U/L(P=0.046)(图1)。
两组LH/FSH比值变化
基线状态PCOS组和对照组LH/FSH比值分别为2.9±1.1和0.8±0.2(P=0.023)。在注射曲普瑞林后,此比值进一步升高,在第60分钟时两组分别为6.5±1.3和3.1±0.9(P=0.038)(表2)。
讨 论
PCOS是一类发生在育龄期女性、以排卵障碍为主要特征的疾病。临床主要表现为月经紊乱或闭经、雄激素水平升高或多毛、超声显示多囊卵巢改变。此疾病常伴有肥胖、胰岛素抵抗、糖脂代谢紊乱和炎症因子水平升高。因此,PCOS患者发生2型糖尿病和心血管事件的风险显著增加[3-4]。
表1 PCOS组和对照组患者一般资料 (±s)
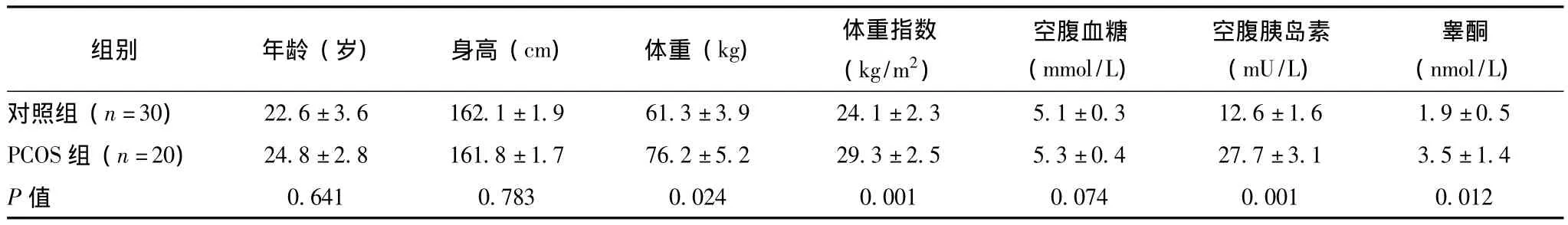
表1 PCOS组和对照组患者一般资料 (±s)
PCOS:多囊卵巢综合征
组别 年龄 (岁) 身高 (cm) 体重 (kg) 体重指数(kg/m2)空腹血糖(mmol/L)空腹胰岛素(mU/L)睾酮(nmol/L)对照组 (n=30) 22.6±3.6 162.1±1.9 61.3±3.9 24.1±2.3 5.1±0.3 12.6±1.6 1.9±0.5 PCOS组 (n=20) 24.8±2.8 161.8±1.7 76.2±5.2 29.3±2.5 5.3±0.4 27.7±3.1 3.5±1.4 P值0.641 0.783 0.024 0.001 0.074 0.001 0.012
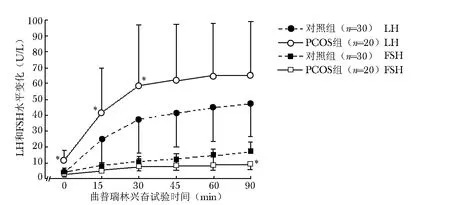
图1 曲普瑞林兴奋试验中PCOS组和对照组LH和FSH的变化趋势
表2 曲普瑞林兴奋试验中PCOS组和对照组LH、FSH和LH/FSH比值随时间的变化 (±s)
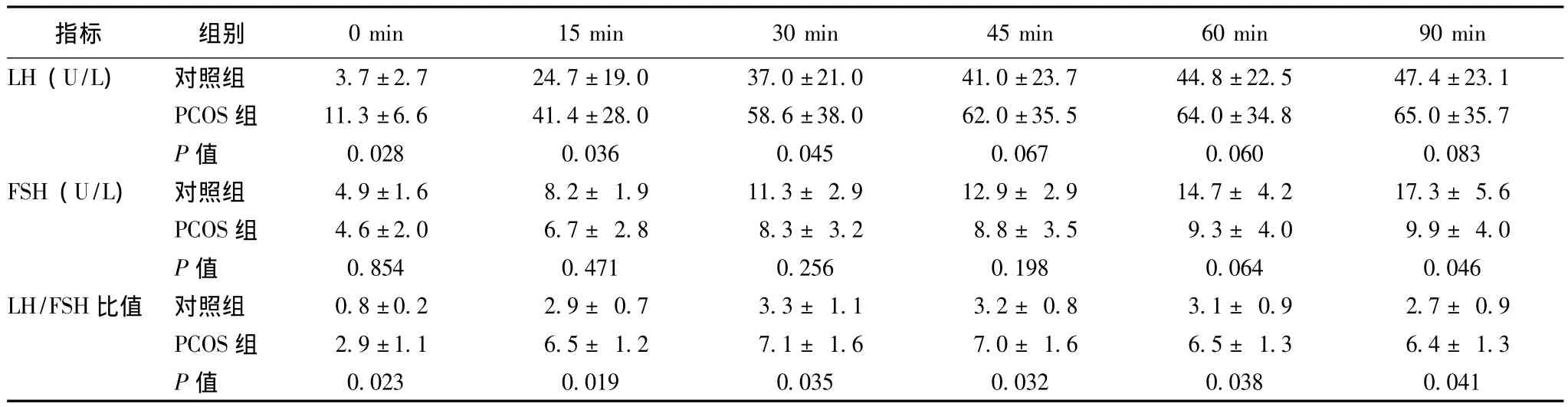
表2 曲普瑞林兴奋试验中PCOS组和对照组LH、FSH和LH/FSH比值随时间的变化 (±s)
PCOS:同表1;LH:黄体生成素;FSH:卵泡刺激素
0 min 15 min 30min 45min 60 min 90 min LH(U/L) 对照组 3.7±2.7 24.7±19.0 37.0±21.0 41.0±23.7 44.8±指标 组别22.5 47.4±23.1 PCOS组 11.3±6.6 41.4±28.0 58.6±38.0 62.0±35.5 64.0±34.8 65.0±35.7 P值 0.028 0.036 0.045 0.067 0.060 0.083 FSH(U/L) 对照组 4.9±1.6 8.2±1.9 11.3±2.9 12.9±2.9 14.7±4.2 17.3±5.6 PCOS组 4.6±2.0 6.7± 2.8 8.3± 3.2 8.8± 3.5 9.3± 4.0 9.9± 4.0 P值 0.854 0.471 0.256 0.198 0.064 0.046 LH/FSH比值 对照组 0.8±0.2 2.9±0.7 3.3±1.1 3.2±0.8 3.1±0.9 2.7±0.9 PCOS组 2.9±1.1 6.5± 1.2 7.1± 1.6 7.0± 1.6 6.5± 1.3 6.4± 1.3 P值0.023 0.019 0.035 0.032 0.038 0.041
本研究纳入的PCOS患者总体偏胖 (平均BMI 29.3 kg/m2),其基础LH水平和LH/FSH比值显著升高。在曲普瑞林兴奋试验中,LH升高的速度和幅度明显高于对照组。这证实了PCOS患者垂体促性腺激素细胞的储备和分泌LH功能存在异常。患者排卵障碍和血雄激素水平增高,可能与此相关。García-Rudaz等[2]通过12 h连续测定LH水平,发现PCOS患者LH分泌的频率和幅度增加,计算所得LH曲线下面积增加。Veldhuis等[5]也通过类似方法证实了LH异常过多分泌。本研究通过更简便的方法,进一步证实了以上结论。
LH分泌受多种因素调控:在一定范围内,下丘脑分泌LHRH频率增加或循环中雌激素水平升高,均可刺激垂体分泌LH[6]。肥胖相关炎症因子也可能促进垂体分泌LH异常升高[7]。一些胰岛素受体功能异常导致严重胰岛素抵抗的患者,可表现为多囊卵巢、雄激素明显升高和LH水平明显升高,提示过高的胰岛素水平可通过卵巢滤泡上皮的胰岛素样生长因子-1受体引起卵巢多囊改变,这种现象又称为“胰岛素溢出效应”[8]。卵巢持续产生过高的雌二醇,通过下丘脑室旁核的Kiss/GRP54系统,正反馈促进下丘脑-垂体系统分泌过多LH[6,9]。如上所述,PCOS患者LH水平升高和多囊卵巢/睾酮水平升高有关,但两者之间的因果关系,在不同发病机制导致的PCOS患者中存在差异[10]。并非所有PCOS患者LH水平均有升高,这可能和不定期排卵造成孕酮水平升高有关,因为孕激素可抑制垂体LH分泌[11]。
本研究首次发现,垂体存在LH异常高分泌的同时,还存在FSH异常分泌,表现在以下方面:在基础状态,LH/FSH比值明显升高;曲普瑞林兴奋试验中,FSH水平虽然有所升高,但升高的幅度明显低于对照组[90min FSH分别为 (17.3±5.6)和 (9.9±4.0)U/L,P=0.046];注射曲普瑞林后,PCOS组的LH曲线和FSH曲线之间的分离趋势明显大于对照组 (图1)。因为FSH对卵泡募集和形成具有重要作用,因此其分泌功能降低也可能导致排卵异常。
曲普瑞林是LHRH类似物,能够和垂体LHRH受体结合,促进垂体分泌FSH和LH。因其生物学活性是天然LHRH的100倍,且半衰期延长到12 h,故可用来评价垂体促性腺激素的储备功能[12]。试验过程简单,费用远低于12 h连续LH监测,为全面评价PCOS患者的下丘脑-垂体-卵巢轴功能异常提供了一个有力的工具。
总之,本研究显示,肥胖PCOS患者促性腺激素分泌异常,LH分泌增加和LH/FSH比值升高;曲普瑞林兴奋试验可进一步放大显示促性腺激素异常分泌的模式。进一步阐明PCOS患者下丘脑-垂体-卵巢轴功能异常的机制,可为疾病治疗提供新靶点。
[1] Carmina E.Diagnosis of polycystic ovary syndrome:from NIH criteria to ESHRE-ASRM guidelines[J].Minerva Ginecol,2004,56:1-6.
[2] García-RudazMC,Ropelato MG,Escobar ME,et al.Augmented frequency andmassof LH discharged per burstare accompanied bymarked disorderlinessof LH secretion in adolescentswith polycystic ovary syndrome[J].Eur JEndocrinol,1998,139:621-630.
[3] González F.Nutrient-induced inflammation in polycystic ovary syndrome:role in the development ofmetabolic aberration and ovarian dysfunction[J].Semin Reprod Med,2015,33:276-286.
[4] PeignéM,Dewailly D.Long term complications of polycystic ovary syndrome(PCOS)[J].Ann Endocrinol(Paris),2014,75:194-199.
[5] Veldhuis JD,Pincus SM,Garcia-RudazMC,etal.Disruption of the synchronous secretion of leptin,LH,and ovarian androgens in nonobese adolescents with the polycystic ovarian syndrome[J].JClin Endocrinol Metab,2001,86:3772-3778.
[6] Gottsch ML,Clifton DK,Steiner RA.Kisspepeptin-GPR54 signaling in the neuroendocrine reproductive axis[J].Mol Cell Endocrinol,2006,254-255:91-96.
[7] Glintborg D,Andersen M.An update on the pathogenesis,inflammation,and metabolism in hirsutism and polycystic ovary syndrome[J].Gynecol Endocrinol,2010,26:281-296.
[8] Mukherjee S,Maitra A.Molecular and genetic factors contributing to insulin resistance in polycystic ovary syndrome[J].Indian JMed Res,2010,131:743-760.
[9] Kauffman AS.Coming of age in the Kisspeptin Era:Sex differences,development,and puberty[J].Mol Cell Endocrinol,2010,324:51-63.
[10] Guastella E,Longo RA,Carmina E.Clinical and endocrine characteristics of themain polycystic ovary syndrome phenotypes[J].Fertil Steril,2010,94:2197-2201.
[11] Dafopoulos K,Venetis C,Pournaras S,etal.Ovarian control of pituitary sensitivity of luteinizing hormone secretion to gonadotropin-releasing hormone in women with the polycystic ovary syndrome[J].Fertil Steril,2009,92:1378-1380.
[12] 曲普瑞林[M]//药物临床信息参考.成都:四川科学技术出版社,2004:869-870.
