细胞外半胱氨酸/胱氨酸氧化还原电位对NAFLD肝细胞线粒体功能的影响
2015-05-16官清华丁启龙中国药科大学药学医学基础实验教学中心江苏南京211198
官清华,丁启龙(中国药科大学药学医学基础实验教学中心,江苏南京211198)
细胞外半胱氨酸/胱氨酸氧化还原电位对NAFLD肝细胞线粒体功能的影响
官清华,丁启龙△
(中国药科大学药学医学基础实验教学中心,江苏南京211198)
[摘要]目的:研究细胞外半胱氨酸/胱氨酸氧化还原电位( EhCys/CySS)对非酒精性脂肪肝( NAFLD)肝细胞线粒体功能的影响。方法:用EhCys/CySS分别为0 mV(氧化)、-80 mV(正常)和-150 mV(还原)的氧化还原培养基培养肝细胞株LO2并采用油酸诱导细胞建立NAFLD模型。荧光探针DCFH-DA和MitoSOX分别检测细胞整体水平和线粒体活性氧簇( ROS)生成,使用apocynin( NADPH氧化酶抑制剂)和MitoQ(10)(靶向线粒体抗氧化剂)、rotenone(线粒体呼吸链复合体I抑制剂)和antimycin A(线粒体呼吸链复合体Ⅲ抑制剂)作用细胞检测线粒体复合体活性从而探究ROS的来源,JC-1检测细胞线粒体膜电位。结果:油酸诱导的NAFLD细胞模型使肝细胞内ROS增多,线粒体膜电位下降;氧化的EhCys/CySS加剧了NAFLD肝细胞ROS的生成以及线粒体膜电位的下降,而还原的EhCys/CySS能清除ROS并逆转线粒体膜电位的下降。线粒体ROS清除剂MitoQ(10)能显著地减少氧化的EhCys/CySS所增加的ROS,而apocynin效果不明显。Rotenone作用于细胞后,ROS的增长率与细胞外EhCys/CySS有关,氧化状态下ROS增长率最小且复合体I活性减弱,即氧化的EhCys/CySS能通过抑制线粒体复合体I增加ROS的生成。结论:氧化的EhCys/CySS能通过抑制线粒体复合体I,从而加剧NAFLD肝细胞ROS的生成,并使线粒体膜电位进一步下降,而还原的EhCys/CySS能减少高脂所致ROS生成并减轻线粒体损伤。
[关键词]半胱氨酸/胱氨酸氧化还原电位;活性氧;非酒精性脂肪肝;线粒体
如今,越来越多的研究者关注细胞外氧化还原状态对细胞内过程及细胞功能的调控作用。Jones等[1-2]研究发现半胱氨酸( cysteine,Cys) /胱氨酸( cystine,CySS)电对是人体血浆中最主要的小分子量硫醇/二硫化物物质对,Cys/CySS电对的电位( Eh)能用来评价及量化细胞外的氧化还原状态,且人正常血浆EhCys/CySS为-80 mV,氧化的血浆电位( EhCys/CySS>-62 mV)往往伴随着疾病。基于这一理论,大量研究证明EhCys/CySS能调节许多重要的细胞内过程,包括增殖、黏附、分化及凋亡[3-6],涉及多种代谢性疾病的发生发展过程,包括动脉粥样硬化、肥胖和糖尿病[4-5,7]。此外,继Jones等[2]发现2型糖尿病、化疗及心血管疾病的早期症状伴随血浆EhCys/CySS氧化,Imhoff等[5]研究表明高脂饮食会导致C57B16小鼠血浆EhCys/CySS氧化,氧化的EhCys/CySS能加剧脂肪细胞脂质生成,而还原的EhCys/CySS能减少脂肪细胞中脂质的含量。由此可见,血浆中EhCys/CySS在高脂致脂质代谢性疾病的形成过程中可能起着重要的调控作用。高脂饮食所致的非酒精性脂肪肝( nonalcoholic fatty liver disease,NAFLD)作为常见的脂质代谢性疾病,常常是肥胖、糖尿病和动脉粥样硬化的并发症。既往研究表明在高脂所致的NAFLD的发生发展过程中,氧化应激起着关键作用[8]。因此,本实验主要观察细胞外EhCys/CySS对高脂培养的LO2肝细胞ROS生成、来源及线粒体功能的研究,以进一步了解高脂致NAFLD的病理生理机制。
材料和方法
1实验材料
1.1实验细胞LO2人正常肝细胞株由中国药科大学药学医学基础实验教学中心提供。
1.2主要实验仪器及试剂Olympus BX51型荧光显微镜; Thermo Scientific Varioskan Flash全波长扫描式多功能读数仪; DMEM、Cys-free DMEM培养基( Gibco) ; Cys、CySS( AMRESCO) ;荧光探针MitoSOX ( Invitrogen) ;油酸、荧光探针DCFH-DA、antimycin A ( Sigma) ; apocynin( TCI) ; Rotenone(阿拉丁公司)。Cys、CySS储备液:取适量Cys和CySS溶于Cys-free DMEM,分别配成10 mmol/L的Cys和10 mmol/L的CySS储备液。
2实验方法
2.1细胞培养及分组将LO2细胞培养于DMEM培养基(含10%新生牛血清及青霉素-链霉素)中,置于37℃、5% CO2、具有一定湿度的细胞培养箱中孵育,2 d换1次液。传代分瓶设对照( control,C)组和油酸( oil acid,OA)组,每组又设有0 mV(氧化)、-80 mV(正常)和-150 mV(还原)电位梯度,每3 h换新鲜电位培养基至细胞达到80%,OA组加油酸再孵育6 h且油酸终浓度为0. 3 mmol/L,模拟高脂饮食造肝细胞NAFLD模型[9]。
2.2Cys/CySS电位液的配置根据人血浆中Cys 和CySS浓度[10],调节Cys-free DMEM培养基中Cys 和CySS浓度,配制成相应的电位液。即将10 mmol/ L的Cys和CySS储备液添加到Cys-free DMEM中得到不同的EhCys/CySS电位液[11],电位的计算符合能斯特方程: Eh=-250 +30 log([CySS]/[Cys]2) (电位单位: mV;浓度单位: mol/L)。配置1 mL EhCys/ CySS电位液所需的CySS和Cys储备液量见表1[3]。

表1 Cys/CySS电位液中Cys和CySS的浓度Table 1.Redox media formulations with Cys and CySS
2.3荧光显微镜及全波长扫描式多功能读数仪检测ROS[5]细胞用电位液和油酸处理后,吸弃培养基,PBS洗2次,用检测活性氧的荧光探针DCFH-DA ( 10 μmol/L,检测细胞内的ROS,激发波长488 nm,发射波长530 nm)或者MitoSOX( 5 μmol/L,检测线粒体内的ROS,激发波长510 nm,发射波长580 nm) 于37℃分别继续孵育细胞30 min和10 min。然后用PBS洗3次,除去未进入细胞的荧光探针。加入2 mL PBS,荧光显微镜检测拍照并传代法收集细胞,全波长扫描式多功能读数仪检测各组荧光强度,实验重复3次。
2.4荧光显微镜检测线粒体膜电位细胞用电位液和油酸处理后,吸弃培养基,PBS洗2次,加入JC-1染液,使终浓度为1. 5 mg/L,37℃孵育30 min,PBS 洗3遍后用荧光显微镜检测。当JC-1浓度低或膜电位水平低时,主要以单体形式存在,激发波长为527 nm,呈绿色荧光;当JC-1浓度升高或线粒体膜电位水平较高时,形成聚合物,发出红色的荧光,激发波长为590 nm[12]。线粒体对JC-1的摄取依赖于跨膜电位,正常的肝细胞线粒体膜电位高,呈现红色荧光;细胞损伤后,线粒体膜电位下降呈现由红色到绿色的荧光转变[13]。应用Image-Pro Plus 6. 0专业图像分析软件对荧光图片进行统计分析。
3统计学处理
采用SPSS 10. 0统计软件分析,数据以均数±标准差( mean±SD)表示,组间比较采用t检验,以P<0. 05为差异有统计学意义。
结果
1细胞外EhCys/CySS对高脂培养LO2细胞ROS生成的影响
以0. 3 mmol/L油酸处理LO2细胞造肝细胞NAFLD模型。用活性氧荧光探针DCFH-DA和MitoSOX分别标记细胞内和线粒体内ROS,荧光显微镜下拍照,荧光酶标仪检测ROS强度。与C组相比,相同EhCys/CySS下,油酸使OA组细胞内绿色荧光和线粒体内红色荧光增强,即ROS增多;各组中氧化的细胞外状态( 0 mV)下细胞内和线粒体内荧光明显增强,表明ROS增多,而还原的细胞外状态(-150 mV)下的细胞相应指标均减弱,见图1。

Figure 1.The effects of EhCys/CySS on ROS generation in the OA treated LO2 cells (×400).Mean±SD.n =6.##P<0. 01 vs C(-150 mV) group;*P<0. 05,**P<0. 01 vs C (-80 mV) group;△△P<0. 01 vs C( 0 mV) group;+ +P<0. 01 vs OA(-80 mV) group.图1 EhCys/CySS对NAFLD肝细胞ROS生成的影响
2氧化的细胞外状态下LO2细胞ROS的来源
既往研究发现,细胞内ROS来源主要是线粒体和NADPH氧化酶。为了了解氧化的细胞外状态( 0 mV)作用下LO2细胞ROS的来源,实验中使用NADPH氧化酶抑制剂apocynin[14]和线粒体内ROS清除剂MitoQ10[15]处理氧化状态下培育的细胞。结果显示,由氧化的EhCys/CySS增加的细胞内ROS,在apocynin的作用下轻微地减少了,而MitoQ10使增加的ROS显著地减少了( P<0. 01),见图2。
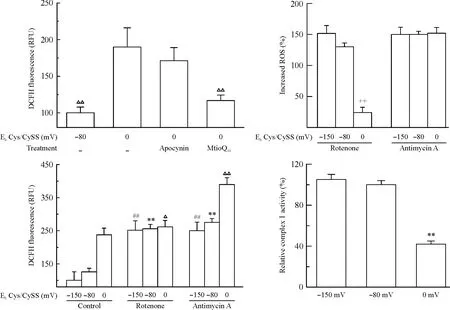
Figure 2.The source of ROS in the LO2 cells treated with the oxidized EhCys/CySS.Mean±SD.n =6.△P<0. 05,△△P<0. 01 vs C( 0 mV) ;##P<0. 01 vs C(-150 mV) ;**P<0. 01 vs C(-80 mV) ;+ +P<0. 01 vs rotenone(-80 mV).图2 氧化的EhCys/CySS作用下LO2细胞ROS的来源
3氧化的EhCys/CySS抑制线粒体复合体I活性
由上面的实验可知,氧化的细胞外状态下LO2细胞ROS主要来源于线粒体。为了进一步探究线粒体内ROS产生机制,实验针对线粒体呼吸链产生ROS的环节,选择线粒体复合体I和III的抑制剂,rotenone( 2 μmol/L)和antimycin A( 5 μmol/L)[16]。实验结果显示,2种抑制剂作用后都使细胞ROS生成增加;但是antimycin A孵育细胞后,各组细胞ROS的增加率与细胞外EhCys/CySS无关,而复合体I抑制剂rotenone作用后ROS的增加率与细胞外EhCys/ CySS呈相关趋势,即0 mV时增加了23. 5%,-150 mV时增加了151. 6%。实验说明氧化的EhCys/ CySS可能通过抑制线粒体复合体I活性来增加ROS的生成。
使用线粒体呼吸链复合体I活性检测试剂盒进一步验证实验假设。结果显示0 mV时线粒体复合体I的活性只有正常状态下细胞的42%,而-150 mV时细胞复合体I活性轻微增强,实验结果进一步证明了氧化的EhCys/CySS通过抑制线粒体复合体I活性来增加ROS的生成,见图2。
4细胞外EhCys/CySS对LO2细胞线粒体膜电位的影响
如图3所示,与C组相比,油酸使OA组细胞线粒体膜电位下降,JC-1染色由红色向橙色转变,绿色荧光与红色荧光的比值由65%增长到82% ( P<0. 01) ;与正常生理状态(-80 mV)相比,氧化状态( 0 mV)使NAFLD肝细胞线粒体膜电位进一步下降,JC-1染色由橙色向绿色转变,绿色/红色荧光比值由82%增长到110%( P<0. 01) ;还原状态(-150 mV)逆转了NAFLD肝细胞线粒体膜电位的下降,JC-1染色呈红色,绿色/红色荧光比值由82%降低到71%( P<0. 05),见图3。
讨论
与正常肝脏相比,脂肪肝肝细胞脂质沉积增加了线粒体β-氧化,ROS增多造成氧化应激,ATP生成减少,线粒体功能紊乱。能量代谢障碍越严重,肝细胞对脂肪的处理转运能力越低,肝细胞中脂质沉积也越多,形成恶性循环,这在NAFLD发病机制中起重要作用[8]。Cys/CySS组成了人血浆中最主要的低分子量硫醇/二硫化物物质对[1],肥胖、糖尿病、化疗、酗酒、抽烟等往往伴随着血浆中EhCys/CySS的氧化[2],越来越多研究表明氧化的EhCys/CySS与脂质代谢性疾病的危险因素有关。Imhoff等[5]研究表明高脂饮食会导致小鼠血浆EhCys/CySS氧化,细胞实验进一步说明细胞外液氧化的EhCys/CySS能加剧脂肪细胞脂质生成,而还原的EhCys/CySS能改善脂质沉积。Thong等[17]研究发现N-乙酰半胱氨酸能改善非酒精性脂肪性肝炎大鼠氧化应激和肝脂质沉积及炎症症状。而且,N-乙酰半胱氨酸作为L-cysteine的前体,能使血浆中EhCys/CySS还原[18]。因此,血浆中氧化的EhCys/CySS可能对NAFLD发生发展起重要作用。
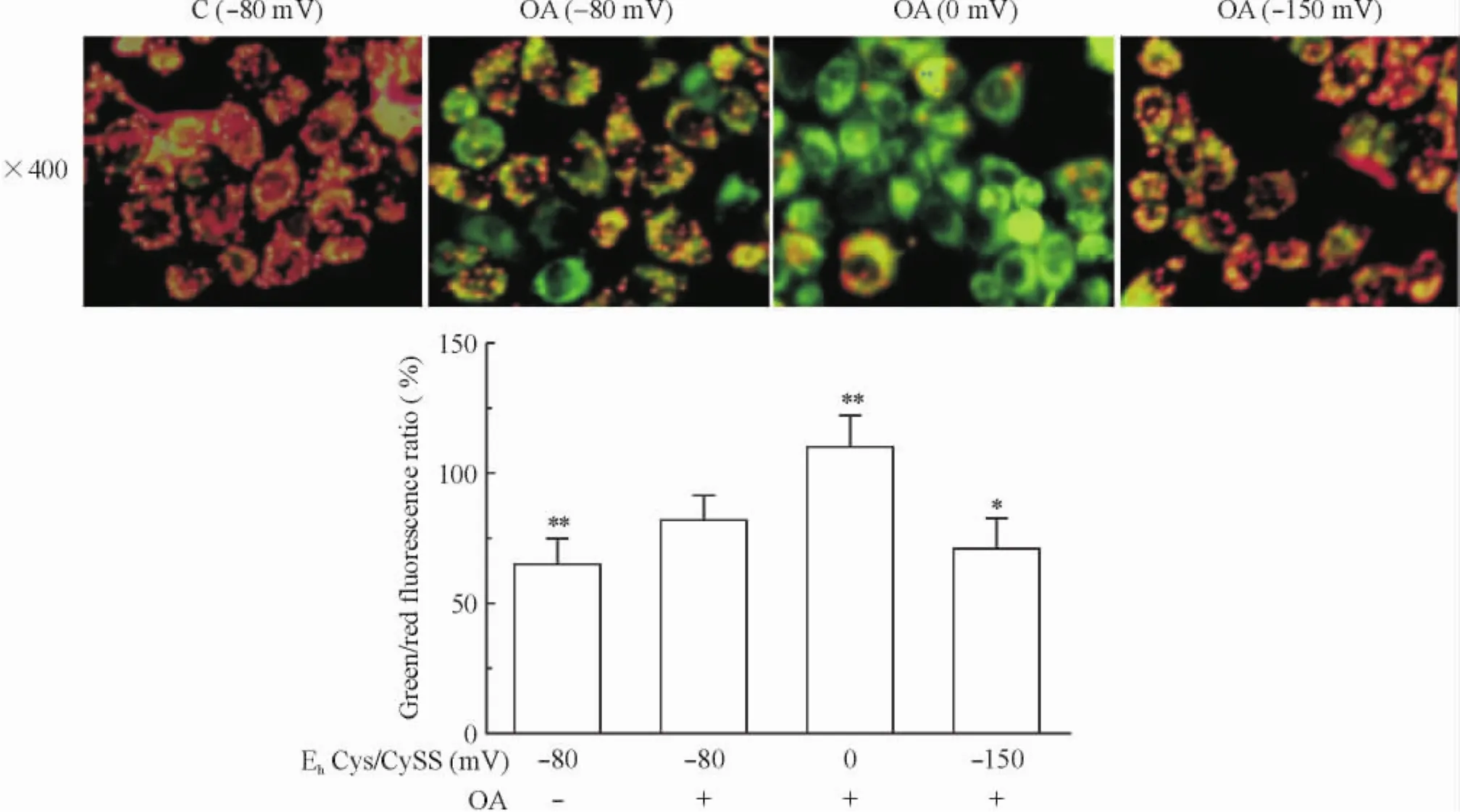
Figure 3.The effects of EhCys/CySS on the mitochondrial membrane potential of OA treated LO2 cells.Mean±SD.n = 6.*P<0. 05,**P<0. 01 vs OA(-80mV).图3 EhCys/CySS对LO2细胞线粒体膜电位的影响
本研究通过细胞实验,以Cys、CySS和Cys-free DMEM培养基模拟人体氧化、正常和还原的细胞外环境培育LO2细胞并以油酸建立NAFLD模型。研究中发现油酸NAFLD模型能使细胞ROS增加线粒体膜电位降低,而氧化的EhCys/CySS( 0 mV)加剧了ROS的生成并使线粒体膜电位进一步下降,还原的EhCys/CySS(-150 mV)能清除ROS并纠正降低的膜电位。线粒体ROS清除剂MitoQ10显著减少了由氧化EhCys/CySS所增加的ROS。线粒体复合体I抑制剂rotenone作用于细胞后,ROS的增长率与细胞外EhCys/CySS有关,0 mV时ROS的增长率很小并且线粒体复合体I活性减弱。实验说明,对于高脂培养的LO2肝细胞,细胞外液氧化的EhCys/CySS能通过抑制线粒体复合体I加剧肝细胞ROS的生成,并使线粒体膜电位降低,而还原的EhCys/CySS能减少高脂所致ROS生成并改善线粒体损伤。线粒体膜电位下降表明线粒体功能障碍,即可引起线粒体能量储备减少及氧化应激增强,导致脂质变性的肝细胞对二次打击的抵抗能力降低。
综上,高脂饮食能使动物血浆EhCys/CySS氧化,高脂培养能导致LO2肝细胞内ROS增多,氧化的细胞外EhCys/CySS能通过抑制线粒体复合体I加剧NAFLD肝细胞ROS的生成,并使线粒体膜电位进一步下降,而还原的EhCys/CySS能清除ROS并改善线粒体损伤。实验根据细胞外EhCys/CySS对肝细胞线粒体功能的影响,进一步认识高脂通过细胞外氧化还原状态来影响细胞内的功能,这有助于深入探究NAFLD的病理机制。关于高脂是如何氧化血浆EhCys/CySS及由此引发的氧化的EhCys/CySS对NAFLD进程的影响,如肝脂质沉积、炎性反应、纤维化等机制有待进一步研究。
[参考文献]
[1]Jones DP,Carlson JL,ModyJr VC,et al.Redox state of glutathione in human plasma[J].Free Radical Biol Med,2000,28( 4) : 625-635.
[2]Jones DP.Redefining oxidative stress[J].Antioxid Redox Signal,2006,8( 9-10) : 1865-1879.
[3]Ramirez A,Ramadan B,Ritzenthaler JD,et al.Extracellular cysteine/cystine redox potential controls lung fibroblast proliferation and matrix expression through upregulation of transforming growth factor-β[J].Am J Physiol Lung Cell Mol Physiol,2007,293( 4) : L972-L981.
[4]Go YM,Jones DP.Intracellular proatherogenic events and cell adhesion modulated by extracellular thiol/disulfide redox state[J].Circulation,2005,111( 22) : 2973-2980.
[5]Imhoff BR,Hansen JM.Extracellular redox environments regulate adipocyte differentiation[J].Differentiation,2010,80( 1) : 31-39.
[6]Jiang S,Moriarty-Craige SE,Orr M,et al.Oxidant-induced apoptosis in human retinal pigment epithelial cells: dependence on extracellular redox state[J].Invest Ophthalmol Vis Sci,2005,46( 3) : 1054-1061.
[7]Jones DP.Extracellular redox state: refining the definition of oxidative stress in aging[J].Rejuvenation Res,2006,9( 2) : 169-181.
[8]Gambino R,Musso G,Cassader M.Redox balance in the pathogenesis of nonalcoholic fatty liver disease: mechanisms and therapeutic opportunities[J].Antioxid Redox Signal,2011,15( 5) : 1325-1365.
[9]Cui W,Chen SL,Hu KQ.Quantification and mechanisms of oleic acid-induced steatosis in HepG2 cells[J].Am J Transl Res,2010,2( 1) : 95-104.
[10]Jones DP,Mody VC Jr,Carlson JL,et al.Redox analysis of human plasma allows separation of pro-oxidant events of aging from decline in antioxidant defenses[J].Free Radical Biol Med,2002,33( 9) : 1290-1300.
[11]Moriarty SE,Shah JH,Lynn M,et al.Oxidation of glutathione and cysteine in human plasma associated with smoking[J].Free Radical Biol Med,2003,35( 12) : 1582-1588.
[12]Cossarizza A,Baccaranicontri M,Kalashnikova G,et al.A new method for the cytofluorometric analysis of mitochondrial membrane potential using the J-aggregate forming lipophilic cation 5,5’,6,6’-tetrachloro-1,1’,3,3’-tetraethylbenzimidazolcarbocyanine iodide ( JC-1)[J].Biochem Biophys Res Commun,1993,197( 1) : 40-45.
[13]张勇,胡文君,王尧,等.mfn2基因转染对非酒精性脂肪肝细胞线粒体功能的影响[J].中国病理生理杂志,2010,26( 3) : 568-572.
[14]Stolk J,Hiltermann TJ,Dijkman JH,et al.Characteristics of the inhibition of NADPH oxidase activation in neutrophils by apocynin,a methoxy-substituted catechol[J].Am J Respir Cell Mol Biol,1994,11( 1) : 95-102.
[15]Graham D,Huynh NN,Hamilton CA,et al.Mitochondria-targeted antioxidant MitoQ10improves endothelial function and attenuates cardiac hypertrophy[J].Hypertension,2009,54( 2) : 322-328.
[16]Chen Q,Vazquez EJ,Moghaddas S,et al.Production of reactive oxygen species by mitochondria central role of complex III[J].J Biol Chem,2003,278( 38) : 36027-36031.
[17]Thong-Ngam D,Samuhasaneeto S,Kulaputana O,et al.N-acetylcysteine attenuates oxidative stress and liver pathology in rats with non-alcoholic steatohepatitis[J].World J Gastroenterol,2007,13( 38) : 5127-5132.
[18]Moriarty SE,Shah JH,Lynn M,et al.Oxidation of glutathione and cysteine in human plasma associated with smoking[J].Free Radical Biol Med,2003,35( 12) : 1582-1588.
Extracellular cysteine/cystine redox potential affects mitochondrial function in NAFLD LO2 cells
GUAN Qing-hua,DING Qi-long
( Experimental and Teaching Center of Medical Basis for Pharmacy,China Pharmaceutical University,Nanjing 211198,China.E-mail: g637cpu@163.com)
[ABSTRACT]AIM: To investigate the effects of extracellular cysteine/cystine redox potential ( EhCys/CySS) on the mitochondrial function of nonalcoholic fatty liver disease ( NAFLD) hepatocytes.METHODS: LO2 cells were incubated with EhCys/CySS of the oxidized ( 0 mV),the normal (-80 mV),or the reduced (-150 mV) status medium,then treated with oleic acid to establish NAFLD model in vitro.DCFH-DA and MitoSOX were used as the fluorescent probes for determining reactive oxygen species ( ROS).Apocynin ( NADPH oxidase inhibitor),MitoQ(10)( mitochondria-targeted antioxidant),rotenone ( mitochondrial respiratory chain complex I inhibitor) and antimycin A ( mitochondrial respiratory chain complex III inhibitor) were used to investigate the sources of ROS.RESULTS: An increase in ROS in LO2 cells by oleic acid was aggravated by the oxidized extracellular EhCys/CySS ( 0 mV),which was removed by the reduced EhCys/ CySS (-150 mV).ROS generation by 0 mV was significantly eliminated by MitoQ(10).ROS levels were dependent on extracellular EhCys/CySS in rotenone treated LO2 cells.A decline of mitochondrial membrane potential in the cells with NAFLD was aggravated by 0 mV and reversed by-150 mV.CONCLUSION: The oxidized extracellular EhCys/CySS via inhibitiing of complex I intensifies ROS generation and reducing the mitochondrial membrane potential in the NAFLD hepatocytes,which were reversed by reduced EhCys/CySS.
[KEY WORDS]Cysteine / cystine redox potential; Reactive oxygen species; Nonalcoholic fatty liver disease; Mitochondria
通讯作者△Tel: 025-86185359; E-mail: g637cpu@163.com
[收稿日期]2015-01-06[修回日期]2015-03-26
[文章编号]1000-4718( 2015)07-1266-06
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.07.020
