藻蓝蛋白诱导喉癌HEP-2细胞凋亡的实验研究*
2015-09-14潘若望王茂峰陈吉顺张洪勤包其郁李佩珍
应 俊, 潘若望, 王茂峰, 陈吉顺, 刘 倩, 张洪勤, 包其郁, 李佩珍△
(1温州医科大学检验医学院生命科学学院,浙江温州325035;2中国人民解放军第118医院,浙江温州325000;3温州医科大学附属东阳医院,浙江东阳322103)
喉癌是头颈部常见的恶性肿瘤之一,占全身恶性肿瘤的5.7% ~7.6%,占耳鼻喉科恶性肿瘤的7.9%~35.0%,环境污染的增加和不良生活习惯使我国各地的喉癌发病率呈上升趋势[1]。对喉癌的治疗目前主要还是手术、放疗、化疗,但对于中晚期喉癌患者,预后仍不够理想且副作用太大。欧洲癌症研究与治疗组织(EORTC)头颈合作组进行了以顺铂和氟尿嘧啶为主的诱导化疗方案,结果表明在没有影响总生存率的前提下,患者的喉保留率54.0%,远处转移率明显降低[2]。但由于化疗药物副作用大,无法大剂量的使用,从而限制了肿瘤的治疗手段。因此,发现并筛选新的高效低毒的化疗药物己成为当今肿瘤治疗研究的重点。
藻蓝蛋白(phycocyanin,PC)是一种普遍存在于蓝藻和螺旋藻细胞内的捕光色素蛋白,具有抗肿瘤、抗氧化、抗突变、抗病毒等多种生物学功能,有重要的开发利用价值[3]。现今研究已发现,无论是光动力学方向还是体内外直接作用于肿瘤细胞株,藻蓝蛋白在抗肿瘤方面都有着极佳的前景。但目前有关藻蓝蛋白抗肿瘤免疫活性作用的分子作用机制尚未明确,关于藻蓝蛋白和喉癌的关系至今没有比较系统的文献报道。为此本课题选用人喉癌HEP-2细胞进行实验,通过MTT法观察藻蓝蛋白对人喉癌HEP-2细胞活力的影响,采用普通倒置显微镜、电镜、流式细胞术观察藻蓝蛋白对HEP-2细胞凋亡的影响,利用RT-PCR、Western blot等进一步从细胞分子水平深入探讨藻蓝蛋白的抗肿瘤作用机制,为今后应用藻蓝蛋白治疗恶性肿瘤奠定一定基础。
材料和方法
1 细胞和主要试剂
人喉癌HEP-2细胞购于中科院上海细胞库。藻蓝蛋白纯度(A620/A280)达4.24,由本实验室从新鲜钝顶螺旋藻中提取纯化制得。1640培养基、胰酶为Gibco产品;胎牛血清为杭州四季青生物科技有限公司生产;MTT和二甲基亚砜(DMSO)为Sigma产品;Annexin V/PI染色试剂盒为联科生物产品;RT-PCR及PCR相关试剂为TaKaRa产品;N-乙酰半胱氨酸(N-acetylcysteine,NAC)、活性氧(reactive oxygen species,ROS)检测试剂盒、caspase-3、-8、-9 活性检测试剂盒、RIPA细胞裂解液、PMSF、鼠单克隆抗体cleaved caspase-3、鼠单克隆抗体P53、鼠单克隆抗体β-actin、辣根过氧化物酶标记的山羊抗鼠IgG抗体及ECL发光试剂盒均为上海碧云天公司产品。
2 主要方法
2.1 细胞培养 人喉癌HEP-2细胞株在含10%胎牛血清、1%青霉素-链霉素的1640培养液中生长,并置于37℃、5%CO2的相对饱和湿度孵箱中培养,细胞呈贴壁生长,取对数生长期的细胞进行实验。
2.2 MTT法检测藻蓝蛋白对HEP-2细胞生长的影响 取对数生长期的HEP-2细胞,胰酶消化,细胞计数板计数并调整细胞悬液浓度达到1.0×108/L,每孔加入100 μL细胞悬液于96孔细胞培养板中,37℃、5%CO2过夜培养至细胞完全贴壁。加入不同浓度的藻蓝蛋白培养液(终浓度为 10、20、40、80、160、320 mg/L),每个浓度做5个复孔,并设顺铂阳性对照和不含藻蓝蛋白的阴性对照。分别以不同的时间梯度进行培养后,加入MTT溶液,继续孵育4 h,弃上清,加入DMSO 150 μL,避光振荡10 min。用酶标仪于490 nm处测各孔吸光度值(A)。统计数据后计算各不同浓度药物对细胞抑制率(R)和半效抑制浓度(IC50)。R=[(对照组A值-实验组A值)/对照组A值]×100%。
2.3 倒置显微镜下观察藻蓝蛋白对HEP-2细胞形态的影响 生长状况较好的HEP-2细胞消化制备细胞悬液,浓度达到1.0×108/L,接种1.5 mL细胞悬液于装有盖玻片的6孔板中。待细胞贴壁后,加入藻蓝蛋白(0、20、40、80、160、320 mg/L)分别干预人HEP-2细胞24 h和48 h,倒置显微镜下观察HEP-2细胞形态变化并拍照。
2.4 扫描电子显微镜观察细胞的表面结构 在6孔板中分别放入已处理的盖玻片,每孔加入浓度为1.0×108/L的细胞悬液1.5 mL。培养24 h后根据实验分组加药处理,藻蓝蛋白终浓度分别为 0、80、160、320 mg/L。处理48 h后将细胞爬片放入4%戊二醛固定液中4℃固定过夜,次日取出经 PBS缓冲液清洗3次,自然晾干,1%锇酸固定,乙醇梯度脱水,叔丁醇梯度置换,真空干燥,离子溅射镀膜,放于扫描电镜中观察细胞表面结构的变化并拍照保存[4]。
2.5 透射电子显微镜观察细胞的超微结构 收集经0、80、160、320 mg/L藻蓝蛋白作用 48 h的HEP-2细胞及未经处理的 HEP-2细胞,1 500 r/min 4℃离心5 min,PBS洗2次。沉淀经2.5%戊二醛前固定,1%锇酸后固定,丙酮梯度脱水,环氧树脂包埋,超薄切片,醋酸铅-铀双重染色,透射电子显微镜下观察细胞的超微结构并拍照[5]。
2.6 流式细胞术检测藻蓝蛋白对HEP-2细胞凋亡的影响 不同浓度藻蓝蛋白(0、20、40、80、160、320 mg/L)处理HEP-2细胞48 h后,1 000 r/min离心5 min,去上清,用 400 μL PBS 重悬洗涤 2 次,Annexin V-FITC/PI双荧光(FITC 10 mg/L,PI 50 mg/L)避光染色10 min,将样本放入流式细胞仪的样品室内,激发波长488 nm,使用BDFACSDivaTm软件收集数据,并用ModfitLT 3.0软件进行细胞凋亡分析[6]。
2.7 细胞内ROS的检测 HEP-2细胞传代培养24 h后,按实验需要用不同浓度藻蓝蛋白单用及与ROS抑制剂NAC(3 mmol/L)联合处理48 h。收集细胞后悬浮于用无血清培养液稀释好的DCFA-DA(终浓度为10 μmol/L)中,37℃避光孵育20 min,用无血清培养液清洗3次,流式细胞仪测定荧光强度(激发波长488 nm,发射波长525 nm)。实验重复3次,所得数据经 Quest软件收集、分析[7]。
2.8 Caspase活性的测定 Caspase-3、-8、-9活性的检测采用比色法。收集经0、80、160、320 mg/L藻蓝蛋白处理24 h的HEP-2细胞,用细胞裂解液在冰上裂解20 min,4 ℃、12 000 r/min离心15 min,取 10 μL上清进行蛋白定量,于紫外分光光度计内测样本在595 nm下的吸光度值;另10 μL加80 μL检测缓冲液及10 μL caspase反应底物,混匀,37℃孵育2 h,测定样本 A405,再计算 caspase 相对活性[8]。
2.9 RT-PCR检测细胞凋亡调控基因mRNA的表达 收获经不同浓度藻蓝蛋白(0、80、160、320 mg/L)培养48 h的HEP-2细胞,TRIzol法提取细胞总RNA,所得沉淀用0.1%DEPC水溶解,用Nano Drop 2000型超微量分光光度计检测 RNA纯度及浓度,取A260/280为1.8~2.0者用于RT反应。参照TaKaRa公司的逆转录试剂盒说明进行cDNA合成,反应体系为 20 μL,包括:总 RNA 1 μg,Prime Script RTase 1 μL,10 × Prime Script buffer 3 μL,RNase inhibitor 0.5 μL,dNTP Mix 1 μL,Random Primer 1 μL,加 RNA free H2O至20 μL。逆转录条件为30℃ 10 min,42℃ 45 min,95℃ 5 min,4℃ 30 min。PCR反应体系按照试剂说明配制以β-actin为内参照,所有引物序列详见表1。反应条件为94℃ 5 min;94℃ 40 s,58℃ 45 s,72℃ 50 s,35个循环;72℃ 10 min。PCR 产物5 μL进行琼脂糖凝胶电泳并拍照,应用凝胶图像分析管理系统进行灰度测量,mRNA的表达水平以每一样品与其内参照β-actin灰度比值表示,实验独立重复 3 次[9]。

表1 用于RT-PCR分析的引物序列Table 1.The primers sequences for RT-PCR analysis
2.10 Western blot检测细胞凋亡调控蛋白的表达收集前述方法培养并处理的细胞,用200 μL RIPA裂解液和1 μL PMSF 裂解30 min,4 ℃、12 000 r/min离心15 min,留取上清,用 BCA蛋白试剂盒测蛋白浓度。在 30 μg体积下行 12%SDS-PAGE,后用PVDF膜转膜,5%脱脂牛奶封闭2 h。用1∶1 000比例稀释Ⅰ抗,4℃孵育过夜。次日用TBST洗3次,每次15 min,按1∶3 000比例稀释Ⅱ抗,37℃孵育2 h,接着用TBST洗膜,方法同前。最后滴加ECL液,暗室X线压片曝光,显影、定影,内参照用β-actin。扫描X光片后,计算机软件处理,进行密度分析,计算灰度值[10]。
3 统计学处理
用SPSS 15.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,2组间比较采用t检验,多组间比较采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 MTT法检测藻蓝蛋白对HEP-2细胞生长的影响
MTT结果显示160 mg/L的藻蓝蛋白作用12 h后,细胞的生长抑制率为2.83%,作用时间延长至72 h后,抑制率上升至61.85%,与不含藻蓝蛋白的对照组相比,差异有统计学意义(P<0.05)。这说明藻蓝蛋白对人喉癌HEP-2细胞有明显的抑制作用。
并且,藻蓝蛋白对HEP-2细胞的抑制率增加,呈剂量依赖性。同时,48 h作用组与24 h作用组不同浓度下的抑制率之间有明显差别(P<0.05),说明藻蓝蛋白对喉癌HEP-2细胞生长的抑制作用呈时间依赖性。其24 h的IC50为431.86 mg/L,48 h的IC50为225.93 mg/L,见图 1。

Figure 1.The inhibitory effect of phycocyanin on HEP-2 cell activity.Mean±SD.n=5.*P<0.05,**P<0.01 vs 0 mg/L;#P <0.05,##P <0.01 vs 12 h.图1 藻蓝蛋白对HEP-2细胞增殖的抑制作用
2 藻蓝蛋白对人喉癌HEP-2细胞形态学影响
在倒置显微镜下观察,对照组HEP-2细胞轮廓清晰,呈梭形、多边形、上皮细胞样,良好的贴壁生长,随着培养时间的增长,细胞逐渐融合成片,在培养基中未见明显悬浮细胞。随着藻蓝蛋白刺激浓度的增加,贴壁生长细胞逐渐减少,细胞间的连接减少,胞浆浓缩,边缘不规则,变圆细胞和脱壁漂浮的小圆球细胞逐渐增多,到高浓度藻蓝蛋白作用后(320 mg/L)贴壁生长细胞极少。由此可见,随着藻蓝蛋白处理时间的延长,镜下出现形态学改变的细胞逐渐增多,见图2。

Figure 2.The morphology of HEP-2 cells treated with phycocyanin for 48 h(×20).图2 显微镜下观察藻蓝蛋白作用48 h后HEP-2细胞的形态
3 扫描电镜观察藻蓝蛋白对HEP-2细胞表面形貌结构的影响
对照组HEP-2细胞表面存在着丰富的微绒毛,在细胞边缘有丰富的丝状伪足,多且较长,呈放射状向四周伸展。80 mg/L的藻蓝蛋白作用后,部分细胞伪足回缩,多数细胞表面无明显变化。160 mg/L的藻蓝蛋白作用后,HEP-2细胞整体形态与对照组相比差别较为明显,细胞表面微绒毛和伪足进一步减少或全部消失,细胞变得相对光滑,出现凋亡小体。随着药物浓度的继续增加,细胞形态的改变愈加明显,大多数细胞凹陷、变形、破损,表面呈空洞化或出现由峭状、片层状突起组成的结构,有的细胞极度受损变形成为团块状细胞碎片或残片,见图3。
4 透射电镜观察藻蓝蛋白对HEP-2细胞内部超微结构的影响
对照组HEP-2细胞形态规则,表面有丰富的微绒毛,核规则,核仁清晰,靠近核膜一侧的胞浆丰富,电子密度低,线粒体结构完整,并可见内质网及游离核糖体。随着藻蓝蛋白作用浓度的升高,各组HEP-2细胞形态变化明显,细胞体积缩小,形态变得不规则,细胞器结构不清,细胞质中空泡增多,细胞核内异染色质增多,凝集成块状或聚集在核膜下,呈分叶状、花瓣状,核仁增大,数目增多,形态和位置不规则,大剂量组(320 mg/L PC)细胞膜碎裂,胞浆脱落,核膜消失,细胞核裂解为碎块,见图3。
5 喉癌HEP-2细胞凋亡的流式细胞检测结果

Figure 3.Ultrastructural changes of HEP-2 cells treated with phycocyanin.图3 电镜观察藻蓝蛋白作用48 h后HEP-2细胞的超微结构
藻蓝蛋白作用HEP-2细胞48 h,与对照组相比,随着藻蓝蛋白给药剂量的不断增加,早期及晚期凋亡细胞所占比例逐渐增加,总凋亡率逐渐增加。藻蓝蛋白浓度分别为20、40、80、160、320mg/L时,凋亡细胞占细胞总数的百分比分别为11.6%,14.6%,17.3%,18.9%,32.1%。各浓度组凋亡细胞比率与对照组比较,差异显著(P<0.05)。说明藻蓝蛋白在20 mg/L~320 mg/L浓度范围内呈浓度依赖性诱导喉癌HEP-2细胞发生凋亡,见图4。
6 藻蓝蛋白对HEP-2细胞内ROS水平的影响
随着藻蓝蛋白浓度的增加,PC组和PC+NAC组ROS荧光强度也随之增强(P<0.01),单独使用NAC处理的HEP-2细胞荧光强度无明显变化。经320 mg/L藻蓝蛋白处理的HEP-2细胞内荧光强度为对照组的3.2倍(P<0.01);而当藻蓝蛋白联合ROS抑制剂NAC处理HEP-2细胞时,细胞内荧光强度虽比PC组低(P<0.05),但仍高于对照组(P<0.05),说明藻蓝蛋白处理HEP-2细胞后能使细胞内ROS水平明显升高,且细胞内ROS水平的升高可被ROS抑制剂抑制,见图5。
7 Caspase活性测定
不同浓度藻蓝蛋白处理HEP-2细胞后,caspase-3、caspase-8和caspase-9的活性明显升高且具有浓度依赖性(P<0.05),见表2,表明藻蓝蛋白诱导的细胞凋亡是caspase依赖型的。
8 RT-PCR检测结果
经不同浓度藻蓝蛋白作用48 h后,HEP-2细胞Bax、P53、Fas、caspase-3 和 caspase-9 的 mRNA 表达出现上调,抗凋亡基因Bcl-2的mRNA表达出现下调,并表现出一定的剂量依赖性。320 mg/L的藻蓝蛋白处理组与对照组相比,Bax、Fas、P53、caspase-3和caspase-9 mRNA的表达分别增加了1.6倍、1.8倍、1.9倍、2.6倍和1.7倍,Bcl-2的表达降低了0.6倍,和空白对照组比较差异显著(P<0.05),见图6。
9 Western blot检测凋亡相关蛋白表达
在本实验中,采用了Western blot方法检测各组细胞P53和caspase-3蛋白水平的改变。结果显示不同浓度的藻蓝蛋白(80、160、320 mg/L)给药后,HEP-2细胞P53蛋白 和caspase-3的活化片段(17 kD)逐渐增多,和空白对照组比较差异显著(P<0.05),与RT-PCR和caspase活性检测结果是一致的,见图7。
讨 论
藻蓝蛋白是从螺旋藻中提取的一种捕光色素蛋白,捕光效能高,属于藻胆蛋白的一种,主要由α和β两种亚基组成,天然状态下多以多聚体形式存在。近年来在海洋生物中寻找高效、低毒、不良反应小的抗肿瘤药物受到越来越多的关注[11]。本实验结果显示藻蓝蛋白能够抑制HEP-2细胞增殖并诱导细胞凋亡,且有一定剂量效应关系。

Figure 4.The effects of phycocyanin on apoptosis of HEP-2 cells.Mean±SD.n=3.*P <0.05,**P <0.01 vs 0 mg/L.图4 不同浓度藻蓝蛋白对HEP-2细胞凋亡的影响
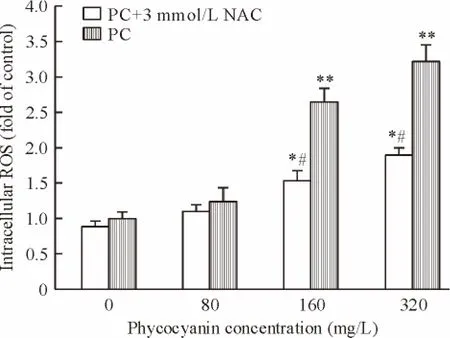
Figure 5.The effects of phycocyanin on ROS production in HEP-2 cells.NAC:N-acetylcysteine.Mean ± SD.n=3.*P <0.05,**P <0.01 vs 0 mg/L;#P <0.05 vs PC.图5 不同浓度藻蓝蛋白对HEP-2细胞内ROS水平的影响
细胞凋亡的发生是一个级联式基因表达的结果,主要通过3条信号转导途径产生:线粒体途径、死亡受体途径和内质网信号途径。而3条信号途径最终都通过引发凋亡中心环节caspase-3的激活,形成级联反应,进而诱导细胞产生凋亡。Caspase家族在凋亡信号转导过程中发挥着重要作用,其中caspase-8和caspase-9为凋亡的效应分子,分别与凋亡的死亡受体通路和线粒体通路相关;而caspase-3为关键的凋亡执行分子,它在凋亡信号转导的许多途径中发挥功能。本文进一步检测了藻蓝蛋白处理后HEP-2细胞中caspase的活性,结果发现caspase-3、-8、-9均被激活,说明藻蓝蛋白不仅能够介导细胞凋亡的线粒体通路的活化,而且能够活化死亡受体通路。
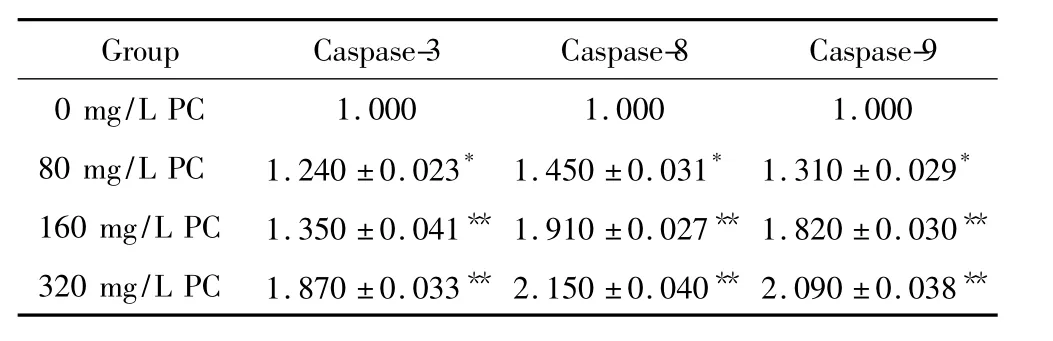
表2 不同浓度藻蓝蛋白作用于HEP-2细胞后caspase活性的变化Table 2.The results of caspase activities in the HEP-2 cells treated with phycocyanin at different concentrations(Mean±SD.n=3)

Figure 6.The effects of phycocyanin on the mRNA expression of apoptosis-related genes in HEP-2 cells tested by RT-PCR.β-actin was used as an internal control.Mean±SD.n=3.*P <0.05,**P <0.01 vs 0 mg/L.图6 RT-PCR检测藻蓝蛋白对HEP-2细胞凋亡调控基因mRNA表达的影响

Figure 7.The effects of phycocyanin on the protein levels of P53 and cleaved caspase-3 determined by Western blot.βactin was used as an internal control.Mean±SD.n=3.*P <0.05,**P <0.01 vs 0 mg/L.图7 Western blot检测藻蓝蛋白对 HEP-2细胞 P53和cleaved caspase-3蛋白水平的影响
在线粒体凋亡途径中,Bcl-2和Bax蛋白是线粒体完整性的关键调节者,Bcl-2与Bax可形成异源二聚体或与自身形成同源二聚体,参与调节细胞线粒体凋亡途径。14-噻吩基次亚甲基苦参碱对人鼻咽癌CNE细胞的诱导凋亡机制与激活线粒体凋亡通路(上调 Bax的表达并下调 Bcl-2的表达)有关[12]。Subhashini等[13]研究表明C-PC通过细胞色素C从线粒体释放进入细胞质,引起Bcl-2的下调从而诱导K562细胞凋亡。我们在研究中发现,藻蓝蛋白作用于HEP-2细胞后,Bcl-2表达下降,Bax、caspase-9和caspase-3表达增加,并表现出一定的剂量依赖性,藻蓝蛋白可能通过抑制Bcl-2,激活Bax而释放细胞色素C,释放到细胞质中的细胞色素C通过形成凋亡小体而启动caspase依赖的线粒体途径的细胞凋亡。
Fas/FasL介导的通路也是引起细胞凋亡的重要途径之一,Fas/Apol属于肿瘤坏死因子受体超家族,是细胞膜上的糖基化穿膜蛋白。Fas和FasL均主要以膜形式存在,二者结合可引起多种细胞的凋亡。研究发现许多肿瘤细胞具有较高水平FasL表达,而Fas则表达明显下降,在发生转移的肿瘤 Fas几乎完全消失[14]。在本研究中藻蓝蛋白可明显上调HEP-2细胞Fas的表达水平。因而可推测藻蓝蛋白诱导HEP-2细胞凋亡可能是通过上调细胞膜表面的 Fas抗原表达,进而激活caspase启动HEP-2细胞内的凋亡信号转导通路,诱导细胞凋亡,这与李冰等[8]的研究结果一致。
ROS是生物体内重要的信号分子并对生物生长发育有重要意义。正常情况下,细胞内ROS处于一个相对稳定的水平,但理化和生物因素的刺激可导致细胞内ROS大量增加[7]。ROS与线粒体、死亡受体介导的细胞凋亡均有关联,且在药物作用下诱导细胞凋亡的作用更为明显。本研究发现藻蓝蛋白处理HEP-2细胞后能使细胞内ROS水平明显升高,且细胞内ROS水平的升高可被ROS抑制剂NAC抑制,说明细胞内ROS升高在藻蓝蛋白诱导细胞凋亡中起着非常重要的作用,藻蓝蛋白可打破细胞内氧化还原平衡,引发细胞内ROS升高,而后者可能作为活化信号,激活细胞凋亡途径,从而促进细胞凋亡。这与Bobbili等[15]认为自由基消除剂能够抑制藻蓝蛋白介导的AK-5肿瘤细胞的凋亡的结论相符。
另外,p53是细胞内重要的抑癌基因,在本实验中,RT-PCR和Western blot检测结果显示给药后细胞P53表达增加,且呈现明显的剂量依赖性,其效果与Ad-ING4-OSM联合放疗抑制喉癌HEP-2细胞生长[16]、槐定碱联合顺铂诱导人宫颈腺癌HeLa细胞凋亡[17]相当。藻蓝蛋白诱导HEP-2细胞凋亡可能是通过P53介导的凋亡途径,但有关P53蛋白与凋亡发生的具体机制尚有待于进一步的研究。
综上所述,藻蓝蛋白诱导HEP-2细胞凋亡是线粒体途径和死亡受体途径激活同时参与的结果。这反映了藻蓝蛋白多层次、多靶点的作用优势。当然,藻蓝蛋白对于肿瘤细胞的抑制作用是一个很复杂的问题,本实验仅从对于肿瘤细胞的增殖和凋亡的影响做了一些探索,可能还有其它方面的因素参与其中,还有待深入研究。
[1] Zhang W,Geng T,Han W,et al.Tea intake and risk of oral,pharyngeal,and laryngeal carcinoma:a meta-analysis[J].Med Sci Monit,2014,20:2142-2150.
[2] 赵永强.塞来昔布诱导喉癌Hep-2细胞凋亡及细胞周期阻滞的实验研究[D].济南:山东大学,2014.
[3] Zhang YY,Chen BL.Rose algal phycocyanin purification and vitro antioxidant activity[J].Food Fermentation Industries,2012,8(9):38-43.
[4] 赵德璋,罗子国,杨杰顺.改良游离细胞扫描电镜制样方法适用于凋亡细胞观察[J].电子显微学报,2013,32(6):492-495.
[5] 王盛兰,钟延丰,管增伟,等.电镜和荧光显微镜技术在细胞凋亡研究中的应用[J].北京大学学报:医学版,2003,35(1):91-93.
[6] 王雯婕,陈 剑,刘小勇,等.白藜芦醇对视网膜色素上皮细胞增殖的影响[J].中国病理生理杂志,2014,30(10):1839-1844.
[7] 范丽丽,李伟华.外源性NO诱导胃癌SGC-7901细胞凋亡的作用机制[J].世界华人消化杂志,2015,23(1):8-15.
[8] 李 冰,褚现明,高美华,等.钝顶螺旋藻藻蓝蛋白诱导HeLa细胞凋亡的分子机制研究[J].中国药理学通报,2009,25(8):1045-1050.
[9] 王和峰,翟纯刚,庞文会,等.PI3K/Akt/mTOR信号通路在巨噬细胞自噬及动脉粥样硬化斑块不稳定中的作用[J].中国病理生理杂志,2013,29(3):390-397.
[10] Lu W,Yu P,Li J.Induction of apoptosis in human colon carcinoma COLO 205 cells by the recombinant a subunit of C-phycocyanin[J].Biotechnol Lett,2011,33(3):637-644.
[11] Li B,Chu X,Gao M,et al.Apoptotic mechanism of MCF-7 breast cells in vivo and in vitro induced by photodynamic therapy with C-phycocyanin[J].Acta Biochim Biophys Sin,2010,42(1):80-89.
[12] 陈 俊.14-噻吩基次亚甲基苦参碱抗鼻咽癌作用及机制的实验研究[D].南宁:广西医科大学,2013.
[13] Subhashini J,Mahipal SV,Reddy MC,et al.Molecular mechanisms in C-phycocyanin induced apoptosis in human chronic myeloid leukemia cell line-K562[J].Biochem Pharmacol,2004,68(3):453-462.
[14] Bębenek M,Du's D,Ko'zlak J.Prognostic value of the Fas/Fas ligand system in breast cancer[J].Contemp Oncol(Pozn),2013,17(2):120-122.
[15] Pardhasaradhi BV,ALi AM,Kumari AL,et al.Phycocyanin-mediated apoptosis in AK-5 tumor cells involves down-regulation of Bcl-2 and generation of ROS[J].Mol Cancer Ther,2003,2(11):1165-1170.
[16] 王 飞.Ad-ING4-OSM联合放疗对喉癌抑瘤增效的体内外实验研究[D].蚌埠:蚌埠医学院,2012.
[17] 马小萍.槐定碱联合顺铂对宫颈腺癌HeLa细胞增殖抑制作用的研究[D].兰州:兰州大学,2014.
