运用RP-HPLC同时测定火龙果中7种有机酸和Vc含量的方法研究
2015-05-15蒋侬辉
蒋侬辉,凡 超,刘 伟,向 旭
(广东省农业科学院 果树研究所/农业部南亚热带果树生物技术与遗传资源利用重点实验室/广东省热带亚热带果树研究重点实验室,广东 广州 510640)
火龙果(Hylocereus undulatus)属仙人掌科量天尺属果树,目前种植的主要有量天尺属的白肉火龙果(H.undatus)、红肉火龙果(H.polyrhizus)和紫红肉火龙果(H.costaricensis)3个品种[1-2],于20世纪90年代初引入我国台湾省,之后开始在广西、广东、海南等省区种植,因其外形亮丽,果肉多汁味美,深受消费者的喜爱[3]。火龙果耐干旱,耐粗放管理,病虫害少,可基本不施化学农药和化肥,具有作为绿色食品开发的基础条件,且发展前景广阔[4]。
有机酸组分及其含量对果实内在品质有着重要的影响,是决定果实风味的重要指标[5-6],其含量直接影响果品风味、口感及色泽,是果品成熟度、耐贮藏性以及加工性的重要指标,同时也是研究不同资源的有机酸组分积累特征及其代谢的重要依据[7-11]。由于引进时间短,对火龙果研究多侧重于引种及品种比较、常规种植管理技术的研究[12-13],但目前对广州地区引种栽培的火龙果有机酸组分及糖组分代谢极少见详细报道,因此对火龙果中的有机酸的测定方法研究是很有意义的。近年来,建立了一些用反相高效液相色谱(RP-HPLC)分离检测有机酸的方法[15-19],但同时测定火龙果中有机酸与Vc的方法还未见报道。Vc的常规检测方法是采用2,6-二氯酚靛酚滴定法[20],此法简便快速,但也有其缺点,当遇到颜色较深的水果时因滴定终点(淡粉红色)难以判定而无法获得准确的结果,运用HPLC方法可以克服以上缺点并获得准确结果。
本试验以广东珠海斗门产紫红肉火龙果为试验材料,对影响有机酸分离的主要因素进行了研究,最终确定了运用HPLC法一次进样同时测定火龙果果实多种有机酸及Vc的方法。为今后果实特别是深色果肉果实的有机酸及Vc类物质的深入研究及其开发利用提供参考。
1 材料与方法
1.1 材料与试剂
供试火龙果采自广东省珠海斗门试验基地,为紫红肉火龙果(H.costaricensis)果肉。
草酸、酒石酸、苹果酸、乙酸、乳酸、柠檬酸、琥珀酸、Vc标准、H3PO4、Na2HPO4均为分析纯试剂。
1.2 仪器与设备
Agilent 1100型高效液相色谱仪(配有VWD紫外检测器),美国Agilent公司;5702台式冷冻离心机,美国Eppendorf公司;超纯水仪,美国Millipore公司;KQ-300VDE超声波清洗器,昆山舒美超声仪器有限公司;S20K pH计,瑞士梅特勒-托利多公司;Kromasil C18反相柱(250 mm×4.6 mm,5 μm),瑞典EKA Chemicals公司。
1.3 方法
1.3.1 标准溶液配制 分别称取草酸标准50 mg、酒石酸标准125 mg、苹果酸标准125 mg、Vc标准125 mg、乳酸标准50 mg、醋酸标准100 mL、柠檬酸标准250 mg、琥珀酸标准125 mg于25 mL的容量瓶(精确至0.1 mg),分别用流动相缓冲溶液溶解并定容于25 mL容量瓶中,作为有机酸的标准贮备液。使用时各取1.00 mL于10 mL容量瓶配制成有机酸的混合标准液,再将混合标准液在10 mL容量瓶中用流动相缓冲溶液稀释成不同的浓度梯度(即稀释1倍、5倍、10倍、50倍、100倍、500倍)。
1.3.2 样品制备 取H3PO4-Na2HPO4配置0.05 mol/L,pH2.5的样品缓冲液,取经组织捣碎后的果蔬样品10 g,加H3PO4-Na2HPO4缓冲液定容于100 mL,于超声清洗器上超声混合提取10 min,置于高速冷冻离心机上离心10 min(10 000 r/min,4℃),移取上清液,经0.45 μm滤膜过滤,漩涡混合器上混合1 min后加入样品瓶备用。
1.3.3 色谱条件 参照 GB/T 5009.157—2003《食品中有机酸的测定》[21]、文献[15-19]等的方法加以修改,采用的色谱条件为:Kromasil柱250 mm×4.6 mm,缓冲液:0.05 mol/L H3PO4-Na2HPO4缓冲液;进样体积:20 μL;紫外检测波长:215 nm,柱温:30℃,流速:1 mL/min。
2 结果与分析
2.1 色谱条件的优化
2.1.1 检测波长的确定 用二极管阵列检测器采集有机酸在190~300 nm的紫外吸收光谱图,对每种有机酸的吸光度进行波长扫描,发现这7种有机酸与Vc在200~230 nm有最大吸收波长[22],且215 nm处其他物质干扰少,确定为检测波长。
2.1.2 流动相pH值的确定 水溶性有机酸的HPLC分析,通过添加H3PO4调节pH值来抑制有机酸的解离,降低离子化,用Na2HPO4水溶液的可获得满意的分离效果,流动相的pH值对有机酸的保留时间有很大的影响,因此,通过调节流动相的pH值对7种有机酸与Vc进行检测;当pH值较小时草酸分离效果很好,但过小(pH≤2),影响色谱柱的使用寿命,当pH值较大(pH>3),目标峰会严重重叠[23],最终选择分离效果较好的pH 2.5为缓冲液pH值。
2.1.3 流动相流速 分别考察了 0.2,0.6,0.8,1.0,1.2 mL/min 5 种流速,流速低易导致拖尾,当随着流速的增大,分离度有所减小,但出峰时间更快,但流速增大也会增加系统的压力,因1.0 mL/min的流速有较高的分离度,更短的分析时间,综合各种因素,选择1.0 mL/min为最佳流速。
2.1.4 柱温的确定 随着柱温的升高,色谱峰的保留时间减小,色谱峰形越理想,但过高的柱温会影响色谱柱的使用寿命。选择柱温30℃时,可以在10 min内完成1个样品的测定,测定时间和峰形都较理想。因此选择30℃为本试验的柱温。
2.2 标准曲线绘制与线性关系考察
将各有机酸与Vc标准试剂分别配成单一的标准溶液,在同一色谱条件下分别进样,确定每种有机酸的保留时间,根据保留时间定性。待仪器稳定后,取不同浓度梯度的7种有机酸与Vc的混合标准溶液分别进样,每个浓度标样至少进3次,外标法定量,以峰面积为横坐标,质量浓度为纵坐标做标准曲线。在上述优化所得色谱条件下标准品的色谱图见图1。
各有机酸的线性拟合方程、线性范围及相关系数(R)如表 1 所示,R >0.999 0,说明有机酸及Vc的浓度对峰面积线性关系良好。

图1 混合有机酸标准的高效液相色谱图Fig.1 HPLC chromatogram of mixed organic acid standard
2.3 精密度考察
对某一浓度的有机酸混合标准溶液在1.3.3节色谱条件下进行HPLC分析,重复操作5次,根据峰面积计算精密度,结果各有机酸与Vc的相对标准偏差(RSD)分别为草酸1.39%、酒石酸1.08%、苹果酸0.84%、Vc 0.50%、乳酸 0.58%、乙酸 0.99%、柠檬酸 1.86%、琥珀酸 1.75% ,其中 Vc 的 RSD 为最低(表1)。可见用本法同时测定果实中的有机酸与Vc具有较好的精密度,适用于定量分析。
2.4 重复性考察
精密称取同一份均匀混合的火龙果样品5份,按1.3.2节样品前处理方法获得供试溶液,按1.3.3节色谱条件进样,测得各有机酸的平均含量分别为草酸0.211 4 mg/g、酒石酸0.616 9 mg/g、苹果酸3.861 1 mg/g、Vc 0.143 7 mg/g、乳酸 0.152 4 mg/g、乙酸 0.365 1 mg/g、柠檬酸 0.936 1 mg/g、琥珀酸0.245 3 mg/g,RSD 分别为 3.76%、2.56% 、0.78%、0.36%、2.24%、1.58%、1.50%、2.89%。表明本法重复性良好。

表1 标准溶液回归分析和精密度分析Tab.1 Regression analysis and precision analysis of standard solution
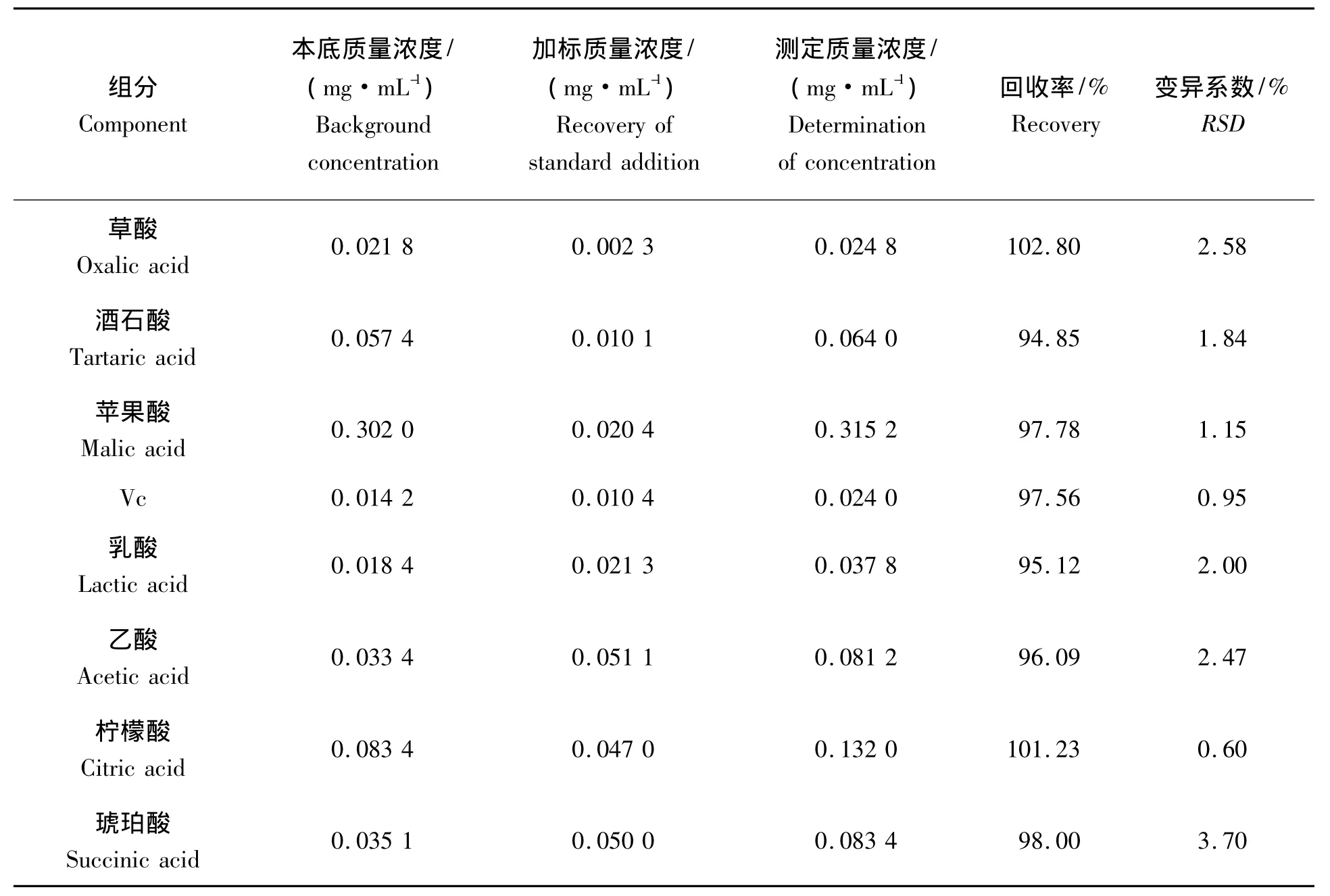
表2 火龙果有机酸与Vc测定的回收率试验Tab.2 Recovery rates of organic acid and Vc determination in dragon fruit
2.5 回收率考察
取同一火龙果样品制备液2份,1份作为空白,另1份加入一定量的标准有机酸溶液,分别进行样品处理和HPLC分析,测定回收率。重复测定6次,其平均回收率分别为:草酸102.80% 、酒石酸94.85%、苹果酸97.78%、Vc 97.56%、乳酸 95.129% 、乙酸 96.09% 、柠檬酸 101.23%、琥珀酸 98.00%。表2显示该处理样品的方法具有较高的回收率。
2.6 火龙果样品有机酸与Vc的测定
为验证以上分析方法,取经黑色遮阳网覆盖方式栽培的成熟火龙果与无覆盖的对照按照1.3.2节方法处理样品,进样20 μL。有机酸色谱图见图2,各处理含量见表3。

图2 火龙果样品中有机酸与Vc的HPLC色谱图Fig.2 HPLC chromatogram of organic acids and Vc in dragon fruit sample
从表3可以看出:供试火龙果中有机酸以苹果酸含量最高,为3.15 ~3.86 mg/g,占总酸的 60%~67%,其次是柠檬酸,为0.88 ~1.13 mg/g,占总酸的 16%~22%,草酸及乳酸含量较低;7种有机酸含量由高到低依次为:苹果酸、柠檬酸、酒石酸、琥珀酸、乙酸、草酸、乳酸,这与以往文献[24]测定火龙果果肉中仅含有草酸、酒石酸、丙酮酸和富马酸不同。同时检测到 Vc含量有0.14 ~0.16 mg/g。表3数据表明黑色遮阳网降低了火龙果苹果酸、草酸及总酸的含量,提高了Vc的含量。
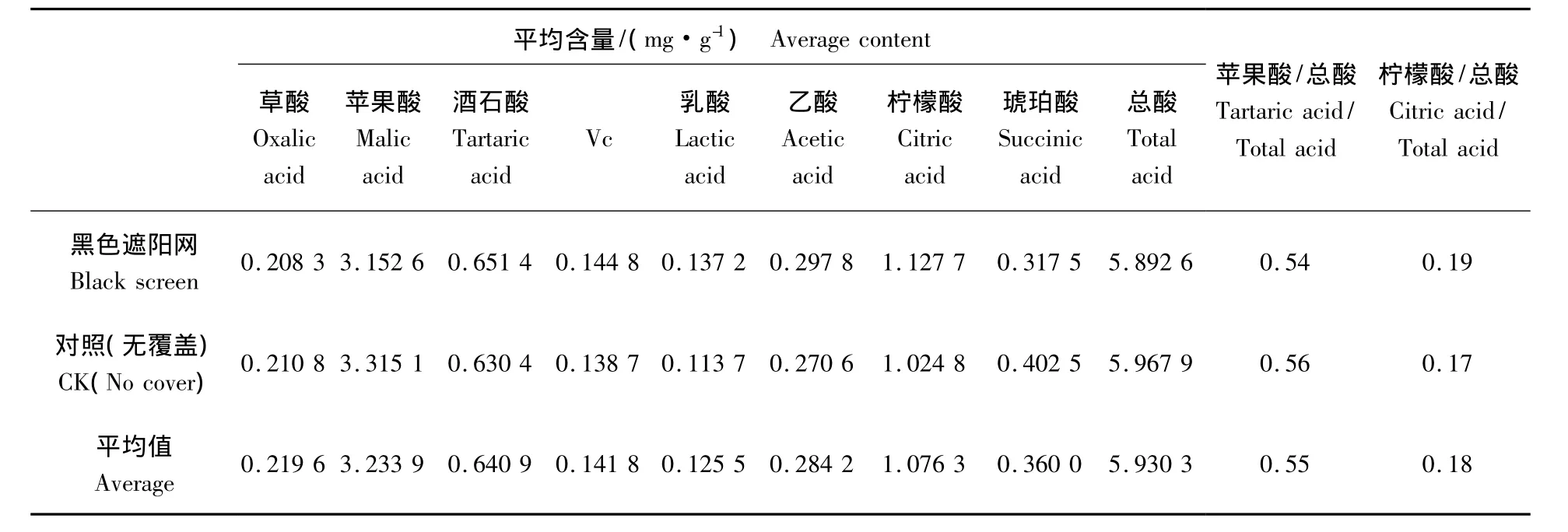
表3 黑色遮阳网栽培对火龙果中有机酸及Vc的含量的影响Tab.3 The influence of content of black screen cultivation methods for dragon fruit in organic acid and Vc
3 讨论与结论
测定结果发现,杂质对结果有较大的影响,由于草酸及酒石酸被洗脱的时间最短,其保留时间在2 min左右,测定样品时很容易与最先被洗脱下来的杂质等混在一起被洗脱,可能是由于该色谱柱对这两种酸较为敏感,因此方法改进还需从改进前处理方法,进一步清除杂质来优化。
实践证明流动相pH值对本方法有非常大的影响,细微的差别将导致保留时间及出峰次序的变化,因此必须对pH计进行严格的校正,才能确保方法的重复性和准确性。
草酸在肠道内会与钙结合成难吸收的草酸钙,干扰人体对钙的吸收,草酸的高低与果实的口感与品质密切相关,随着人们对健康的日益关注,低草酸含量的水果将更受大众的欢迎[25]。苹果酸与柠檬酸相比酸度大(酸味比柠檬酸强20%),但味道柔和(具有较高的缓冲指数),具有特殊香味,被生物界和营养界誉为“最理想的食品酸味剂”[26]。结果表明,测定的紫红肉火龙果是一种高苹果酸,低草酸的水果,因此是一种复合现代人饮食健康和风味需求的水果。
综合以上,本试验获得以下结论:
(1)建立了一种运用HPLC同时快速测定紫红肉火龙果果实中7种有机酸(草酸、酒石酸、苹果酸、乙酸、乳酸、柠檬酸、琥珀酸)和Vc含量的方法。采用的色谱条件为:柱温30℃,流速1 mL/min,色谱柱为 Kromasil柱(250 mm ×4.6 mm),波长215 nm,缓冲液0.05 mol/L H3PO4-Na2HPO4,10 min 内可完成一次测定。
(2)供试的紫红肉火龙果果肉中含有苹果酸、柠檬酸、酒石酸、琥珀酸、乙酸、草酸、乳酸,苹果酸是其最主要的有机酸、其次是柠檬酸。
该方法具有分析速度快、灵敏度高、重复性好、效率高等优点,对果实中有机酸及Vc的测定及相关代谢研究有较高的参考意义。
[1]Yosef M,Avinoam N,Park S N.Cacti as crops[J].Horticultural Reviews,2010,118(4):291-391.
[2]颜昌瑞.新兴果树栽培农业推广手册[M].屏东:中国台湾省国立屏东科技大学农业推广委员会,2002.
[3]郑伟,王彬.火龙果生物学特性、保健价值及发展前景[J].西南园艺,2004,32(3):47-48.
[4]李德勇.栽培火龙果市场前景广阔[J].农业科技通讯,2001,25(8):35-35.
[5]贾惠娟,冈本五郎,平野健.桃果实品质形成成分与其风味之间的相关性[J].果树学报,2004,2l(1):5-10.
[6]陈发兴,刘星辉,陈立松.果实有机酸代谢研究进展[J].果树学报,2005,22(5):526-531.
[7]李甲明,杨志军,张绍铃,等.不同梨品种果实有机酸含量变化与相关酶活性的研究[J].西北植物学报,2013,33(10):2024-2030.
[8]秦巧平,林飞凡,张岚岚.枇杷果实糖酸积累的分子生理机制[J].浙江农林大学学报,2012,29(3):453-457.
[9]何旭孔,邢增涛,饶钦雄,等.法测定香菇中有机酸含量的检测技术研究[J].天然产物研究与开发,2012,24(10):1444-1448.
[10]Ametoli M,Montegrossi G,BucciaIlti A,et al.Determinalion of organic acids in plants of Silene paradoxa L.by HPLC[J].J Agric Food Chem,2008,56(10):789-795.
[11]王俊宁,陈俊鹏,弓德强,等.1-MCP处理对菠萝蜜采后生理效应的影响[J].江西农业大学学报,2014,36(1):56-61.
[12]陈标华,彭乃容.红肉火龙果优质高产栽培技术[J].现代园艺,2010,10(8):24-25.
[13]齐清琳.不同品种火龙果引种栽培比较试验[J].福建林业科技,2004,32(4):48-50.
[14]郑良永.海南岛火龙果丰产栽培技术[J].热带农业科学,2004,24(4):24-25.
[15]孔祥虹,付兴隆,姚秉华,等.固相萃取-反相高效色谱法同时测定浓缩果汁中的11种有机酸[J].食品科技,20l0,35(7):29l-295.
[16]董彩霞,董园园,王健.同一流动相测定植物体内种有机酸和维生素的高效液相色谱法[J].土壤学报,2005,14(02):331-335.
[17]孔祥虹,李健华.反相高效液相色谱法测定果汁中的有机酸[J].理化检验-化学分册,2004,40(6):331-333.
[18]赵景婵,郭治安,常建华.有机酸类化合物的反相高效液相色谱法的分离条件研究[J].色谱,2001,19(3):260-263.
[19]林维宜,房学军,杨红.高效液相色谱法测定山楂中有机酸的研究[J].大连轻工业学院学报,1992,10(3):21-24.
[20]韩雅珊.食品化学实验指导[M].北京:中国农业出版社,1995:15-18.
[21]中华人民共和国卫生部.GB/T 5009.157—2003食品中有机酸的测定[S].北京:中国标准出版社,2003.
[22]Kafka E,Kosar M,Turemis N,et a.Analysis of sugars,organic acids and vitamin C contents of blackberry genotypes from Turkey[J].Food Chemistry,2013,97(4):732-736.
[23]李小平,姚浔平,范建中,等.果汁中种有机酸的反相高效液相色谱法测定[J].中国卫生检验杂志,2008,21(4):582-584.
[24]关秀杰,蔡智军,王莹,等.反相高效液相色谱法测定火龙果有机酸[J].中国农学通报,2009,25(23):114-117.
[25]刘建军,姜鲁燕,赵祥颖,等.苹果酸的应用及研究进展[J].中国食品添加剂,2003,20(3):53-55.
[26]李艳萍,牛建新,陈清.桃果实中糖酸物质代谢的影响因素研究进展[J].中国农学通报,2007,23(8):212-216.
