利用染色体片段置换系浅析三系杂交水稻中的杂种优势位点
2015-05-15王智权王晓玲雷建国肖宇龙李马忠余传元
王智权,王晓玲,雷建国,肖宇龙,李马忠,余传元
(江西省农业科学院 水稻研究所/水稻国家工程实验室,江西 南昌 330200)
1973年中国籼型三系杂交稻实现三系配套,同时推出“南优2号”和“汕优2号”等第一批强优势杂交稻组合,宣告中国三系杂交稻育种取得成功。IR24是野败型不育系最早配套的强优势恢复系,利用IR24选育出多种多样的衍生恢复系。因此,研究IR24的杂种优势位点及杂种优势形成原因,或许可为今后的三系杂交水稻育种提供一些参考。前人利用各类遗传群体研究水稻杂种优势位点,已经有很多报道[1-7],笔者利用染色体片段置换系(chromosome segment substitution(CSS)lines,CSSL)对水稻籼粳亚种间杂种优势的形成原因进行了探析[8-10],而利用三系不育系与籼型恢复系为背景的染色体片段置换系测交后进行水稻农艺性状杂种优势的QTL定位也是首次尝试。理论上,利用CSSL群体进行杂种优势性状的研究,可以在同一遗传背景中比较不同染色体区段的杂种优势效应,进而定位影响产量相关性状的杂种优势位点。为探讨籼中掺粳后粳稻血缘对提高籼稻恢复系杂种优势的作用,本研究利用一套以籼稻恢复系IR24为背景渗入粳稻Asominori血缘的染色体片段置换系为测交父本,以荣丰A、中9A、1133A、1A 4个籼型不育系为母本配置2套杂合F1群体,结合已有置换系图谱的分子标记数据,进行三系杂交水稻产量相关性状杂种优势位点的定位,同时对比分析各套F1群体所检测到的QTL,发掘有助于稳定提高产量相关性状的杂种优势位点;寻找与杂种优势密切相关的分子标记,以期为今后的分子标记辅助选择育种提供一些思路。
1 材料与方法
1.1 试验材料
本试验共采用5套群体,其中染色体片段置换系IAS群体为65个株系(包含两个亲本IR24和Asominori),由南京农业大学提供;对应4套杂种F1群体,由IAS群体各株系为父本与荣丰A、中9A、1133A、1A 4个籼型不育系杂交得到F1组合构成(简称荣丰A/IAS F1;中9A/IAS F1;1133A/IAS F1;1A/IAS F1群体)。其中1133A和1A与置换系的组合是2012年配置的,荣丰A和中9A与置换系的组合是2013年配置的。
1.2 试验设计
2012年夏季在江西省农科院试验基地种植了IAS、1133A/IAS F1和1A/IAS F1共3套遗传群,2013年夏季在江西省农科院试验基地种植了IAS、荣丰A/IAS F1和中9A/IAS F1共3套遗传群,田间排布按随机区组设计,两次重复,每小区种2行,每行10株,每重复共种植20株,单本“宽窄行”种植。田间肥水管理同常规大田,及时进行病虫害防治。
1.3 性状考查
成熟后及时取样考种。每套群体每重复分别计数中间10株单株有效穗数,按单株有效穗数的均值对每份材料收取5个健康单株,剪收有效穗,分别装好晒干。考查的主要性状有:单株有效穗数(Panicles per plant,PPP)、平均穗长(Panicle length,PL)、着粒密度(Seeds density,SD)、结实率(Seeds set rate,SSR)和千粒质量(Thousand-grain weight,TGW);各性状表型值均取5株平均值。考种按中国稻种资源评价标准[11]进行。
1.4 数据分析
1.4.1 中亲优势(Midparental heterosis,HMP)的计算 染色体片段置换系F1群体的中亲优势(mid-pa-rental heterosis,HMP)计算公式为:HMP=F1不育系/IAS -IAS。
1.4.2 杂种优势位点(Heterotic loci,HL)的定位 以中亲优势HMP作为杂种优势QTL检测的基准表型值,结合新构建的基因型图谱,检测该置换系对应杂种F1群体中水稻产量密切相关农艺性状中表现杂种优势效应的QTL,所得标记的加性效应值Add(a)即视为杂种优势效应值HMP。QTL的检测采用逐步回归和极大似然估计相结合的方法(likelihood ratio test with stepwise regression,RSTEP-LRT),又称为RSTEP-LRT方法[12-15]。以LOD值≥2.0作为经验阈值来判断QTL是否存在。QTL命名遵循McCouch等[16]的方法,稍作调整。利用染色体片段置换系群体定位QTL的运算过程已由中国农科院作物所王建康博士编成软件QTL IciMapping(已编制了实现ICIM的交互式用户友好软件QTL IciMapping,可从http://www.isbreeding.net网站免费下载)。
2 结果与分析
2.1 IAS群体各测交杂种F1代产量相关农艺性状中亲优势表型变异
表1列示的是IAS群体以及各测交杂种F1代产量相关农艺性状中亲优势均值表现(群体均值)。各不育系与置换系杂交后,1A/IAS,1133A/IAS,荣丰A/IAS,中9A/IAS等F1组合的有效穗、平均穗长、着粒密度以及千粒质量各性状在群体表现上与置换系群体CSSL相比较具有不同程度的杂种优势,说明产量相关性状杂种优势的形成比较复杂。IAS群体杂种F1代除了结实率和千粒质量(1A/IASF1群体)性状表现为负向的中亲优势,其余性状均表现为正向的中亲优势,各性状也普遍存在双向超亲分离现象(数据未列示)。以上结果表明,水稻籼粳亚种间组合中结实率是制约产量提高的瓶颈因素。
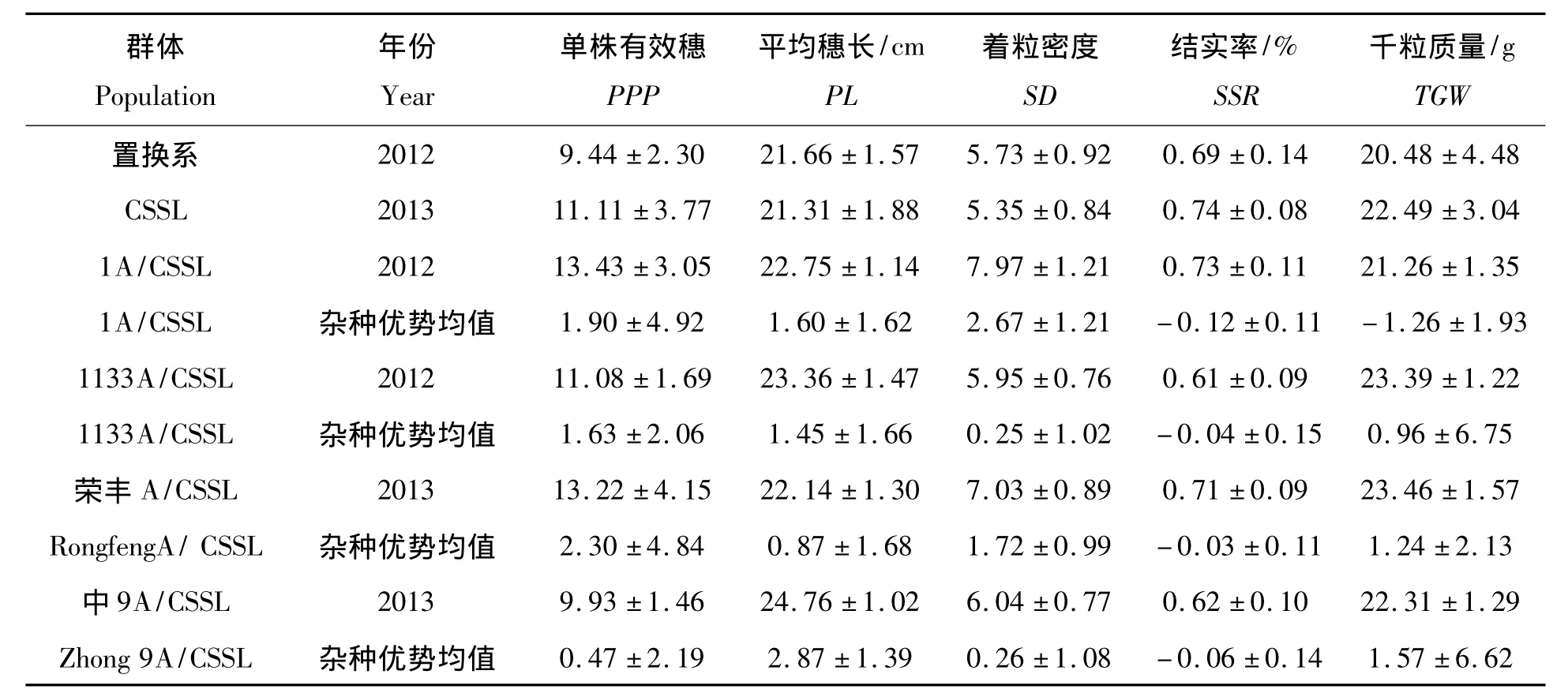
表1 各不育系与置换系杂种F1代产量相关农艺性状中杂种优势值Tab.1 Phenotypic performance of mid-parental heterosis concerning yield-related traits PPP,PL,SD,SSR,TGW in IAS F1derivatives crossed with four CMS lines
2.2 IAS各测交对应杂种F1代产量相关农艺性状中亲优势的方差分析
利用各测交对应杂种F1代产量相关农艺性状中亲优势的平均值进行了方差分析,从表2可知,单株有效穗数组合之间差异显著,环境之间差异极显著,组合与环境之间的互作差异极显著,表明单株有效穗数受环境的影响比较明显,是一个表现不稳定的性状;平均穗长组合、组合与环境之间的互作差异极显著,环境之间差异不显著,表明平均穗长是稳定遗传的性状,受环境的影响不大;着粒密度组合之间、组合与环境互作之间差异显著,但环境之间差异不显著,表明着粒密度性状也是稳定遗传的性状;结实率性状在组合、环境以及组合与环境之间互作差异均极显著,说明结实率性状受环境影响比较大,这也是水稻育种工作中的难题之一;而千粒质量只是组合之间差异显著,受环境的影响不大,是个稳定遗传的性状。
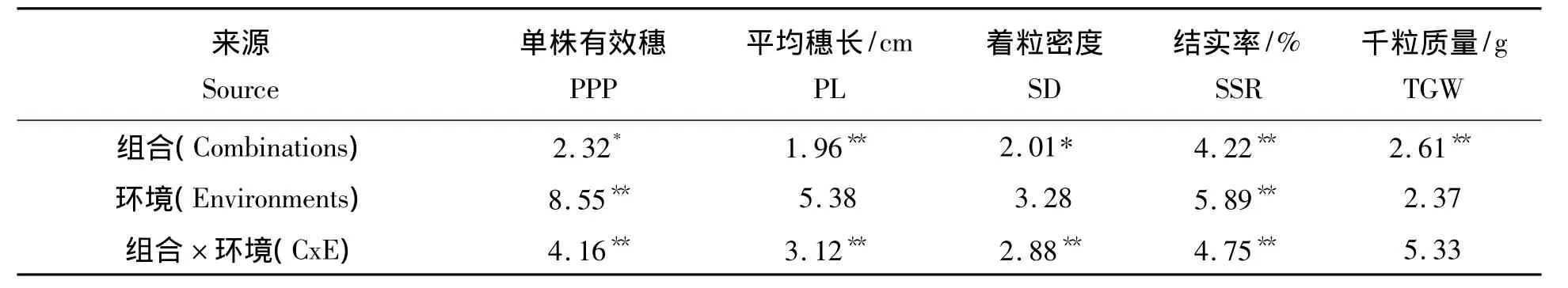
表2 各不育系与置换系杂种F1代产量相关农艺性状中亲优势(HMPValue)的方差分析Tab.2 ANOVA of mid-parental heterosis concerning yield related traits in PPP,PL,SD,SSR,TGW in IAS F1derivatives crossed with four CMS lines IAS F1derivatives
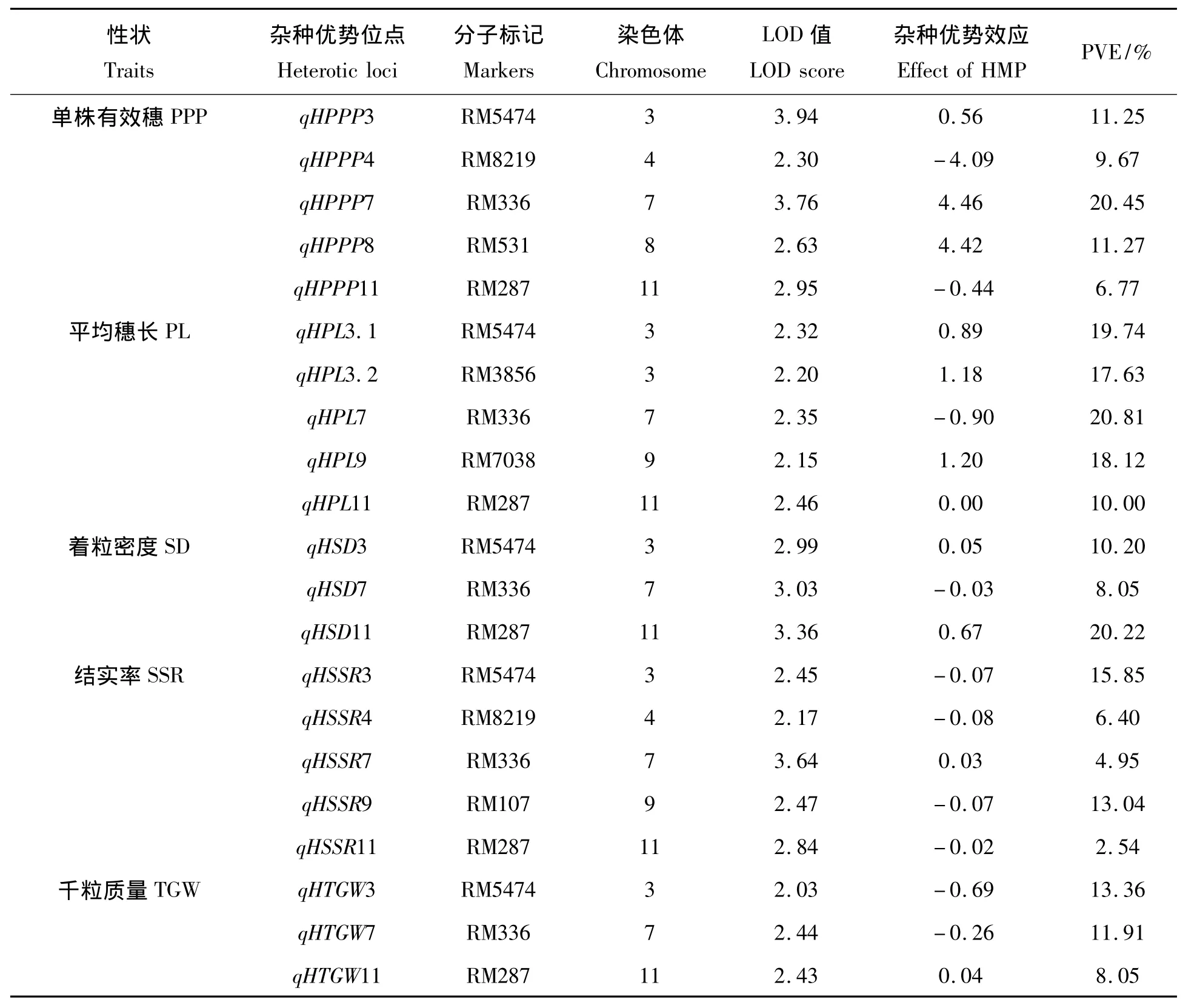
表3 1A/IAS F1群体中各农艺性状杂种优势位点分布Tab.3 Mapping heterotic loci affecting PPP,LP,SD,SSR and TGW traits in 1A/IAS F1derivatives
2.3 IAS各测交对应F1群体产量相关农艺性状杂种优势位点的定位
从表3可知,在1A/IAS F1群体中,共检测到21个产量相关性状杂种优势位点,分别位于第3、4、7、8、9、11染色体上。所有检测到影响单株有效穗、平均穗长、着粒密度、结实率、千粒质量等性状的位点中,位于第3、7、11染色体上的RM5474、RM336、RM287表现出一因多效,其中在单株有效穗性状中,RM5474的LOD值和PVE值分别为3.94、11.25%;RM336的 LOD 值和 PVE 值分别为3.76、20.45%;RM287的LOD值和PVE值分别为2.95、6.77%;在平均穗长性状中,RM5474的LOD值和PVE值分别为 2.32、19.74%;RM336 的 LOD 值分别为 2.35、20.81%;RM287 的 LOD 值和 PVE 值分别为 2.46、10.00%;在着粒密度性状中,RM5474的LOD值和PVE值分别为2.99、10.20%;RM336的LOD值和PVE值分别为3.03、8.05%;RM287 的 LOD 值分别为3.36、20.22%;在结实率性状中,RM5474 的 LOD 值和PVE值分别为2.45、15.85%;RM336的 LOD 值和 PVE 值分别为 3.64、4.95%;RM287的 LOD 值和PVE 值分别为2.84、2.54%;在千粒质量性状中,RM5474的 LOD 值和 PVE 值分别为 2.03、13.36%;RM336的 LOD 值和PVE 值分别为2.44、11.91%;RM287的 LOD 值和 PVE 值分别为2.43、8.05%;而位于第4染色体上的RM8219能影响单株有效穗和结实率两个性状。
从表4可知,在1133A/IAS F1群体中,共检测到21个产量相关性状杂种优势位点,分别位于第1、3、6、7、9、10、11染色体上。所有检测到影响单株有效穗、平均穗长、着粒密度、千粒质量等性状的位点中,位于第3、7、11染色体上的RM5474、RM336、RM287表现出一因多效,其中在单株有效穗性状中,RM5474的LOD值和 PVE 值分别为 2.88、6.35%;RM336的 LOD 值和 PVE 值分别为 2.75、6.38%;RM287的LOD值和PVE值分别为2.41、8.19%;在平均穗长性状中,RM5474的LOD值和PVE值分别为 2.40、3.06%;RM336 的 LOD 值分别为 2.62、7.37%;RM287 的 LOD 值和 PVE 值分别为 2.66、10.28%;在着粒密度性状中,RM5474的LOD值和PVE值分别为2.91、11.63%;RM336的LOD值和PVE值分别为2.91、11.63%;RM287 的 LOD 值分别为2.68、9.50%;在千粒质量性状中,RM5474 的 LOD 值和 PVE 值分别为3.01、11.10%;RM336的 LOD 值和 PVE 值分别为2.10、10.52%;RM287的LOD 值和PVE 值分别为 2.44、6.45%。
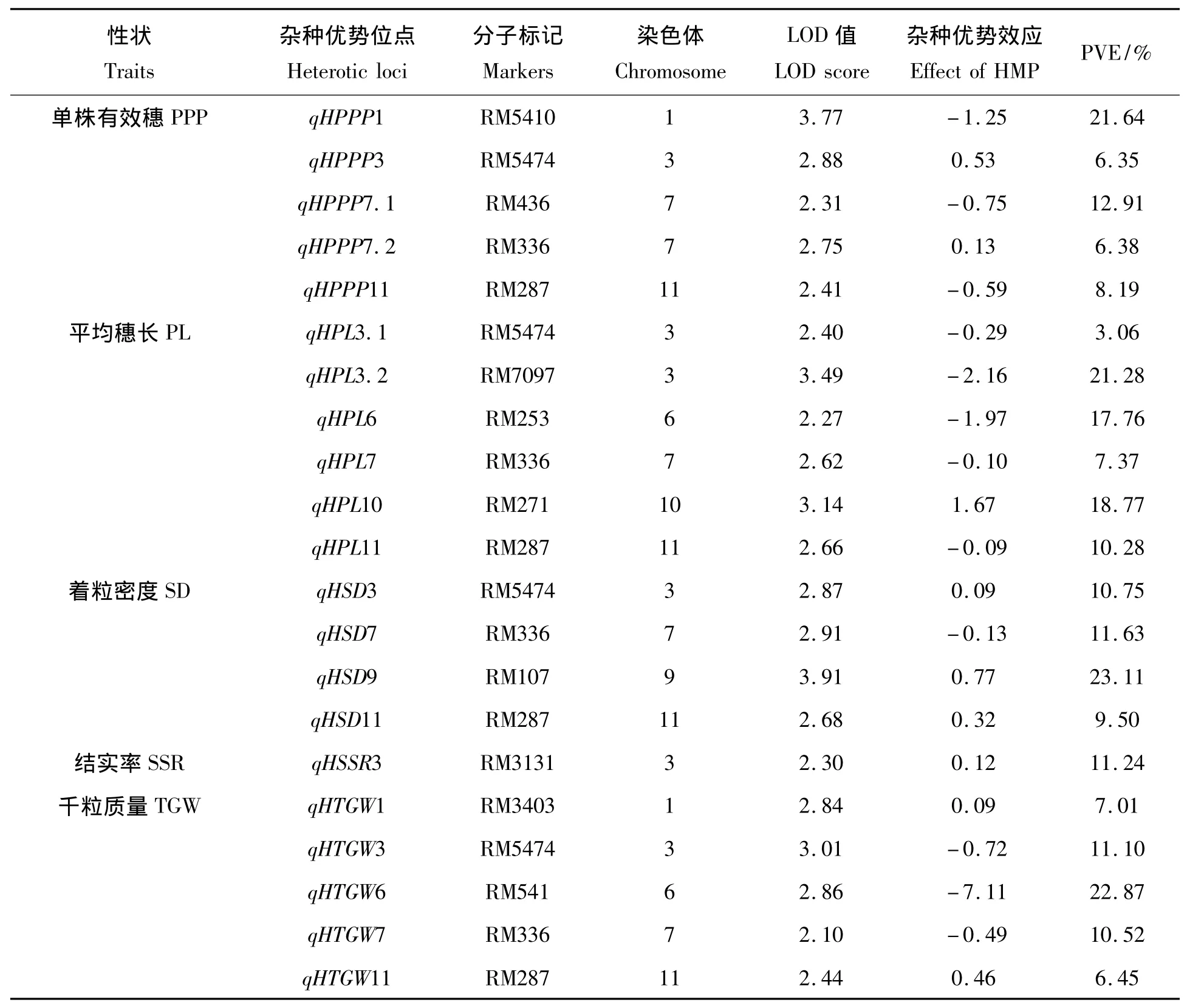
表4 1133A/IAS F1群体中各农艺性状杂种优势位点分布Tab.4 Mapping heterotic loci affecting PPP,LP,SD,SSR and TGW traits in 1133A/IAS F1derivatives
从表5可知,在荣丰A/IAS F1群体中,共检测到24个产量相关性状杂种优势位点,分别位于第1、3、5、6、7、8、9、10、11、12 染色体上。所有检测到影响单株有效穗、平均穗长、着粒密度、千粒质量等性状的位点中,位于第3、7、11染色体上的RM5474、RM336、RM287能控制多个性状,其中在单株有效穗性状中,RM5474的LOD值和 PVE值分别为3.07、18.24%;RM336的 LOD值和 PVE值分别为2.22、6.08%;RM287的LOD值和PVE值分别为2.90、22.17%;在平均穗长性状中,RM5474的 LOD值和PVE值分别为2.59、7.45%;RM336的 LOD 值分别为3.12、16.81%;RM287的 LOD 值和 PVE 值分别为2.57、7.08%;在着粒密度性状中,RM5474的 LOD 值和 PVE 值分别为2.57、5.31%;RM336的 LOD值和 PVE 值分别为3.10、2.39%;RM287的 LOD 值分别为2.70、8.99%;在千粒质量性状中,RM5474的 LOD 值和PVE 值分别为2.37、20.93%;RM336的 LOD 值和 PVE值分别为2.79、12.01%;RM287的LOD 值和 PVE 值分别为3.09、10.04%。
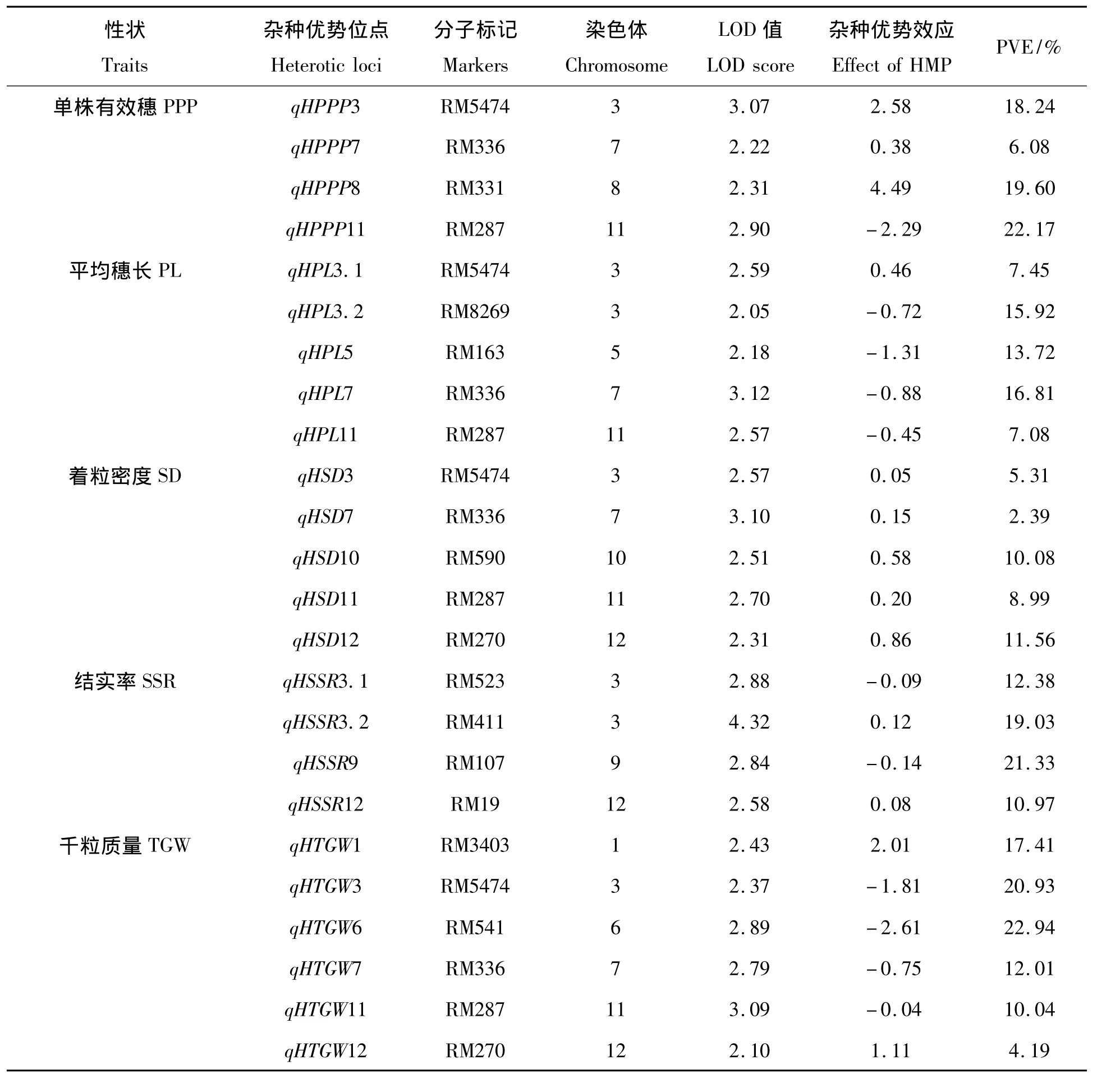
表5 荣丰A/IAS F1群体中各农艺性状杂种优势位点分布Tab.5 Mapping heterotic loci affecting PPP,LP,SD,SSR and TGW traits in Rongfeng A/IAS F1derivatives
从表6可知,在中9A/IAS F1群体中,共检测到28个产量相关性状杂种优势位点,分别位于第1、3、6、7、9、10、11染色体上。所有检测到影响单株有效穗、平均穗长、着粒密度、千粒质量等性状的位点中,位于第3、7、11染色体上的RM5474、RM336、RM287表现出一因多效,其中在单株有效穗性状中,RM5474的LOD 值和PVE 值分别为3.22、18.19%;RM336的LOD 值和 PVE 值分别为3.29、10.29%;RM287的 LOD值和PVE值分别为2.55、7.12%;在平均穗长性状中,RM5474的LOD值和PVE值分别为4.07、23.91%;RM336的LOD 值分别为2.54、3.43%;RM287的 LOD 值和 PVE 值分别为2.67、8.34%;在着粒密度性状中,RM5474的LOD值和PVE 值分别为2.84、10.00%;RM336的 LOD 值和 PVE 值分别为2.19、7.26%;RM287的LOD值分别为2.76、5.63%;在千粒质量性状中,RM5474的 LOD 值和 PVE值分别为2.16、6.16%;RM336的LOD值和PVE值分别为2.47、10.05%;RM287的LOD值和PVE值分别为3.78、11.19%。
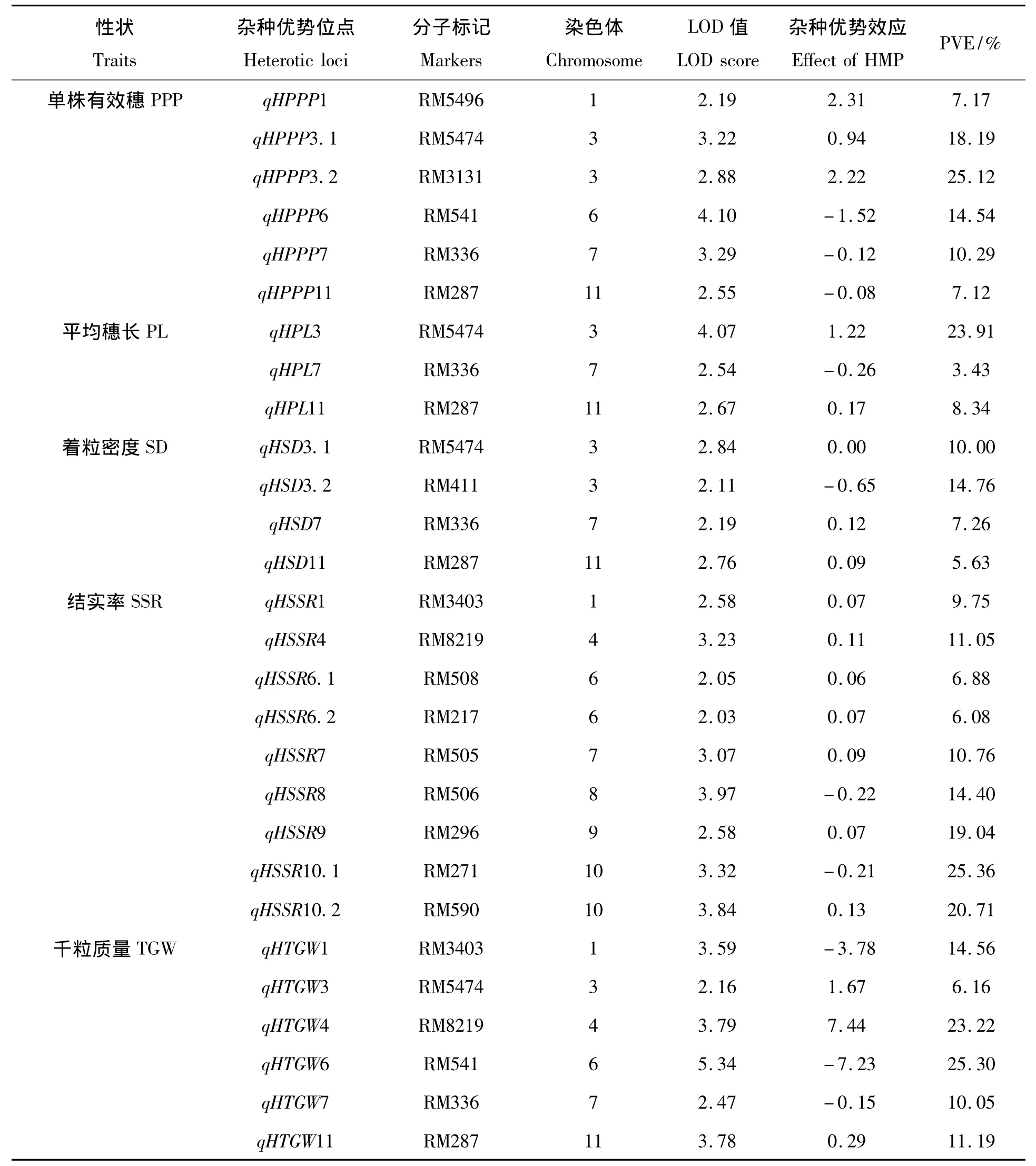
表6 中9A/IAS F1群体中各农艺性状杂种优势位点分布Tab.6 Mapping heterotic loci affecting PPP,LP,SD,SSR and TGW traits in Zhong9A/IAS F1derivatives
3 讨论
IR24是野败型不育系最早配套的强优势恢复系,也是杂交籼稻育种早期的核心种质之一,利用它选育出大量的衍生恢复系。因此,利用染色体片段置换系来研究IR24的杂种优势位点及杂种优势形成原因可为今后的三系杂交水稻育种提供一些参考信息。
本研究结果发现在生产上大面积应用的不育系中9A/CSSL,荣丰A/CSSL测交F1群体中分别检测到28和24个杂种优势位,其中正向增效的杂种优势位点为18个和13个;而自主选育的已稳定但未审定的不育系1133A/CSSL,1A/CSSL测交F1群体中分别检测到21和21个杂种优势位点,其中正向增效的杂种优势位点只有9个和11个;这说明含有正向杂种优势位点多的不育系在育种过程中由于更多的有利等位基因的互补,所以更容易配置出优良组合。本研究所定位到的杂种优势位点是否具有代表性还需要通过其它育种材料大量的测交和位点分析加以证明。
本研究中染色体片段置换系各株系与各不育系测配后发现具有一定程度的杂种优势,但不同的农艺性状杂种优势表现不一致,其中每穗粒数的杂种优势比较显著,而着粒密度和千粒质量的杂种优势较小(数据未列示),可见不同性状杂种优势表现的差异性是产量杂种优势遗传基础复杂性的外在反映。各性状均存在正向增效和负向减效杂种优势标记位点。通过染色体片段置换系IAS群体与各IASF1群体之间的差异表现,利用IAS各对应杂种F1群体1133A/IAS、1A/IAS、中9A/IAS和荣丰A/IAS分别检测到杂种优势位点分别为21(9正向增效)、21(11正向增效)、28(18正向增效)和24(13正向增效)个影响产量构成性状杂种优势的表现。从HL效应的方向来看,IAS各对应F1群体检测到的94个杂种优势标记基因位点中,有51个增效位点,占总位点数的54.26%,表明来自Asominori的等位基因导入到籼稻IR24中能增强F1代的杂种优势表现,因此来自粳稻亲本Asominori置换片段携带的等位基因能够用来改良籼型杂交稻;对于同一个座位上不同等位基因之间等位基因互作造成的负向杂种优势,如本研究中检测到的43个减效位点,应该尽量避免或者通过多代回交重组等育种手段打破这些不利的互作。
在育种过程中,那些增效的优势位点具有直接的应用价值,可以通过杂交重组结合标记辅助选择不断聚合累加这些有益的等位基因产生的杂种优势,通过染色体片段置换的技术,可能在后代中选择到强优势的株系作为中间材料或直接的育种亲本,再通过与不育系的广泛测配可以选择到强优势的杂交组合。对于含有劣势位点的杂种F1组合,如果还有其它育种价值,则可以通过与背景亲本的回交重组,将劣势位点置换掉,亦可在后代中选择到适宜的株系作为中间材料用于育种[9]。
前人研究表明,数量性状位点尤其是杂种优势位点受不同遗传背景以及环境的影响很大,重演性很差。Hua等[17]两年研究发现大部分的HL无重演性;陈深广等[18]以中亲优势值表示杂种优势进行杂种优势的QTL定位,结果表明大部分杂种优势QTL的重演性不好。Li等[7]也检测到很多的HL,但重演性不高,认为可能是由于不同的遗传背景各QTL之间的互作方式不同,导致同一QTL效应及方向不同。赵芳明等[19]研究发现,大部分的QTL具有不稳定性,说明不同遗传背景以及不同环境对于数量性状位点的影响很大。本研究在4套杂种F1群体中共检测到94个与杂种优势相关的QTL,其中大部分的QTL在各群体中没有重演性,说明水稻重要农艺性状的表现不仅受基因等遗传因素的影响,而且外界的环境因素也起着重要的作用。在以上5个与产量密切相关的性状中,位于第3、7、11染色体上与分子标记RM5474、RM336、RM287密切相关的3个QTL虽然效应较小,属于微效基因;但却表现出一因多效现象,说明这3个QTL与各农艺性状紧密连锁,育种过程中应注意利用有益的连锁QTL,尽量避免不利的连锁;有意思的是,这3个QTL在4套群体中都能检测到,不过由于本研究4套群体均只进行了一年的大田试验,QTL检测所采用的LOD值比较小(LOD≥2.0),而且大部分的效应值均比较微弱,是否具有特异性或代表性,还是因为统计误差等原因还需要进一步试验来确定。
致谢:感谢南京农业大学水稻所提供的染色体片段置换系群体。
[1]Mei H W,Li Z K,Shu Q Y,et al.Gene actions of QTL affecting several agronomic traits resolved in a recombinant inbred rice population and two backcross populations[J].Theor Appl Genet,2005,110:649-659.
[2]Xiao J H,Li J,Yuan L,et al.Dominance is the major genetic basis of heterosis in rice as revealed by QTL analysis using molecular markers[J].Genetics,1995,140:745-754.
[3]Li Z K,Pinson S R M,Paterson A H,et al.Epistasis for three grain yield components in rice(Oryza sativa L.)[J].Genetics,1997,145:453-465.
[4]Li Z K,Luo L J,Mei H W,et al.Overdominance epistatic loci are the primary genetic basis of inbreeding depression and het-erosis in rice.I.Biomass and grain yield[J].Genetics,2001,158:1737-1753.
[5]Luo L J,Li Z K,Mei H W,et al.Overdominance epistatic loci are the primary genetic basis of inbreeding depression and heterosis in rice.II.Grain yield components[J].Genetics,2001,158:1755-1771.
[6]Mei H W,Luo L J,Ying C S,et al.Gene actions of QTLs affecting several agronomic traits resolved in a recombinant inbred rice population and two testcross populations[J].Theor Appl Genet,2003,107:89-101.
[7]Li L Z,Lu K Y,Chen Z M,et al.Dominance,overdominance and epistasis condition the heterosis in two heterotic rice hybrids[J].Genetics,2008,180:1725-1742.
[8]Wang Z Q,Yu C Y,Wan J M,et al.Identification of Indica rice chromosome segments for the improvement of Japonica inbreds and hybrids[J].Theor Appl Genet,2012,124:1351-1364.
[9]王智权.利用染色体片段置换系剖析水稻釉粳亚种间产量相关农艺性状杂种优势的遗传基础[D].南京:南京农业大学,2010.
[10]王智权,江玲,尹长斌,等.水稻产量相关农艺性状杂种优势位点的定位[J].中国水稻科学,2013,27(6):569-576.
[11]应存山主编.中国稻种资源[M].北京:中国农业科技出版社,1993:530-531.
[12]Wang J K,Wan X Y,Crossa J,et al.QTL mapping of grain length in rice(Oryza sativa L.)using chromosome segment substitution lines[J].Genet Res Camb,2006,88:93-104.
[13]Wang J K,Wan X Y,Li H H,et al.Application of identified QTL-marker associations in rice quality improvement through a design-breeding approach[J].Theor Appl Genet,2007,115:87-100.
[14]Li H H,Ye G,Wang J.A modified algorithm for the improvement of composite interval mapping[J].Genetics,2007,175:361-374.
[15]Li H H,Ribaut J M,Li Z L,et al.Inclusive composite interval mapping(ICIM)for digenic epistasis of quantitative traits in biparental populations[J].Theor Appl Genet,2008,116:243-260.
[16]McCouch S R,Chen X,Panaud O,et al.Microsatellite marker development,mapping and applications in rice genetics and breeding[J].Plant Mol Biol,1997,35:89-99.
[17]Hua J P,Xing Y Z,Wu W R,et a1.Single-locus heterotic effects and dominace by dominance interactions can adequately explain the genetic basis of heterosis in an elite rice hybrid[J].Genetics,2003,100:2574-2579.
[18]陈深广,沈希宏,曹立勇,等.水稻产量性状杂种优势的QTL定位[J].中国农业科学,2010,43(24):4983-4990.
[19]赵芳明,朱海涛,丁效华,等.基于SSSL的水稻重要性状QTL的鉴定及稳定性分析[J].中国农业科学,2007,40(3):447-456.
