软组织肉瘤术后局部复发因素分析
2015-05-14江军OliverPeckNicholasClementDanielEdwardPorter
江军 Oliver Peck Nicholas D Clement Daniel Edward Porter
软组织肉瘤术后局部复发因素分析
江军 Oliver Peck Nicholas D Clement Daniel Edward Porter
作者单位:100016 北京,清华大学第一附属医院骨科 ( 江军、Daniel Edward Porter );英国爱丁堡皇家医院骨科 ( Oliver Peck、Nicholas D Clement )
【摘要】目的 探讨软组织肉瘤 ( soft tissue sarcoma,STS ) 患者术后局部复发的因素。方法 回顾分析 1995 年至 2010 年,英国爱丁堡皇家医院手术治疗的 79 例 STS 患者的随访结果。男 44 例,女 35 例;年龄18~97 岁,平均 62.9 岁。79 例随访 6~139 个月,平均 41 个月。组织学诊断由 2 名隶属于英国国家组织病理学专家组的成员来确定。肿瘤分级按 Trojani 分级评定。Trojani 1 级定义为低度恶性,Trojani 2 级和 3 级定义为高度恶性。阳性外科边界的标准是,在组织学切片上,发现切除边缘任何部位存在肿瘤细胞。结果 本组 79 例中,21 例阳性边界者 14 例复发,7 例未复发;58 例阴性边界者 9 例复发,49 例未复发 ( P<0.0001,OR=10.9 )。53 例高度恶性者 20 例复发,33 例未复发;26 例低度恶性者,3 例复发,23 例未复发 ( P=0.016,OR=4.6 )。43 例进行辅助治疗者 19 例复发,24 例未复发;36 例非辅助治疗者 4 例复发,32 例未复发( P=0.001,OR=6.3 )。17 例肿瘤转移者 8 例复发,9 例未复发;62 例未转移者 15 例复发,47 例未复发 ( P=0.07,OR=2.8 )。肿瘤组织学分级、阳性边界和是否进行辅助治疗是局部复发的相关因素;肿瘤是否转移与局部复发无相关性。高度恶性肿瘤是低度恶性肿瘤的 5.2 倍,阳性边界是阴性边界的 3.3 倍,是导致局部复发的独立危险因素。结论 外科边界和肿瘤组织学级别是导致局部复发的最重要影响因素。高度恶性肿瘤患者的阳性边界通常会提高肿瘤的复发几率。
【关键词】肉瘤;软组织肿瘤;肿瘤复发,局部;肿瘤分级;外科手术;肿瘤
【Key words】 Sarcoma; Soft tissue neoplasms; Neoplasm recurrence, local; Neoplasm grading; Surgical procedures, operative; Neoplasms
软组织肉瘤 ( soft tissue sarcoma,STS ) 是在除骨、空腔脏器、血液和网状内皮系统外,发生在其余解剖部位的原发性间质肿瘤[1]。在英国,每年有约 2300 例 STS 新发病例。1997 年至 2007 年,其发病率上升了 26%[2]。然而,因 STS 在所有恶性肿瘤的成年患者中仅占 1%,而被视为少见肿瘤[3]。
近年来,STS 的主要治疗方法是附带或不带辅助治疗的保肢手术,而不再是离断手术[4-6],但是,有时由于肿瘤过大 ( 因延迟诊断而造成的 )、肿瘤的侵袭性、肿瘤靠近重要的解剖结构和 ( 或 ) 手术技术等原因,要广泛切除或达到阴性边界是不可能的[4]。目前,与英国的 STS 患者相比,其它国家的 STS 患者处于更晚期阶段 ( Scandinavian 肉瘤登记组织的数据显示肿瘤大小的中位数为 10 cm vs 7 cm )[7-8]。许多研究证实阳性 ( 受污染的 ) 边界增加局部复发的风险[9-11]。也有研究表明,局部复发患者预后不佳[12-13]。保肢手术可能降低患者的存活率。其有效性取决于诸如对肿瘤的分级和辅助治疗等因素。
肿瘤分级对了解肿瘤的转移潜能和患者的总体存活率至关重要。然而,肿瘤的级别是否影响局部复发率还有争论。有研究证明肿瘤级别和复发存在相关性,对于高度恶性肿瘤,尽管术后常规放疗,但其复发率仍高达 15%~30%,而低度恶性肿瘤患者的术后复发率仅为 0%~10%[14-16]。然而,一些多变量分析研究证实,肿瘤级别不是一个独立的局部复发的预后因素[17-19]。肿瘤分级对其局部复发影响的不同结论,也许是因为手术理念和术后辅助治疗方法的不同所致。
阳性边界是影响局部复发的一个重要因素,如果能进一步明确肿瘤级别对复发的影响程度,就能精准地预估复发的风险,这将有助于手术方案的确定。高度恶性 STS 患者不管是否阳性边界,术后均常规辅助放疗,应评估辅助放疗对阳性边界的有效性。Kawaguchi 等[20]发现在阳性边界的情况下,对高度恶性肿瘤患者,行辅助放疗不能有效控制其局部复发,但对低度恶性肿瘤患者,辅助放疗可以取得满意疗效。这支持对高度恶性肿瘤且阳性边界的患者行根治手术,而不是辅助放疗。1995 年至 2010年,英国爱丁堡皇家医院对 79 例 STS 患者进行了手术切除,现将随访结果报告如下。
资料与方法
一、一般资料
本组 79 例,男 44 例,女 35 例,年龄 18~97 岁,平均 62.9 岁。大多数 ( 58 例,73.42% ) 肿瘤位于下肢。资料来自英国爱丁堡皇家医院的肿瘤研究所和骨科患者数据库。
纳入标准:( 1 ) 1995 年至 2010 年,英国爱丁堡皇家医院骨科的经治病例;( 2 ) 肢体或躯干 STS;( 3 ) 年龄>16 岁;( 4 ) 随访至少 6 个月。
排除标准:( 1 ) 非本中心诊治的患者;( 2 ) 头面部的 STS;( 3 ) 儿童患者;( 4 ) 随访少于 6 个月。
二、治疗方法和数据分析
所有患者接受了手术治疗,外科边界为边缘或广泛切除。组织学诊断由 2 名隶属于英国国家组织病理学专家小组的成员确定。按 Trojani 分级系统[21]进行肿瘤分级评定。根据本研究的目的,Trojani 1 级定义为低度恶性,Trojani 2 级和 3 级定义为高度恶性。阳性外科边界的标准是,在组织学切片上,发现切除边缘任何部位存在肿瘤细胞 ( 表 1 )。
数据使用 Microsoft Excel 和 IBM SPSS 进行分析。这些统计资料被用来计算百分比,中位数,P 值,优势比 ( OR ),构造图和 Kaplan-Meier 生存曲线。

表 1 数据搜集的具体参数Tab.1 Specific parameters for data collection
结 果
79 例接受手术切除的患者中,21 例 ( 26.58% )术后为阳性边界。33 例 ( 41.77% ) 接受放疗;10 例( 12.66% ) 接受化疗。
瘤体直径 0.9~30 cm,平均 9.6 cm。53 例确诊为高度恶性肿瘤。本组随访 6~139 个月,平均41 个月。23 例 ( 29.11% ) 局部复发,复发时间 6~84 个月,平均 30 个月 ( 表 2 )。
本组患者的生存率 ( 表 3 ) 和 Kaplan-Meier 生存曲线 ( 图 1 )。5 年累积生存率为 63.82% ( 95% CI 62%~66% )。
1. 局部复发:表 4 显示局部复发的各单因素情况,组织学分级,79 例中,高度恶性复发 20 例,未复发 33 例,低度恶性复发 3 例,未复发 23 例( P=0.016,OR=4.6 );阳性边界者复发 14 例,未复发 7 例,阴性边界者复发 9 例,未复发 49 例( P<0.0001,OR=10.9 );辅助治疗组复发 19 例,未复发 24 例,非辅助治疗组复发 4 例,未复发32 例 ( P=0.001,OR=6.3 )。组织学分级、阳性边界、辅助治疗与局部复发有相关性。肿瘤转移者复发 8 例,未复发 9 例,未转移者复发 15 例,未复发47 例 ( P=0.07,OR=2.8 ),局部复发与肿瘤转移与否无相关性。

表 2 79 例患者的临床资料Tab.2 Clinical data of 79 patients

图 1 Kaplan-Meier 生存曲线图Fig.1 Kaplan-Meier survival curve

表 3 79 例患者生存情况Tab.3 Survival information of 79 patient

表 4 局部复发的单因素分析Tab.4 Local recurrence univariate analysis
复发的预后因素 Cox 回归分析结果显示:肿瘤的组织学分级和阳性边界是 2 个复发的危险因素( 表 5 )。高度恶性肿瘤患者的复发率是低度恶性肿瘤患者的 5.2 倍,阳性边界的复发率是阴性的 3.3 倍。
在切除后边界呈阳性的病例中,高度恶性肿瘤患者更容易复发 ( χ2=4.42,P=0.04 ) ( 图 2 )。低度恶性肿瘤患者更多为阴性边界 ( 92.31% 低度恶性 vs 64.15% 高度恶性,χ2=7.086,P=0.008 )。即使是阴性边界的低度恶性肿瘤患者,也存在局部复发的风险 ( 12.50% 低度恶性 vs 17.65% 高度恶性 )。阳性边界高度恶性患者的局部复发率高达 73.68% ( 14 例/19 例 )。根据病理结果和术中情况,术者建议部分患者行术后辅助治疗 ( 33 例放疗,10 例化疗 ),应用辅助治疗组局部复发率为 44.19%,无辅助治疗组局部复发率为 11.11%。其中 21 例边界阳性患者均进行了术后放疗,有 15 例复发,复发率高达 71.43%。
2. 肿瘤组织学分级和阳性边界对总体生存率的影响 ( 图 3 ):阳性边界患者,术后 5 年生存率为37%,而阴性边界患者术后 5 年生存率则为 72%。高度恶性肿瘤患者术后 5 年生存率为 51%,而低度恶性肿瘤患者术后 5 年生存率则为 87% ( 图 4 ) 。

图 2 阳性边界患者肿瘤分级与局部复发风险的关系Fig.2 Positive margin: tumor grade and local recurrence risk

表 5 复发的独立预后因素 Cox 回归分析Tab.5 Independent prognostic factors of recurrence, Cox regression analysis

表 6 组织学分级和外科边界的患者复发例数Tab.6 Patients of recurrence: histological grade and surgical margin
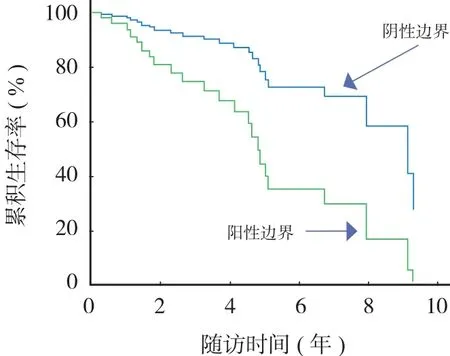
图 3 不同切除边界的生存率Fig.3 Survival rates of different resection margin

图 4 不同肿瘤分级的生存率Fig.4 Survival rates of different tumor grade
讨 论
就肿瘤患者的治疗原则而言,控制局部复发,以最大限度地提高其生存率,是 STS 治疗的主要目的。局部复发是影响预后的重要因素[12-13],也是降低整体生存率的主要危险因素[22]。本组 79 例,平均随访 41 个月,23 例局部复发,复发率为 29.11%,与文献报道的 29%~39% 的复发率一致[13]。本研究结果显示外科边界和肿瘤组织学分级均为局部复发的独立风险因素。
本组病例,男性患者局部复发率为 29.55% ( 13 例/44 例 ),女性患者局部复发率为 28.57% ( 10 例/35 例 ),P=0.92;肿瘤转移,发生转移组的局部复发率为 47.06% ( 8 例/17 例 ),无转移组的局部复发率为 24.19% ( 15 例/62 例 ),P=0.07;肿瘤深度,表浅组的局部复发率为 27.50% ( 11 例/40 例 ),深在组的局部复发率为 30.77% ( 12 例/39 例 ),P=0.75;肿瘤间室,间室内组的局部复发率为 34.78% ( 16 例/46 例 ),间室外组的局部复发率为 21.21% ( 7 例/33 例 ),P=0.19;结果表明性别、肿瘤转移、肿瘤深度、肿瘤间室与局部复发的相关性无统计学意义。
组织学分级,高度恶性肿瘤的局部复发率为37.74% ( 20 例/53 例 ),低度恶性肿瘤的局部复发率为 11.54% ( 3 例/26 例 ),P 值=0.016;外科边界,阳性边界组的局部复发率为 66.67% ( 14 例/21 例 ),阴性边界组的局部复发率为 15.52% ( 9 例/58 例 ),P 值<0.0001;辅助治疗,辅助治疗组的局部复发率为 44.19% ( 19 例/43 例 ),未行辅助治疗组的局部复发率为 11.11% ( 4 例/36 例 ),P=0.001;结果表明组织学分级、外科边界、辅助治疗与局部复发有相关性。辅助治疗组的复发率明显高于未行辅助治疗组,这是因为术者通常会对高度恶性或阳性边界的高危患者建议辅助治疗,这些接受辅助治疗的患者本身就有较高的潜在复发风险,而本组结果证实辅助治疗控制局部复发的效果不佳。
对高度恶性肿瘤患者而言,阳性边界是预后的最重要的影响因素。本组 19 例高度恶性且为阳性边界患者,14 例局部复发 ( 73.68% )。26 例低度恶性肿瘤患者,2 例阳性边界者未复发。这一结果支持阳性边界是潜在复发风险因素的观点[24-25]。由于阳性边界的残存肿瘤组织的体积相对较大,放疗效果有限,本组病例中 21 例边界阳性患者均进行了术后辅助放疗,有 15 例复发,复发率高达 71.43%。这种情况下,选择进一步的根治术是一个合理的决定[26-27],尽管患者仍然可能由于肿瘤的远处转移导致死亡[18,28]。另外,高度恶性肿瘤患者,即使进行了彻底的边缘切除,其卫星病灶也会增加局部复发的风险[29-30]。对于存在这种微小卫星病灶的肿瘤患者,术后进行辅助放疗是有效的[18,28]。因此,对高度恶性的患者,建议术后常规进行辅助治疗。
本组资料显示低度恶性肿瘤患者中阴性边界多见 ( 92.31% 低度恶性 vs 64.15% 高度恶性,χ2=7.086,P=0.008 )。在高度恶性肿瘤患者中,由于肿瘤的侵袭性生长,阴性边界较难获得。由于阳性边界者局部复发率高,其生存率会明显降低,因此,手术应力争达到阴性边界。截肢手术即使会给患者带来一些心理问题,却更有利于长期局部控制[4]。保肢手术致使边界接近重要的神经、血管结构。通过重建这些结构来增加切除边界的作法,可能会增加并发症发生率。
本组资料显示在 26 例低度恶性肿瘤中,阳性边界 2 例未复发,而阴性边界 24 例中有 3 例复发,考虑为样本量较小的原因。
阳性边界和肿瘤组织学级别是导致局部复发的最重要影响因素。高度恶性肿瘤患者的阳性边界通常会提高肿瘤的复发几率,且术后辅助放疗效果有限。因此,本研究结果支持对高度恶性肿瘤患者进行手术时,应以获得阴性边界为目的。
参 考 文 献
[1] Leow AM, Halim AS, Wan Z. Reconstructive treatment following resection of high-grade soft-tissue sarcomas of the lower limb. J Orthop Surg (Hong Kong), 2005, 13(1):58-63.
[2] Zahm SH, Fraumeni JF Jr. The epidemiology of soft tissue sarcoma. Semin Oncol, 1997, 24(5):504-514.
[3] Jemal A, Tiwari RC, Murray T, et al. Cancer statistics, 2004. CA Cancer J Clin, 2004, 54(1):8-29.
[4] Rosenberg SA, Tepper J, Glatstein E, et al. The treatment of soft-tissue sarcomas of the extremities: prospective randomized evaluations of (1) limb-sparing surgery plus radiation therapy compared with amputation and (2) the role of adjuvant chemotherapy. Ann Surg, 1982, 196(3):305-315.
[5] Karakousis CP, Emrich LJ, Rao U, et al. Feasibility of limb salvage and survival in soft tissue sarcomas. Cancer, 1986, 57(3):484-491.
[6] Brennan MF, Casper ES, Harrison LB, et al. The role of multimodality therapy in soft-tissue sarcoma. Ann Surg, 1991, 214(3):328-36; discussion 336-338.
[7] Bauer HC, Trovik CS, Alvegård TA, et al. Monitoring referral and treatment in soft tissue sarcoma: study based on 1,851 patients from the Scandinavian Sarcoma Group Register. Acta Orthop Scand, 2001, 72(2):150-159.
[8] Allgar VL, Neal RD. Delays in the diagnosis of six cancers: analysis of data from theNational Survey of NHS patients: Cancer. Br J Cancer, 2005, 92(11):1959-1970.
[9] Gronchi A, Casali PG, Mariani L, et al. Status of surgical margins and prognosis in adult soft tissue sarcomas of the extremities: a series of patients treated at a single institution. J Clin Oncol, 2005, 23(1):96-104.
[10] LeVay J, O’Sullivan B, Catton C, et al. Outcome and prognostic factors in soft tissuesarcoma in the adult. Int J Radiat Oncol Biol Phys, 1993, 27(5):1091-1099.
[11] Tanabe KK, Pollock RE, Ellis LM, et al. Influence of surgical margins on outcome in patients with preoperatively irradiated extremity soft tissue sarcomas. Cancer, 1994, 73(6):1652-1659.
[12] Rööser B, Attewell R, Berg NO, et al. Survival in soft tissue sarcoma. prognosticvariables identified by multivariate analysis. Acta Orthop Scand, 1987, 58(5):516-522.
[13] Cantin J, McNeer GP, Chu FC, et al. The problem of local recurrence after treatment of soft tissue sarcoma. Ann Surg, 1968, 168(1):47-53.
[14] Chang HR, Hajdu SI, Collin C, et al. The prognostic value of histologic subtypes in primary extremity liposarcoma. Cancer, 1989, 64(7):1514-1520.
[15] Suit HD, Russell WO, Martin RG. Sarcoma of soft tissue: clinical and histopathologicparameters and response totreatment. Cancer, 1975, 35(5):1478-1483.
[16] Lindberg RD, Martin RG, Romsdahl MM, et al. Conservative surgery andpostoperative radiotherapy in 300 adults with softtissue sarcomas. Cancer, 1981, 47(10):2391-2397.
[17] Fein DA, Lee WR, Lanciano RM, et al. Management of extremity soft tissue sarcomas withlimb-sparing surgery postoperative irradiation: do total dose, overall treatment time, and thesurgery-radiotherapy interval impact on local control? Int J Radiat Oncol Biol Phys, 1995, 32(4):969-976.
[18] Pisters PWT, Harrison LB, Leung DHY, et al. Long-term results of a prospective randomized trial of adjuvant brachytherapy in soft tissue sarcoma. J Clin Oncol, 1996, 14(3):859-868.
[19] Potter DA, Kinsella T, Glatstein E, et al. High-grade soft tissue sarcomas of the extremities. Cancer, 1986, 58(1):190-205.
[20] Kawaguchi N, Matumoto S, Manabe J. New method of evaluating the surgical margin and safety margin for musculoskeletal sarcoma, analysed on the basis of 457 surgical cases. J Cancer Res Clin Oncol, 1995, 121(9-10):555-563.
[21] Coindre JM, Trojani M, Contesso G, et al. Reproducibility of a histopathologic grading system for adult soft tissue sarcoma. Cancer, 1986, 58(2):306-309.
[22] Novais E, Demiralp B, Alderete J, et al. Do surgical margin and local recurrence influence survival in soft tissue sarcomas? Clin Orthop Relat Res, 2010, 468(11):3003-3011.
[23] http://cn.mathworks.com/help/stats/kaplan-meier-methods. html[2015-06-01]
[24] 刘宏炜, 牛晓辉, 徐海荣. 软组织肉瘤治疗现状. 中国骨与关节杂志, 2013, 11(2):108-111.
[25] 李远, 牛晓辉, 徐海荣. 原发肢体软组织肉瘤208例预后的影响因素分析. 中华外科杂志, 2011, 49(11):964-969.
[26] Markhede G, Angervall L, Stener B. A multivariate analysis of the prognosis after surgical treatment of malignant soft-tissue tumors. Cancer, 1982, 49(8):1721-1733.
[27] Ueda T, Aozasa K, Tsujimoto M, et al. Multivariate analysis for clinical prognostic factors in 163 patients with soft tissue sarcoma. Cancer, 1988, 62(7):1444-1450.
[28] Yang JC, Chang AE, Baker AR, et al. Randomized prospective study of the benefit of adjuvant radiation therapy in the treatment of soft tissue sarcoma of the extremity. J Clin Oncol, 1998, 16(1):197-203.
[29] Gerrand CH, Wunder JS, Kandel RA, et al. Classification of positive margins afterresection of soft-tissue sarcoma of the limb predicts the risk of local recurrence. J Bone Joint Surg Br, 2001, 83(8):1149-1155.
[30] Giuliano AE, Eilber FR, Morton DL.The management of locally recurrent soft tissuesarcoma. Ann Surg, 1982, 196(1):87-91.
( 本文编辑:李贵存 )
. 论著 Original article .
Impact factor analysis of postoperative local recurrence of soft tissue sarcoma
JIANG Jun, Oliver Peck, Nicholas
D Clement, Daniel Edward Porter
Department of Orthopaedic Surgery, 1st Affiliated Hospital of Tsinghua Univeristy,
Beijing, 100016, PRC
【Abstract】Objective To analyze the factors that lead to postoperative local recurrence of soft tissue sarcoma. Methods A retrospective analysis of a sequential series of 79 patients who had undergone surgical resection of soft tissue sarcomas in Royal Infirmary of Edinburgh between 1995 and 2010 was conducted. Forty-four males and 35 females with a mean age of 62.9 years ( range: 18-97 years ). Mean follow-up was 41 months ( range: 6-139 months ). Histological diagnosis was confirmed by 2 pathologist members of national sarcoma histopathology panel ( UK ). Tumour grade was assessed using the Trojani grade system. Trojani grade 1 STS was defined as low grade; grade 2 and 3 were defined as high grades. Surgical margins were defined as positive if tumour cells were found at any surgical resection margins in histological sections. Results In the series of 79 cases, 14 of 21 patients with positive margin recurred, 7 cases without recurrence; 9 of 58 cases with negative margin recurred, 49 cases without recurrence ( P<0.0001, OR=10.9 ). Twenty of 53 cases with high-grade recurred, 33 cases without recurrence; 3 of 26 cases with low-grade recurred, 23 cases without recurrence ( P=0.016, OR=4.6 ). Nineteen of 43 cases with adjuvant therapy recurred, 24 cases without recurrence; 4 of 36 cases with non-adjuvant therapy recurred, 32 cases without recurrence ( P=0.001, OR=6.3 ). Eight of 17 cases with metastasis recurred, 9 cases without recurrence; 15 of 62 cases with nonmetastasis recurred, 47 cases without recurrence ( P=0.07, OR=2.8 ). Histological grade, positive margin and use of adjuvant therapy were the only factors associated with an increased risk of local recurrence. An association with metastasis at presentation was not statistically significant. High grade tumours gave odds ratio of recurrence of 5.2 and positive margins gave odds ratio of 3.3, both were significant independent risk factors of local recurrence. Conclusions Surgical margin and histological grade are the most important factors leading to local recurrence. High-grade tumors with positive margins generally increase the risk of recurrence.
( 收稿日期:2014-07-07 )
DOI:10.3969/j.issn.2095-252X.2015.07.009
中图分类号:R738.6
