密蒙花黄色素的提取及其稳定性研究*
2015-05-12许海棠廖艳娟欧小辉李家璇周菊英
许海棠,廖艳娟,欧小辉,李家璇,周菊英
1(广西民族大学化学化工学院,广西南宁,530006)2(广西高校微生物与植物资源利用重点实验室,广西南宁,530006)3(广西民族大学海洋与生物技术学院,广西南宁,530006)4(广西壮族自治区环境监测中心站,广西南宁,530022)5(山东省潍坊市94303部队医院,山东潍坊,261051)
密蒙花为马钱科醉鱼草属植物密蒙花Buddleja officinalis Maxim.的花蕾,又称蒙花、黄饭花、小锦花、羊耳朵等,分布于福建、广东、广西、湖南、安徽、湖北、四川、贵州、云南、陕西、甘肃等地。密蒙花为临床常用中草药,其味甘,性微寒,有清肝、退翳、养肝明目之功效,用于治疗肝热目赤肿痛,羞明多泪、目生翳胀、肝虚目昏,视物昏花等症[1]。研究表明,密蒙花富含黄酮类物质,具有多种药理活性,主要表现在治疗干眼症等眼部疾病、还具有抗炎、抗菌、抗氧化和降血糖等作用[2-6]。此外,密蒙花含有丰富的黄色素,在中国西南壮族、布依族、傣族及汉族地区常用它作食品染色剂[7]。本文采用溶剂浸提法提取密蒙花黄色素并对其稳定性进行了研究。
1 材料与方法
1.1 材料与仪器
密蒙花,购于广西南宁市老百姓大药房,产地四川。
无水乙醇、葡萄糖、蔗糖、麦芽糖、苯甲酸钠、Na2SO3等,均为市售分析纯;水为超纯水。
UV-1800岛津紫外可见分光光度计,苏州岛津仪器有限公司;RE-52系列旋转蒸发仪,上海亚荣生化仪器厂;PL203电子天平,梅特勒-托利多仪器有限公司;SPS401F型电子天平,奥豪斯国际贸易有限公司;AJF-1001-U型基础性纯水器,艾科浦公司;HH-S型恒温水浴锅,巩义市予华仪器有限责任公司;PHS-3C酸度计,上海雷磁仪器厂。
1.2 实验方法
1.2.1 工艺流程
干密蒙花→粉碎→加入溶剂提取→抽滤→离心(取适量测吸光值)→减压浓缩→真空干燥→色素固体
1.2.2 测定波长的选择
取5份密蒙花各5 g,各加入不同浓度的乙醇溶液作提取剂,室温浸提4 h,抽滤得色素原液,以对应的不同浓度的乙醇溶液为空白,稀释后在400~700 nm范围内扫描吸收光谱,确定其测定波长为435 nm。
1.2.3 单因素实验研究
考察乙醇浓度、提取温度、提取时间、料液比对提取效果的影响,色素的提取效果用435 nm波长处的吸光度值来表示。
1.2.3.1 乙醇体积分数的选择
精密称取密蒙花6份各1 g,按料液比1∶30(g∶mL),分别添加不同体积分数(40%、50%、60%、70%、80%、90%)的乙醇溶液,60℃水浴浸提2 h,过滤色素原液,稀释20倍后测定其吸光度。
1.2.3.2 浸提温度的确定
精密称取密蒙花6份各1 g,按料液比1∶30(g∶mL),添加体积分数为60%的乙醇溶液,浸提温度为40、50、60、70、80、90 ℃的水浴条件下,浸提 2 h,过滤色素原液,稀释20倍后在435 nm测定其吸光度。
1.2.3.3 浸提时间的选择
精密称取密蒙花6份各1 g,按料液比1∶30(g∶mL),添加体积分数为60%的乙醇溶液,60℃水浴条件下,浸提时间为 0.5、1.0、1.5、2.0、2.5、3.0 h,过滤色素原液,稀释20倍后测定其吸光度。
1.2.3.4 料液比的选择
精密称取密蒙花7份各1 g,加入料液比(g∶mL)分别为 1∶20、1∶30、1∶40、1∶50、1∶60、1∶70、1∶80 的体积分数为60%的乙醇溶液,60℃水浴条件下,浸提2 h,过滤色素原液,稀释20倍后测定其吸光度。
1.2.4 正交实验设计
根据单因素试验结果,以不同乙醇体积分数(A)、浸提温度(B)、浸提时间(C)、料液比(g∶mL)(D)为考察因素,选取最佳条件上下梯度为考察水平,提取液的吸光度值为考察指标,选用L9(3)4正交表设计,确定密蒙花黄色素提取的最佳工艺条件。因素水平见表1。
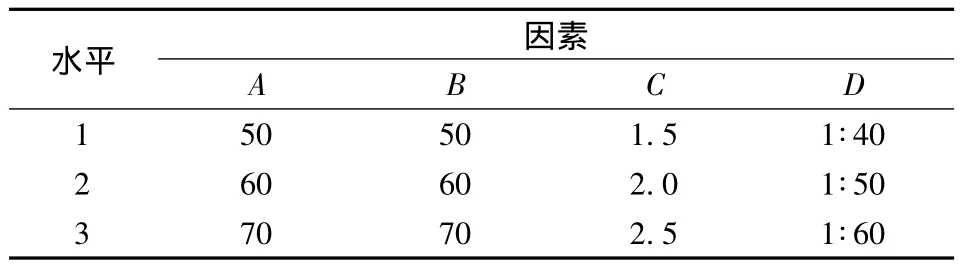
表1 正交试验因素水平表Table 1 Factors and levels of orthogonal experiment
1.2.5 不同环境条件下密蒙花黄色素的稳定性研究
按最佳提取工艺条件提取密蒙花黄色素溶液,稀释后在不同的条件下测定其吸光度值的变化,考察pH值、温度、光照、金属离子、氧化剂和还原剂、食品添加剂等对色素稳定性的影响。
1.2.5.1 pH值对色素稳定性的影响
取密蒙花黄色素提取液,稀释40倍后,用HCl和NaOH 溶液调节色素溶液的 pH 值分别为2、3、4、5、6、7、8、9、10、11、12。3 h 后在435 nm 处测定其吸光度[8]。
1.2.5.2 温度对色素稳定性的影响
取密蒙花黄色素提取液,稀释20倍后,分别置于30、40、50、60、70、80、90 ℃的恒温水浴中,2 h 后冷却至室温,在435 nm波长下测定吸光度[9]。
1.2.5.3 光照对色素稳定性的影响
取密蒙花黄色素提取液,稀释20倍后,分别于室外太阳直射(南方秋季晴天,从早上9点到下午17点)、室内自然光和避光的环境下放置,每隔1 h测定吸光度值[10]。
1.2.5.4 常见金属离子对色素稳定性的影响
取密蒙花黄色素提取液,稀释40倍后,每份取8 mL,分别加入浓度为 2 mg/mL 的 K+、Na+、Ca2+、Mg2+、Al3+、Cu2+、Fe3+、Zn2+、Pb2+溶液各 2 mL,对照组以2 mL蒸馏水代替金属离子溶液,混合均匀,避光静置2 h后,测定在435 nm波长下的吸光度[8]。
1.2.5.5 氧化剂对色素稳定性的影响
选用 H2O2作为氧化剂,配制浓度为 0.2%、0.4%、0.6%、0.8%、1.0% 的双氧水溶液。取稀释30倍的密蒙花黄色素提取液6份,每份8 mL,分别加入不同浓度的双氧水溶液各2 mL,对照组中加入蒸馏水2 mL,室温下避光放置2 h后,于435 nm下测其吸光度[8]。
1.2.5.6 还原剂对色素稳定性的影响
选用Na2SO3作为还原剂,配制成浓度分别为2、4、6、8、10 mg/mL的溶液。取稀释30倍的密蒙花黄色素提取液6份,每份8 mL,分别加入不同浓度的Na2SO3溶液各2 mL,对照组中加入蒸馏水2 mL,室温下避光放置2 h后,于435 nm下测其吸光度[8]。
1.2.5.7 食品添加剂对色素稳定性的影响
取密蒙花黄色素提取液,稀释20倍后,分别配制成含5%葡萄糖、5%蔗糖、5%麦芽糖、1%苯甲酸钠的色素溶液及不含添加剂的色素溶液,避光放置6 h,期间测吸光度值的变化[10]。
2 结果与分析
2.1 单因素实验结果
2.1.1 乙醇体积分数对提取效果的影响
由图1可知,黄色素的提取液的吸光值随乙醇体积分数的增加而先上升后下降。分析其原因是黄色素易溶于乙醇,随着乙醇体积分数的增加,提取率逐渐增加。但是高浓度的乙醇使细胞内蛋白质凝固[11],阻碍了黄色素溶出。因此,吸光值在乙醇体积分数为60%时达到最高,之后开始呈下降趋势。所以初步确定乙醇体积分数为60%。
2.1.2 浸提温度对提取效果的影响
由图2可知,随着温度的升高,溶剂的渗透力逐渐增强,有利于黄色素的溶出。当浸提温度达到60℃时,黄色素的浸提效果最好,之后随着温度的增加,吸光值呈下降趋势。原因是因为密蒙花黄色素对热不够稳定,温度升高易分解[9]。故最佳浸提温度定为60℃。
2.1.3 浸提时间对提取效果的影响
由图3可知,浸提时间0.5~2.0 h时,吸光值逐渐上升,之后随着浸提时间的增加,浸提效果变化不明显。这是因为随着时间的延长,黄色素类物质溶出已完全。因此,可以初步确定浸提时间为2 h。
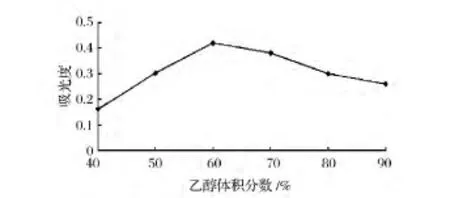
图1 乙醇体积分数对提取效果的影响Fig.1 Effect of ethanol concentration on the extraction
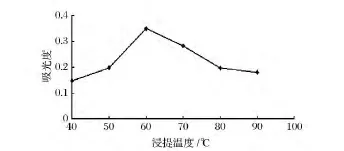
图2 浸提温度对提取效果的影响Fig.2 Effect of extraction temperature on the extraction
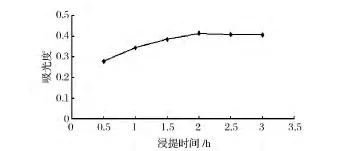
图3 浸提时间对提取效果的影响Fig.3 Effect of extraction time on the extraction
2.1.4 料液比对提取效果的影响
由图4可知,随着料液比的减小,溶剂的增加,色素的吸光度值先上升后下降。当料液比达到1∶50(g∶mL)时,色素的吸光度值最高,这表明黄色素在料液比1∶50的条件下已基本溶出。料液比太大,密蒙花粉末与提取溶剂不能充分接触,使色素不能全部溶出;料液比太小浪费溶剂,给后期浓缩带来一定困难[12]。因此,料液比以1∶50 为宜。
2.2 正交实验
2.2.1 正交实验结果
采用正交设计研究乙醇体积分数、温度、时间、液料比对密蒙花黄色素提取的影响,做3次平行,确定密蒙花黄色素提取的最佳工艺条件。正交试验结果与分析见表2。根据极差分析方法,各因素对密蒙花黄色素提取效果的影响大小顺序依次为:B>C>D>A,提取温度影响最大,乙醇体积分数影响最小。最佳提取条件为:A2B2C3D2,即乙醇体积分数为60%、提取温度为60 ℃、提取时间为2.5 h、料液比为1∶50(g∶mL)。
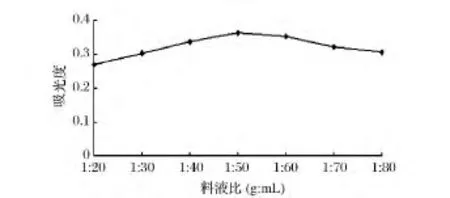
图4 料液比对提取效果的影响Fig.4 Effect of solid to liquid ratio on the extraction
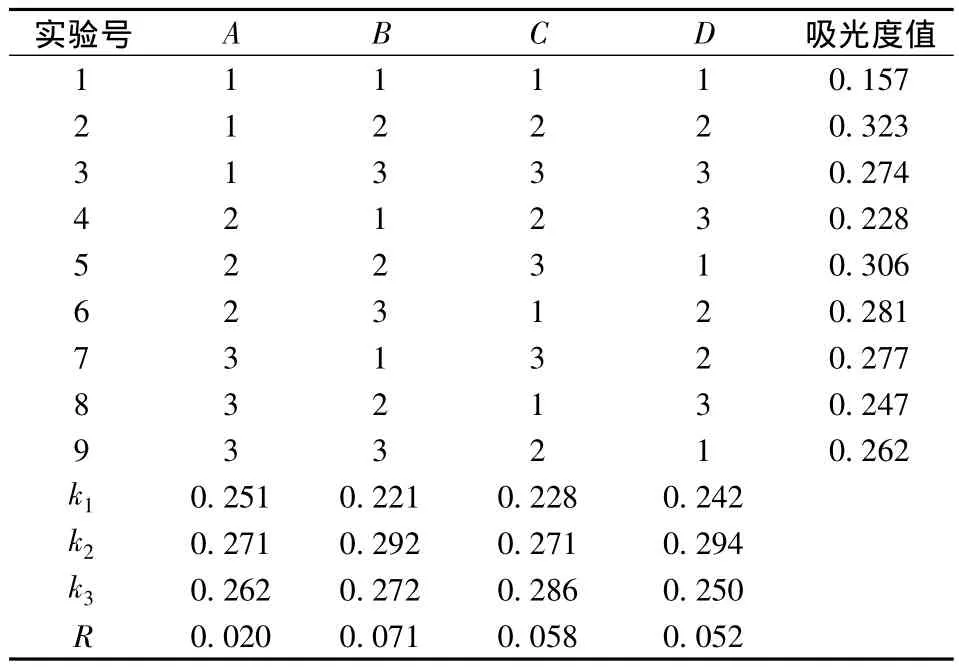
表2 正交实验表结果Table 2 The results of orthogonal experiment
2.2.2 验证实验结果
按照正交实验获得的最佳提取工艺进行验证试验,重复5次平行操作,平均吸光值为0.382。结果优于正交表中的最高吸光值,表明通过正交实验研究达到了优化目的。
2.3 稳定性实验结果
2.3.1 pH值对色素稳定性的影响
由表3可以看到,在pH 2~8内,色素溶液吸光度没有明显变化;pH 9~12内,色素溶液吸光度明显上升。由此推断,密蒙花色素在酸性及中性条件下较稳定,而在碱性条件下不稳定,其原因是碱性条件改变了色素中发色基团的结构,导致吸光值的明显变化[4]。因此在密蒙花黄色素的开发使用过程中,要注意酸碱性的影响。

表3 pH值对黄色素稳定性的影响Table 3 Effect of different pH conditions on the stability of the pigment
2.3.2 温度对色素稳定性的影响
实验结果见图5。从图5可知,黄色素在温度为30~60℃内,吸光度变化不大,70~90℃时,吸光度呈下降趋势。当温度超过60℃ 后,吸光值明显下降,这是该色素在加热过程中发生氧化反应,导致共价键断裂引起的减色结果[13]。因此在制备和储存黄色素时应尽量避免长时间处于60℃以上的高温。
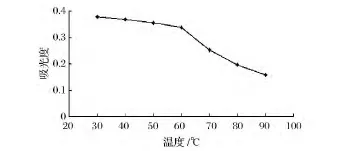
图5 不同温度对色素稳定性的影响Fig.5 Effect of different temperatures on the stability of the pigment
2.3.3 光照对色素稳定性的影响
从图6可知,密蒙花黄色素在室内自然光的条件下,吸光度值有少量减少,但下降的幅度不超过5%;在室内避光条件下,吸光度值几乎没有变化;在太阳直射下随时间的延长吸光度下降比较明显,所以密蒙花黄色素在使用和保存时应该避免阳光直射。
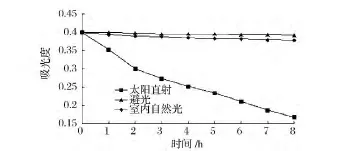
图6 光对黄色素稳定性的影响Fig.6 Effect of different time of light on the stability of the pigment
2.3.4 常见金属离子对色素稳定性的影响
由图7可以看出,金属离子对黄色素的稳定性影响不尽相同。K+、Na+、Ca2+、Mg2+、Zn2+对黄色素基本无影响,Al3+和Cu2+溶液使色素吸光度值略有增大,对黄色素有一定的增色作用。Fe3+和Pb2+溶液对色素影响较大,它们使色素吸光度值明显增大,尤其是Pb2+溶液影响最大,色素溶液变成棕黄色,伴有沉淀。说明黄色素在此条件下可能与Fe3+、Pb2+发生了化学反应。因此,在黄色素生产和应用过程中应尽量避免与Fe3+、Pb2+接触。
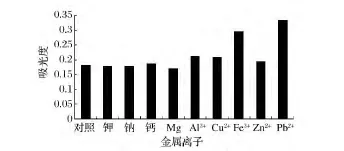
图7 各种金属离子对色素稳定性的影响Fig.7 Effects of metal ions on the stability of pigment
2.3.5 氧化剂对色素稳定性的影响
从表4可以看到,黄色素溶液吸光值随着H2O2浓度的增大而逐渐降低,但总体看吸光度值变化不大,因此黄色素在低浓度的氧化剂中稳定性较好,具有一定的抗氧化性。

表4 H2O2对色素稳定性的影响Table 4 Effect of H2O2on the stability of pigment
2.3.6 还原剂对色素稳定性的影响
从表5可以看到,随着Na2SO3的加入,黄色素溶液的吸光度值明显增大,当Na2SO3的浓度在6~10 mg/mL的范围,色素溶液的吸光度值不再增加。总的来看,黄色素的抗还原能力稍弱。

表5 Na2SO3对色素稳定性的影响Table 5 Effect of Na2SO3on the stability of pigment
2.3.7 食品添加剂对色素稳定性的影响
从表6可知,添加葡萄糖、蔗糖、麦芽糖1 h后,黄色素溶液的吸光度值有所下降,之后则又回升,随着时间的延长,有逐渐恢复的趋势。由此可知糖类对密蒙花黄色素具有一定的保护作用[14]。添加苯甲酸钠后,黄色素溶液的吸光度值逐渐上升,但升幅不大。总的来说,添加适量的以上食品添加剂基本不影响色素的稳定性。
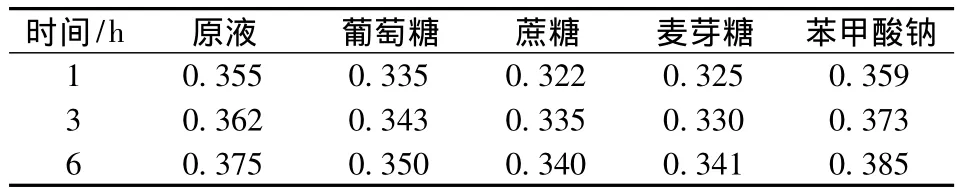
表6 食品添加剂对色素稳定性的影响Table 6 Effect of food additives on the stability of pigment
3 结论
(1)本实验采用溶剂浸提法提取密蒙花的黄色素,对提取密蒙花黄色素的各影响因素进行了研究,在单因素试验的基础上进行了正交优化。其最佳的提取工艺条件为:乙醇体积分数是60%,提取温度为60℃,提取时间为2.5 h,液料比为1∶50。
(2)提取得到的密蒙花黄色素外观呈黄色,水溶性良好。通过黄色素的稳定性实验可知,黄色素在碱性条件下不稳定,对高温比较敏感,而太阳光对色素稳定性有显著影响,所以应用时应尽量避免碱性、高温环境及太阳直射。对 K+、Na+、Ca2+、Mg2+、Zn2+、Al3+、Cu2+比较稳定,对 Fe3+和 Pb2+不稳定,所以生产、储存时避免与含Fe3+和Pb2+的金属容器接触。对氧化剂不太敏感,稳定性较好;对还原剂较敏感,稳定性较差。受葡萄糖、蔗糖、麦芽糖、苯甲酸钠的影响较小,具有良好的稳定性。
(3)密蒙花资源丰富,色素含量高,提取工艺简单,且安全无毒,可广泛应用于医药、食品、化妆品的着色中,因此密蒙花黄色素是一种值得开发和利用的天然色素资源。
[1] 国家药典委员会.中华人民共和国药典[S].一部.北京:中国医药科技出版社,2010:308-309.
[2] 彭清华,姚小磊,彭俊,等.密蒙花提取物滴眼剂对实验性干眼症鼠泪腺组织细胞凋亡 的影响[J].国际眼科杂志,2010,10(11):40-43.
[3] Lee Y J,Moon M K,Hwang S M,et al.Anti-Inflammatory effect of Buddleja officinalis on vascular inflammation in human umbilical vein endothelial cells[J].Am J Chin Med,2010,38(3):585-598.
[4] 杨胜远,李卓文,赖演莲,等.密蒙花黄色素性质研究[J].食品研究与开发,2014,35(4):19-22,32.
[5] 罗子,孔永强,张弘,等.密蒙花总黄酮清除自由基活性研究[J].林产化学与工业,2012,32(3):97-101.
[6] 李海岛,冯苏秀,叶儒,等.密蒙花正丁醇提取物对糖尿病大鼠血糖和醛糖还原酶的影响[J].中草药,2008,39(1):87-90.
[7] 师进霖.密蒙花的利用价值和栽培技术[J].中国林副特产,2004(1):22-23.
[8] 管海波,黄忠京,银小玲,等.当归藤红色素稳定性研究[J].食品研究与开发,2012,33(10):232-235.
[9] 张瑞,邢军,毛居代·亚尔买买提,等.红苋菜天然红色素的提取及其稳定性[J].食品与发酵工业,2013,39(1):208-214.
[10] 李容,蒋林斌,覃涛,等.红花羊蹄甲花色素的提取及其稳定性研究[J].食品工业科技,2013,34(20):326-329,376.
[11] 张福平,郑绵青,吴美娟.革命菜黄酮类化合物提取及其抗氧化性研究[J].食品科学,2012,33(22):48-52.
[12] 张俊杰,王淑霞,周云,等.响应面分析法优化米团花黄色素提取工艺研究[J].食品工业科技,2010,31(6):259-262.
[13] Ankit P,Nigel P,Bruntona C,et al.Effect of thermal processing on anthocyanin stability in foods,mechanisms and kinetics of degradation[J].Trends in Food Science& Technology,2010,21(1):3-11.
[14] 廖芙蓉,阚建全.籽粒苋花穗色素的稳定性研究[J].食品科学,2013,34(5):127-131.
