超高压对冷藏带鱼段的保鲜效果*
2015-05-12杨茜谢晶
杨茜,谢晶
(上海海洋大学食品学院,上海水产品加工与贮藏工程中心,上海,201306)
带鱼(coiliaspp)又称裙带鱼、牙带鱼、刀鱼等,营养价值高,富含不饱和脂肪酸、蛋白质、卵磷脂、磷、钙和维生素等多种营养成分,东海带鱼更是带鱼种类中含有营养物质较多的品种,其肉质细嫩、补血益气,深受广大消费者喜爱。带鱼属深海鱼种,上岸即死,由于含不饱和脂肪酸较多、身段较长易引起腐败变质,常用冷藏、冰藏和冻藏等方法进行保鲜贮藏,与冰藏、冻藏等贮藏方法相比,冷藏对带鱼品质影响较小,营养保持较好,但其货架期比较短,因此可以用气调包装、生物保鲜剂等方法处理带鱼再进行冷藏贮藏,以延长冷藏带鱼的货架期。
超高压技术(high hydrostatic pressure treatment)于20世纪80年代末逐渐在食品工业中流行起来,它是一种将食品真空包装后放入传压介质中,通过100~1 000 MPa静水压对食品进行加压处理的纯物理技术,具有破坏微生物的细胞壁、钝化酶活性、减少细菌总数、抑制营养物质流失和保持风味等优点[1-2]。超高压技术在海产品中的应用主要在鱼糜加工[3]、快速冻结[4]、快速解冻[5]、辅助热处理[6]、脱壳[7]、提取活性物质[8]、保鲜[9]等方面。本文研究了带鱼经不同压力和保压时间的超高压处理后在4℃贮藏过程中的品质变化,旨在探讨超高压技术对带鱼保鲜的效果。
1 材料与方法
1.1 材料与试剂
新鲜东海带鱼,2014年7月购于上海市芦潮港水产品批发市场。选择标准为:个体大小一致、鱼体体表光滑鲜亮且无破损、眼球饱满且黑白分明、鱼腮呈鲜红色。
包装材料:(15×20)cm真空高温蒸煮袋。
试剂:生理盐水、琼脂培养基、40 g/L H3BO3溶液、轻质氧化镁、0.09 mol/L HCl溶液、溴甲酚绿-甲基红混合指示剂、20%TCA(三氯乙酸)、40%TCA、TBA溶液、甲苯、无水 Na2SO4、K2CO3溶液(100 g K2CO3溶于100 mL水)、10%甲醛溶液、2%苦味酸甲苯、0.02%苦味酸、三甲胺氮标准液。所用试剂均为分析纯,并购自国药集团化学试剂有限公司。
1.2 主要实验仪器与设备
XS 225A电子分析天平,普利赛斯国际贸易(上海)有限公司;UDK159全自动凯氏定氮仪,意大利VELP科技有限公司;FA25高剪切分散乳化机(均质机),上海FLUKO弗鲁克流体机械制造有限公司;TDL-40B低速台式大容量离心机,上海安亭科学仪器厂;SJH-4S数控精密恒温水浴锅,宁波天恒仪器厂;UV-2100紫外可见分光光度计,尤尼柯(上海)仪器有限公司;MIR554三洋冷藏箱,日本三洋公司;VS-1300L-U型超净台,苏净安泰集团;DHP-9162型电热恒温培养箱,上海一恒科学仪器有限公司;HPP.L2-600/2超高压设备,华泰森淼仪器有限公司。
1.3 实验方法
1.3.1 原料处理
案板和刀具消毒(体积分数75%乙醇喷洒消毒待干)后,将新鲜东海带鱼去头去尾去内脏,并用灭菌蒸馏水洗干净,沥干后随机分成150 g带鱼段,共49份,分别装入(15×20)cm真空高温蒸煮袋中,真空封口后进行超高压处理(经预实验得出150 MPa压力虽然能抑制微生物生长,延缓TVB-N增加,但效果不显著;300 MPa以上压力对带鱼的感官品质影响较大;保压时间越长,蒸煮化越严重、肉质松弛无弹性。过高压力还会导致蛋白质变性,从而对其他指标有不利影响,因此不利于带鱼保鲜,所以试验压力设为300 MPa以下、保压时间为10 min以内)。具体实验组设计如表1所示。所有组别处理后标记并置于4 ℃贮藏。试验组分别在第 0、2、4、6、8、10、12 天分别进行采样,测定感官评定、菌落总数、持水力、挥发性盐基氮、三甲胺氮、硫代巴比妥酸。

表1 试验组设计Table 1 Design for experimentation
1.3.2 感官评定
感官评定采用《GB/T 18108-2008鲜海水鱼》方法[10],由4个评定项目组成,分别是色泽、气味、组织形态、组织弹性。每个评定项目的满分均为5分,2分及2分以下为不可接受。评定人员由固定5人组成。
1.3.3 菌落总数
按照GB 4789.2-2010食品安全国家标准《食品微生物学检验菌落总数测定》操作进行检测[11]。
1.3.4 持水力(water holding capacity,WHC)
取3 g(m1)样品(非碎肉)放在滤纸中包裹,置于离心管中,在3 000 r/min下离心10 min,沥干表面的水分称重 m2,重复3 次,取平均值[12]。

式中:m1,开始样品质量,g;m2,离心后样品质量,g。
1.3.5 挥发性盐基氮
使用自动凯氏定氮仪进行TVB-N测定。准确称取2 g鱼肉放于消化管,加入0.5 g MgO,以0.09 mol/L HCl滴定,40 g/L H3BO3为吸收液,上机测定,测定空白值为 0.019 6 mg/100 g[13]。
1.3.6 三甲胺氮
参考火腿中三甲胺氮测定方法[14],取1 g带鱼碎肉进行测定。A为吸光度,Y为TMA-N含量(μg),测定标准曲线为y=54.596x+0.575 7,R2=0.990 7。

式中:Y为测定管TMA-N的质量,μg。
1.3.7 硫代巴比妥酸
参考Salih等[15]方法,TBA含量计算。
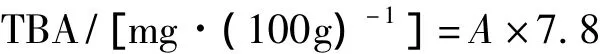
式中:A为TBA的吸光度。
1.4 数据整理及统计分析
数据用Excel整理后,通过SPSS 17.0进行方差分析并用单因素ANOVA中Duncan法进行多重比较,用Origin 8.0制图。(P<0.05,表示差异显著;P>0.05,表示差异不显著)。
2 结果与分析
2.1 感官评定
感官评定是评价海产品保鲜最直观的评判指标,决定着消费者是否愿意购买食用海产品。带鱼在贮藏期间的感官评分变化如表2所示。

表2 不同超高压处理条件对综合感官评定的变化Table 2 Changes of sensory quality during storage time under different HHP conditions
从表2中可见,在冷藏过程中,带鱼总体感官评价分数逐渐降低,CK组下降较快。贮藏2 d时,CK组与其他超高压组已出现明显差异(P<0.05),有臭味、带鱼段横切面透明稍发黄,其他处理组感官良好。贮藏6d时,CK组肉质发黏、臭味严重,感官评分为1.5,达到感官不可接受限值。刚超高压处理完时,220 MPa各组的带鱼段横切面呈半透明、肉质紧密、组织弹性稍变硬、仍保持带鱼特有鲜味;290 MPa各组的带鱼段横切面透明度稍低于220 MPa各组、组织弹性较CK组硬、风味保持较佳。随着贮藏时间延长,各超高压组逐渐失去特有鲜味,略带臭味,肉质稍疏松,组织开始变软,表面色泽变化较小。其中,HP1、HP2组在第10天感官评分小于 2,HP3、HP4、HP5、HP6 组仍在可接受范围,表明相同压力下,保压时间越长,感官评分越好,290 MPa超高压下综合感官品质保持最好。由此说明超高压处理后带鱼在冷藏过程中硬度增大,透明度降低,但能较好地维持带鱼原有形态、保持其特有鲜味、抑制臭味,延长感官可接受期限。
2.2 菌落总数(TPC)
微生物的生长繁殖会导致带鱼品质的下降,因此TPC是评定带鱼腐败变质的主要指标之一。带鱼在贮藏期间菌落总数的变化如图1所示。
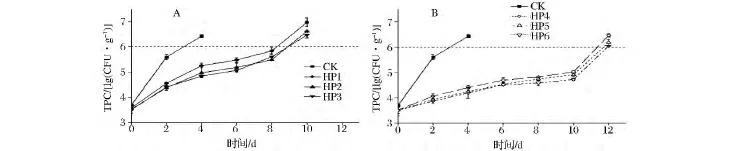
图1 带鱼段冷藏期间220 MPa(A)和290 MPa(B)超高压前处理组的菌落总数变化Fig.1 Changes of TPC during cold storage time under 220MPa(A)and 290MPa(B)HHP conditions
刚超高压完的各组带鱼的菌落总数之间无显著差异(P>0.05),说明超高压对新鲜带鱼的菌落总数影响不大。随贮藏时间的增加,CK组的细菌总数增加最快,第2天时与其他组比较出现显著差异(P<0.05),第4天时已达到6.42 lg(CFU/g),超过带鱼二级鲜度标准(6 lg(CFU/g))。220 MPa的各处理组菌落总数均相对CK组较低。贮藏8d时,HP1、HP2、HP3组细菌总数分别为 5.83、5.60、5.49 lg(CFU/g),表明同一压力、不同保压时间下,保压时间越长,细菌总数在一定程度上增加越缓慢。290 MPa的各处理组上升最慢,贮藏第10天时细菌总数仅为5 lg(CFU/g)左右,第12天时超过二级鲜度标准。290 MPa各处理组与CK组相比货架期延长8 d左右,与220 MPa组相比货架期延长3 d左右。由此可见,保压时间一定条件下,不同压力比较可见,压力越大,菌落总数上升越缓慢。
经过超高压前处理的冷藏组较常规冷藏组能更有效地抑制细菌的生长繁殖,且随着压力增加,保压时间增加,抑菌效果更显著。这是因为超高压能够破坏细菌的细胞膜,影响细菌的遗传物质,改变酶特性,从而抑制细菌总数的增加[16],超高压能有效抑制细菌总数的生长繁殖已广泛被报道[17-18]。
2.3 持水力
持水力是海产品保留自带水分和滞留外界水分的能力。持水力的降低反映了蛋白质的延展和降解情况,水分子镶嵌在蛋白质三维网状结构中,当网状结构被破坏,水分子被释放,导致持水力的降低[1]。试验持水力数值越高,说明保水性越好,带鱼在冷藏过程中持水力的变化如表3所示。

表3 不同超高压处理条件对持水力的变化Table 3 Changes of water holding capacity during storage time under different HHP conditions
贮藏初期,所有试验组无显著差异(P>0.05),随着时间的延长,试验组总体趋势有所下降。贮藏4 d开始,从数值上看,各超高压组数值均低于CK组,说明超高压处理会使持水力降低。这个结果与Lakshmanan[19]等研究超高压过程与鲑鱼持水力的关系相似,该研究表明超高压试验组的持水力低于常规冷藏组。
由表3可知,压力相同的条件下,随着保压时间的延长,持水力略微增加。但数据分析显示,同压下,不同保压时间对持水力的差异不显著(P>0.05);保压时间相同的条件下,随着压力的增加,对持水力的变化规律也不明显,可能原因是本试验所采用的220、290 MPa 均为 300 MPa 以下的中等压力,Jo[20]等研究表明,压力小于300 MPa时,超高压对蛋白质网状结构的影响不明显,所以对持水力的影响很小,当压力达到400 MPa以上时,超高压对蛋白质结构造成破坏,持水力才显著下降。
2.4 挥发性盐基氮(TVB-N)
挥发性盐基氮是指带鱼在腐败变质的过程中,由于微生物和酶的作用使蛋白质分解而产生的氨以及胺类等碱性含氮物质。SC/T3102-2010《鲜、冻带鱼》规定:带鱼TVB-N值≤13 mg N/100 g为一级品,TVB-N值≤30 mg N/100 g为合格品。带鱼在贮藏过程中TVB-N的变化如图2所示。

图2 带鱼段冷藏期间220 MPa(A)和290 MPa(B)超高压前处理组的TVB-N变化Fig.2 Changes of TVB-N during cold storage time under 220MPa(A)and 290MPa(B)HHP conditions
超高压刚处理后,CK组、220 MPa组、290 MPa组的TVB-N 值(分别约为10.71、14.5、16 mg N/100 g)之间差异显著(P<0.05)。原因是150~300 MPa的超高压会增加内源酶含量[21],而内源酶的增加促进了蛋白质分解生成氨以及胺类等碱性含氮物质,从而提高了TVB-N含量。
从图2显示,CK组在贮藏过程中上升最快,超高压组在一级品与合格品范围内缓慢增加。CK组第4天达到合格品上限值30 mg N/100 g。贮藏8 d时,HP1、HP2、HP3 组的 TVB-N 含量分别高于 HP4、HP5、HP6组(P<0.05),HP1组在第9天时达到合格品上限值30 mg N/100 g,HP2第10天时达到合格品上限值。贮藏14 d时,HP3组、HP4组、HP5组、HP6组TVB-N值均未超出30 mg N/100 g的鲜度范围,由此说明相同保压时间下,压力越大,越能有效抑制TVB-N含量,此结果与Bindu等[22]研究超高压对TVB-N的影响一致。虽然贮藏初期超高压会稍增加带鱼TVB-N值,但在贮藏过程中一定程度上延缓了TVB-N的继续增加,较CK组延长了带鱼段货架期。原因可能是随着贮藏时间的延长,微生物对TVB-N的作用逐渐大于内源酶的作用,而超高压可抑制微生物的生长繁殖,从而致使TVB-N的增加在一定程度上也被抑制。
2.5 三甲胺氮(TMA-N)
海产品死后由于微生物和还原酶的作用,氧化三甲胺(TMAO)被分解成三甲胺、二甲胺等物质后会产生不良的腐败异味。在富脂类的海产品中TMA-N超过10 mg/100 g被认为不可接受[23]。带鱼在贮藏期间TMA-N的变化如图3所示。

图3 带鱼段冷藏期间220 MPa(A)和290 MPa(B)超高压前处理组的TMA-N变化Fig.3 Changes of TMA during cold storage time under 220 MPa(A)and 290 MPa(B)HHP conditions
由图3可见,刚超高压完的新鲜带鱼TMA-N均在1.5 mg/100 g,说明超高压对新鲜带鱼的TMA-N值影响很小。第4天时,各超高压组缓慢上升,与CK组出现显著差异(P<0.05)。第5天时,CK组臭味严重。第8天开始,相同保压时间比较可见,290 MPa的TMA-N含量显著低于220 MPa(P<0.05),说明保压时间相同的条件下,压力越大,TMA-N的抑制效果越明显。压力相同的条件下,不同保压时间的超高压处理组TMA-N的上升速度从快到慢分别为:HP1>HP2>HP3,HP4>HP5>HP6,说明同压下,保压时间越长,越能有效延缓三甲胺的产生。其中HP4、HP5、HP6在整个贮藏期间缓慢上升,到贮藏末期,臭味也不大。说明290 MPa的压力下抑制三甲胺的效果最好。此结论与 Erkan等[24]研究超高压对竹荚鱼TMA-N含量变化一致。其原因是超高压处理可抑制蛋白水解活性,从而抑制TMA-N含量的上升[25]。
2.6 硫代巴比妥酸(TBA)
带鱼含有丰富的不饱和脂肪酸,更易于发生脂肪氧化,脂肪氧化会产生酸败等问题,从而影响带鱼的品质。测定TBA变化是根据带鱼不饱和脂肪酸被氧化成丙二醛后,丙二醛与TBA生成稳定的红色化合物,在532 nm下测定吸光度从而得出带鱼的脂肪氧化程度[15]。不同压力和保压时间对带鱼TBA的变化如图4所示。

图4 带鱼段冷藏期间220MPa(A)和290 MPa(B)超高压前处理组的TBA变化Fig.4 Changes of TBA during cold storage time under 220MPa(A)and 290MPa(B)HHP conditions
由图4可知,超高压刚处理后,各超高压组的TBA高于对照组。在压力不变的条件下,不同的保压时间对带鱼TBA变化的影响不明显;保压时间一定时,290 MPa的TBA含量较220 MPa略高,但各处理组之间并无显著差异(P>0.05),有研究表明[26],超高压的压力在400 MPa以下时,不会破坏血红蛋白释放金属离子,促进自动氧化反应。正如本试验采用的300 MPa以下压力时对带鱼脂肪氧化影响不大。
贮藏过程中,各处理组的TBA随时间的延长不断增加。CK组上升速度高于各超高压组,贮藏4 d时,与各超高压组出现显著差异(P<0.05)。由图4左可见,贮藏10 d时HP1组、HP2组、HP3组的TBA值分别为1.20、1.02、0.83 mg/100 g,说明贮藏过程中,相同压力下,保压时间的延长对TBA的抑制效果越好。保压时间一定的条件下,290 MPa比220 MPa的TBA含量略低。此结果与Senturk等[27]得出的数据相符,其研究超高压对大西洋鲭鱼的影响中得出,经过超高压处理的鲭鱼在贮藏期间可在一定程度上抑制鲭鱼中TBA的增长速度,且随着贮藏时间的延长,压力越高,抑制TBA作用越强。
3 结论与讨论
(1)从微生物指标来看,超高压处理能有效抑制冷藏过程中带鱼细菌总数的生长繁殖,且保压时间越长、压力越高,抑菌效果越强。冷藏对照组的带鱼货架期仅为4 d,而经220 MPa处理的带鱼冷藏过程中货架期达8 d左右,经290 MPa处理的带鱼冷藏过程中货架期直到12 d时超过二级鲜度标准。
(2)从挥发性盐基氮指标判断,贮藏初期,经过超高压处理的各组别的TVB-N含量均比对照组高,随着贮藏时间的延长,CK组的TVB-N含量逐渐超过各超高压组。随着压力增加,抑制TVB-N的效果越好,其中 220 MPa、9 min,290 MPa、3 min 超高压处理组,290 MPa、6 min 超高压处理组,290 MPa、9 min 超高压处理组,在贮藏末期均远低于合格品上限值(30 mg N/100 g)。
(3)从其他指标可见,压力越高,感官评定中的透明度越低、肉质变硬,持水力也呈下降趋势。压力增大、保压时间越长,对TMA-N抑制作用越有效,对TBA也有一定程度的抑制效果。
(4)综合以上指标,290 MPa、6 min超高压处理后冷藏组与290 MPa、9 min超高压处理后冷藏组为冷藏带鱼推荐的贮藏方法,但考虑到超高压仪器有一定的容量限制,每批进行超高压处理的数量有限,若保压时间较长,不仅耗时严重,对预超高压处理组的影响也增大,不利于进行大批量试验,因此短时即290 MPa、6 min的超高压处理后冷藏组更适合今后推广应用。
[1] Briones-Lebarca V,Perez-Won M,Zamarca M,et al.Effects of high hydrostatic pressure on microstructure,texture,colour and biochemical changes of red abalone(Haliotis rufecens)during cold storage time[J].Innovative Food Science and Emerging Technologies,2012,13:42 -50.
[2] YI J J,ZHANG L,DING G W,et al.High hydrostatic pressure and thermal treatments for ready-to-eat wine-marinated shrimp:An evaluation of microbiological and physicochemical qualities[J].Innovative Food Science and Emerging Technologies,2013,20:16 -23.
[3] Zhu Z W,Lanier T C,Farkas B E.High pressure effects on heat-induced gelation ofthreadfin bream (Nemipterus spp.)surimi[J].Journal of Food Engineering,2015,146:23-27.
[4] Alizadeh E,Chapleau N,de lamballerie M,et al.Effect of different freezing processes on themicrostructure of Atlantic salmon(Salmo salar)fillets[J].Innovative Food Science& Emerging Technologies,2007,8(4):493 -499.
[5] ZHU S M,SU G M,HE J S,et al.Water phase transition under pressure and its application in high pressure thawing of agar gel and fish[J].Journal of Food Engineering,2014,125:1 -6.
[6] Ramirez R,Saraiva J,Perez Lamela C,et al.Reaction kinetics analysis of chemical changes in pressure-assisted thermal processing[J].Food Engineering Reviews,2009,1(1):16-30.
[7] YI J J,XU Q,HU X S,et al.Shucking of bay scallop(Argopecten irradians)using high hydrostatic pressure and its effect on microbiological and physical quality of adductor muscle[J].Innovative Food Science & Emerging Technologies,2013,18:57 -64.
[8] Gómez-Guillén M,Giménez B,Montero P.Extraction of gelatin from fish skins by high pressure treatment[J].Food Hydrocolloids,2005,19(5):923 -928.
[9] GOU J,XU H,CHOI G-P,et al.Application of high pressure processing for extending the shelf-life of sliced raw squid[J].Food Science and Biotechnology,2010,19(4):923-927.
[10] GB/T18108-2008.鲜海水鱼[S].
[11] GB/T 4789.2-2010.食品微生物学检验:菌落总数测定[S].
[12] 李念文,汤元睿,谢晶,等.物流过程中大眼金枪鱼(Thunnus obesus)的品质变化[J]. 食品科学,2013,34(14):319-323.
[13] 杨胜平,谢晶.不同气调包装方式对鲜带鱼冷藏保鲜过程中品质的影响[J].食品与发酵工业,2010,36(6):211-215.
[14] 许龙福,俞飞兰,胡振友,等.火腿中三甲胺氮测定方法的修订及验证[S].预防医学论坛,2005,11(6):641-643.
[15] Salih A M,Smith D M,Prece J F,et al.Modified extraction 22 thiobarbituric acid method for measuring lipid oxidation in poultry[J].Poultry Science,1987,66(9):1 483-1 488.
[16] Ramirez-Suarez J C,M T Morrissey.Effect of high pressure processing(HPP)on shelf life of albacore tuna(Thunnus alalunga)minced muscle[J].Innovative Food Science & Emerging Technologies,2006,7(1):19 -27.
[18] HSU C P,HUANG H W,WANG C Y.Effects of highpressure processing on the quality of chopped raw octopus[J].LWT-Food Science and Technology,2014,56(2):303-308.
[19] Lakshmanana R,Parkinsonb J A,Piggott J R.High-pressure processing and water-holding capacity of fresh and cold-smoked salmon(Salmo salar)[J].LWT-Food Science and Technology,2007,40(2):544 -551.
[20] Jo Y J,Jung K H,Lee M Y,et al.Effect of high-pressure short-time processing on the physicochemical properties of abalone(Haliotis discus Hannai)during refrigerated storage[J].Innovative Food Science and Emerging Technologies,2014,23:33 -38.
[21] Fidalgo L G,Saraiva J A,Aubourg S P,et al.High pressure effects on the activities of cathepsins B and D of mackerel and horse mackerel muscle[J].Czech J Food Sci,2014,32(2):188 -193.
[22] Bindu J,Ginson J,Kamalakanth C K,et al.Physicochemical changes in high pressure treated Indian white prawn(Fenneropenaeus indicus)during chill storage[J].Innovative Food Science and Emerging Technologies,2013,17:37 -42.
[23] Özogul F,Polat A,Özogul Y.The effects of modified atmosphere packaging and vacuum packaging on chemical,sensory and microbiological changes of sardines(Sardina pilchardus).Food Chemistry,2004,85(1):49 -57.
[24] Hernández-AndrésA,Gómez-Guillén M C,Montero García P,et al.Partial characterization of protease activity in squid(Todaropsis eblanae)mantle:Modification by high-pressure treatment[J].Journal of Food Science,2006,70(4):239 -245.
[25] Erkan N,Üretener G,Alpas H,et al.Effect of high hydrostatic pressure(HHP)treatment on physicochemical properties of horse mackerel(Trachurus trachurus)[J].Food Bioprocess Technol,2011,4(7):1 322 -1 329.
[26] Teixeira B,Marques A,Mendes R,et al.Effects of highpressure processing on the quality of sea bass(Dicentrarchus Labrax)Fillets During Refrigerated Storage[J].Food Bioprocess Technol,2014,7(5):1 333 -1 343.
[27] Senturk T,Alpas H.Effect of high hydrostatic pressure treatment(HHPT)on quality and shelf life of atlantic mackerel(Scomber scombrus)[J].Food Bioprocess Technol,2013,6(9):2 306 -2 318.
