Bacillus mucilaginosus SM-01补料分批发酵产胞外多糖*
2015-05-12杨庆胜闫玉洁马洋李会史劲松
杨庆胜,闫玉洁,马洋,李会,史劲松
(江南大学药学院,江苏无锡,214122)
微生物多糖是由微生物细胞合成的一种糖类高分子聚合物,可分为胞内多糖、胞外多糖和结合多糖3种。胞外多糖具有纯度高、产量大、提取简便等优点,其应用也最为广泛,目前在食品、日化、制药和废水处理等多个行业有着广泛的应用[1]。
胶质芽孢杆菌最早由 Passik首次分离[2],其在特定的生长状态下能够合成大量荚膜多糖[3],这种多糖的生成与胶质芽孢杆菌的解磷、解钾、矿化脱硅等功能密切相关[4-6]。提取后的胞外多糖还可作为生物絮凝剂、陶瓷行业的添加剂等[7]。此外,还有研究表明,胶质芽孢杆菌胞外多糖有显著改善免疫力作用,作为高分子组织材料有着良好的开发前景[8]。
通过深层发酵培养可以大量获取胶质芽孢杆菌胞外多糖,目前在优化的工艺条件下,可以达到24 g/L的产量[9]。培养基中的碳源,不仅作为菌体生长的营养物质,而且是多糖碳架的前体物质,提供充足的、容易代谢和利用的碳源,是合成大量胞外多糖的必要条件。而一次性在培养基中添加大量碳源,会导致菌体生长受到抑制,并影响体系的传质和溶氧,使多糖产量显著下降[10]。通过补料分批发酵工艺可在一定程度上避免底物抑制,提高多糖产量和糖质转化效率[11],但需要对初始糖浓度、补料时间进行选择,使多糖的发酵产率和碳源转化效率趋于优化。
1 材料与方法
1.1 材料
1.1.1 菌种及试剂
菌株Bacillus mucilaginosus SM-01,保藏于中国菌种保藏中心(CGMCC5766);HCl、无水乙醇、葡萄糖、尿素、CaCO3、K2HPO4·3H2O、MgSO4·7H2O 及 NaCl等试剂均为国产分析纯。
1.1.2 培养基
(1)斜面培养基(g/L):蔗糖 10.0,K2HPO4·3H2O 0.2,MgSO4·7H2O 0.2,NaCl 0.2,尿素 0.1,CaCO35.0,琼脂 20,pH 7.0 ~7.2。
(2)种子培养基(g/L):蔗糖 10.0,K2HPO4·3H2O 0.2,MgSO4·7H2O 0.2,NaCl 0.2,尿素 0.1,CaCO35.0,pH 7.0 ~7.2。
(3)发酵培养基(g/L):葡萄糖60.0,K2HPO4·3H2O 0.2,MgSO4·7H2O 0.6,NaCl 0.4,尿素 0.3,CaCO35.0,pH 7.0 ~7.2。
1.2 实验仪器
722型分光光度计,尤尼可上海仪器有限公司;CR22GⅡ冷冻高速离心机,日本日立公司;SPX-250型生化培养箱,上海跃进医疗器械厂;生物传感分析仪SBA-40D,山东省科学院生物研究所;5 L发酵罐,上海保兴生物设备工程有限公司。
1.3 实验方法
1.3.1 胶质芽孢杆菌的培养
种子培养:将斜面菌种划线于平板,30℃活化培养24 h,再用接种环挑取2环已活化的菌种转接到种子培养基中,30℃、150 r/min培养24 h。
摇瓶发酵培养:将种子液4 mL接入装有100 mL发酵培养基的500 mL三角瓶中,30℃、150 r/min培养。
5 L发酵罐培养:将120 mL种子液接入5 L发酵罐,装液量3.0 L,培养温度30℃,通气量6 L/min,搅拌转速500 r/min。
1.3.2 测定方法
菌体浓度测定:取1 mL发酵液,加入等体积2%HCl,混匀,再稀释5倍,于600 nm测定吸光值(OD)。
葡萄糖浓度测定:取1 mL发酵液,稀释100倍,然后12 000 r/min离心5min,取上清液,用生物传感分析仪测定。
粗多糖浓度测定:取1 mL发酵液,稀释10倍后,12 000 r/min离心20 min,取上清液,加入3倍体积无水乙醇,混匀,4℃沉淀10 h。8 000 r/min离心10 min,弃上清液得粗多糖。将粗多糖真空干燥至恒重,以分析天平称重。
2 结果与分析
2.1 初始葡萄糖浓度对菌体生长及产糖的影响
为选择发酵培养基适宜的初始葡萄糖浓度,分别考察葡萄糖质量浓度为 10,20,30,40,50,60,70 g/L时胶质芽孢杆菌的生长和产糖情况(图1)。
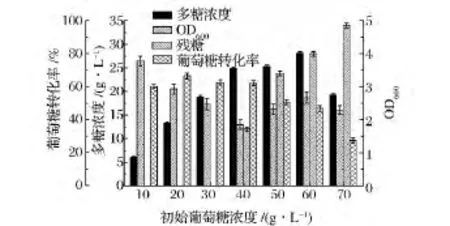
图1 不同初始葡萄糖浓度对菌体生长和多糖浓度的影响Fig.1 Effects of different initial glucose concentration on cell growth and polysaccharide concentration
结果表明,初始葡萄糖浓度为10 g/L时,菌体浓度(OD600)最高,为4.41,而初始葡萄糖浓度为60 g/L时,胞外多糖浓度最高,为28.11 g/L,可见菌体生长和胞外多糖合成所需葡萄糖最适浓度并不相同。当初糖浓度为30 g/L或更高时,菌体生长明显变差,且葡萄糖转化效率降低。综合考虑多糖浓度葡萄糖转化率及菌体生长情况,以初始葡萄糖浓度为60 g/L效果较好,此时菌体生长情况及葡萄糖转化率并非最优,但多糖浓度达到最高,故选择60 g/L作为下一步补料分批发酵的最优初始葡萄糖浓度。
从提高葡萄糖转化率角度分析,较低的或较高的初始葡萄糖浓度均不适宜,20~40 g/L是较为合适的浓度。为进一步比较不同初始葡萄糖浓度下的菌体生长速率、多糖合成速率,为补糖策略提供依据,实验详细测定了20,30,40 g/L三种浓度下的菌体浓度、多糖浓度的过程数据,通过不同批次的比生长速率、多糖比合成速率进行比较,发现在3种浓度下,尽管初始比生长速率有所差异,但在12 h后基本接近(图2)。不同初始葡萄糖浓度对多糖比合成速率影响较大(图3),当初糖浓度为30 g/L,发酵前36 h产物比合成速率较高,之后,可能由于体系中糖浓度的降低(36 h时残存葡萄糖浓度为11 g/L,60 h耗尽),使产物合成速率开始降低。因此,要使产物合成速率保持较高的水平,需要向体系进行糖质补充。
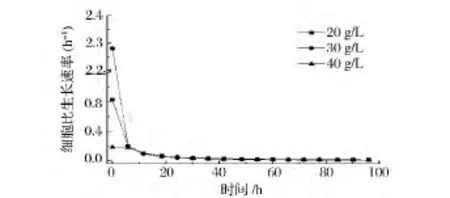
图2 初始葡萄糖浓度对菌体比生长速率的影响Fig.2 Effects of different initial glucose concentration on specific cell growth rate

图3 初始葡萄糖浓度对产物比合成速率的影响Fig.3 Effects of different initial glucose concentration on specific polysaccharide formation rate
2.2 补糖策略确定
胞外多糖合成需要大量碳源,但其浓度较高则会抑制多糖合成。微生物胞外多糖合成会受到高浓度速效碳源阻遏[12-13],通过补料来控制其浓度即可解除这种阻遏。微生物胞外多糖合成一般分两个阶段:前期菌体繁殖阶段及后期多糖积累阶段。发酵前期可控制碳源浓度处于合适的水平使菌体得以生长良好,发酵后期补充碳源可为多糖合成提供充足基质。根据前面的初步研究,基本确定30 g/L作为初始葡萄糖浓度,以36 h作为流加补糖的操作时间点。在此基础上,研究了3种补料方式对菌体生长及多糖合成的影响(表1)。一次性补料工艺:在发酵进行36 h时,一次性将30 g/L的葡萄糖补加进发酵罐;恒速流加补料工艺:在发酵进行36 h,以0.83 g/(L·h)恒定速度将30 g/L葡萄糖补加进发酵罐,至72 h补加完毕;分批补料工艺:于36、48、60及72 h分批次补加葡萄糖,每次补加葡萄糖量为7.5 g/L。

表1 不同补料方式对菌体生长及多糖合成的影响Table 1 Effects of different feeding methods on cell growth and polysaccharide yield
结果表明,采取分批补糖发酵方式能达到最好的效果,而且比恒速流加补料工艺操作简便。其发酵工艺可以概述为:在发酵初期以30 g/L葡萄糖作为初始碳源,发酵进行36 h开始补料,以后每隔12 h补1次,共补加4次,每次补加7.5 g/L葡萄糖,全部发酵过程总葡萄糖浓度为60 g/L。
2.3 5 L发酵罐中分批发酵与补料分批发酵结果比较
以2.2中确定的补糖策略,在5 L发酵罐中进行补料发酵实验,并与分批发酵结果相对比,以此验证2.2中确定的补糖策略的合理性。补料分批发酵:初始葡萄糖浓度为30 g/L,发酵进行36 h开始补料,之后每隔12 h补1次,共补加4次,每次补加7.5 g/L葡萄糖,全部发酵过程总葡萄糖浓度为60 g/L。分批发酵:初始葡萄糖浓度为60 g/L,发酵过程中不进行任何形式的葡萄糖补加。发酵罐其他条件相同,如1.3.1。
比较分批发酵和补料发酵的过程(图4),可看出分批发酵过程前期菌体生长较补料分批发酵慢,发酵72 h左右进入稳定期后,分批发酵菌体浓度明显低于补料分批发酵工艺,多糖浓度仅为28.22 g/L,葡萄糖转化率为47.0%,转化率较低。究其原因,可能是由于分批发酵过程多糖过早合成并积累,导致发酵体系中传氧、传质效果不佳,不利于菌体生长;发酵进行60 h,发酵体系中仍残存较高浓度葡萄糖,并且之后葡萄糖利用速度明显变慢,引起抑制效应,进一步限制多糖积累。在其他微生物多糖,如结冷胶的发酵过程中也有类似现象[14]。

图4 发酵罐中分批发酵与补料分批发酵过程图Fig.4 Batch and fed-batch fermentation process changes in fermentation
补料分批发酵前期菌体生长较快,60 h左右便进入稳定期,说明发酵前期降低初始葡萄糖浓度有利于菌体生长。发酵前期多糖积累较慢,迟滞期约10 h,20 h左右多糖开始积累,较分批发酵迟。36 h补加葡萄糖后,多糖继续大量积累。多糖浓度最终达到38.62 g/L,葡萄糖转化率为64.4%,相对于分批发酵提高36.8%。由此可见,补料分批发酵工艺对菌体生长、产物合成及葡萄糖转化率等均具有促进作用,且对提高多糖产量效果尤为明显。
3 结论
本研究在考察Bacillus mucilaginosus SM-01对葡萄糖利用效率和胞外多糖合成产量的基础上,通过比速率分析,确定了合适的初始葡萄糖浓度和补料时间,进而通过不同补料工艺的对比研究,确定了分批补料的发酵策略。在5 L发酵罐上,通过补料分批发酵,胶质芽孢杆菌胞外多糖浓度达到38.62 g/L,相对分批发酵提高了36.8%,葡萄糖转化率也由47.0%提高至64.4%。
国内外基于发酵罐,关于胶质芽孢杆菌胞外多糖发酵工艺的报道还较少,本文对胶质芽孢杆菌胞外多糖发酵工艺进行研究并提出一套高产的补料工艺,对促进胶质芽孢杆菌胞外多糖的大规模应用有重要意义。本文以提高胶质芽孢杆菌胞外多糖发酵产率及葡萄糖转化率为目标,立足于初始葡萄糖浓度、补料时间及补料方式对发酵过程的影响,提出了一种补料分批发酵的工艺,提高了胶质芽孢杆菌胞外多糖的发酵产率及葡萄糖转化率。该工艺简便,具有较好的工业可操作性,对降低胶质芽孢杆菌胞外多糖的工业成本、提高产品经济效益有积极意义。
[1] Canquil N,Villarroel M,Bravo S,et al.Behavior of the rheological parameters of exopolysaccharides synthesized by three lactic acid bacteria[J].Carbohydrate Polymers,2007,68(2):270 -279.
[2] 蒋先军,黄昭贤,彭盛德,等.硅酸盐细菌的研究现状及展望[J].世界农业,1998(5):28-31.
[3] 王雪,袁晓凡,赵兵,等.胶质芽孢杆菌培养条件及发酵工艺的研究进展[J].过程工程学报,2010,10(2):409-416.
[4] 周吉奎,胡岳华.硅酸盐细菌在矿物工程领域应用研究进展[J].金属矿山,2002(1):26-28.
[5] 周雪莹,李辉,连宾.胶质芽孢杆菌胞外多糖在肥料矿物分解转化中的作用[J].矿物岩石地球化学通报,2010,29(1):63 -66.
[6] 惠明,侯银臣,田青,等.硅酸盐细菌GSY-1胞外多糖的性质及其对铝土矿的脱硅效果[J].河南师范大学学报(自然科学版),2010(1):148-151.
[7] 李洁,窦文芳,李会,等.胶质芽孢杆菌胞外多糖的制备及流变学特性[J].食品与发酵工业,2013,39(1):1-5.
[8] 伍渡清,钱鹏,胡秀芳.胶质类芽孢杆菌胞外多糖对黄羽肉仔鸡生长发育的影响[J].浙江理工大学学报,2013,30(6):864 -869.
[9] 李洁.胶质芽孢杆菌高产多糖菌株的选育及其发酵条件的优化[D].无锡:江南大学,2013.
[10] 孙金旭.不同发酵方式对樟芝真菌多糖产量的影响研究[J].中国酿造,2012,31(1):105-107.
[11] 邓开野,谭梅唇.分批发酵和补料分批发酵结合生产透明质酸的研究[J].食品工业科技,2011(1):166-168.
[12] 李会,李莎,冯小海,等.Alcaligenes sp.NX-3产威兰胶的补料分批发酵工艺研究[J].食品与发酵工业,2009,35(1):1 -4.
[13] 张宁,彭志英.放射形土壤杆菌Q9415发酵生产胞外多糖的研究[J].中国食品学报,2002,2(2):4-7.
[14] Dreveton E,Monot F,Ballerini D,et al.Effect of mixing and mass transfer conditions on gellan production by Auromonas elodea [J].Journal of fermentation and bioengineering,1994,77(6):642 -649.
