华根霉细胞总蛋白及膜蛋白双向电泳优化体系的建立*
2015-05-12郭月王栋徐岩
郭月,王栋 ,徐岩
(江南大学工业生物技术教育部重点实验室,食品安全与营养协同创新中心,江南大学生物工程学院酿造微生物及应用酶学研究室,江苏无锡,214122)
丝状真菌作为重要的工业微生物,在传统发酵食品和现代发酵工业中都有广泛的应用[1-4]。但是,由于丝状真菌生理及其代谢的复杂性,目前对其相关代谢和调控机制的认识尚不充分,难以进行有效的工业生产控制[5-6]。随着系统生物学研究技术的进步,通过蛋白质组学在分子水平研究丝状真菌的内在代谢和调控机制成为可能。它能直观反映出蛋白质表达量的变化,可获得大量与真菌代谢调控及应激表达相关的蛋白信息,已在丝状真菌研究中得到了应用[7-11],为深入研究真菌的代谢调控机制提供理论根据。双向电泳技术(2-DE)因其高通量、高分辨率、快速、简单等优点成为蛋白质组学研究的核心手段。通过优化样品制备和操作条件,获得高质量、可重复的2-DE图谱,是进行蛋白质组学研究的基础。由于蛋白质样本的类型和来源、所处的状态以及实验目的和要求各不相同,目前并没有一个通用的制备方法[12]。此外,在研究真菌代谢及蛋白分泌的过程中,除了大量的胞内蛋白,真菌细胞中40%的蛋白是整合在生物膜上的,具有重要的生理功能[13],整合分析膜结合蛋白质,对于微生物代谢机理研究也至关重要。并且由于膜蛋白本身疏水性强、水溶性差、丰度低等特点,使得膜蛋白质组学的研究较为困难[14-17]。为此,许多研究者致力于膜蛋白质提取方法、增溶剂选择及凝胶电泳体系等方面的研究,使2-DE图谱上能够分离得到更丰富的膜蛋白,以用于蛋白质组学研究。
由于样品的制备效果显著影响着双向电泳的结果[18],针对不同样品可优化的可重复的操作条件也需要不断的摸索[19],建立优化的双向电泳体系是蛋白质组研究的基础。由于根霉属微生物细胞壁结构复杂,细胞裂解相对其他属菌株较困难,因此高效的裂解方法对于总蛋白及膜蛋白的提取和2-DE图谱的获得至关重要。目前针对真菌,细胞总蛋白样品制备的常用方法包括机械法和化学法裂解细胞获取蛋白,其中机械法包括液氮研磨法及高速珠磨法,化学裂解法包括在强碱或SDS存在下煮沸细胞,或者利用含有高浓度的尿素硫脲及表面活性剂配方中裂解细胞获取蛋白[20-22]。其中对于丝状真菌,采用机械法和化学裂解法相结合效果较好[22];对于膜蛋白,目前通用的样品制备方法不多,一般采用膜蛋白提取试剂盒或者利用表面活性剂等进行提取。ReadyPrepTMProtein Extraction Kit膜蛋白提取试剂盒是一种基于提取全细胞蛋白,再经过两相分层提取膜蛋白的试剂盒,已报道用于酵母、细菌、植物及动物组织膜蛋白的提取[23-25]。Hama[26]和 Teng[27]也提出了根霉膜蛋白的提取方法。
华根霉(Rhizopus chinesis)CCTCC M201021,是从我国传统酿造食品白酒大曲中分离得到的丝状真菌,在传统酿造过程中具有重要的作用。进一步研究发现该菌生产的膜结合脂肪酶具有较强的有机相酯合成活性[28],可用于脂肪酶的工业生产。但是,由于根霉微生物的复杂性,其生理及发酵代谢机制尚不清楚,难以在传统酿造及现代发酵过程中进行有效控制。因此,从分子水平入手,解析此类微生物的生理及发酵代谢机制,是一项极具意义与挑战的研究。蛋白质组学技术为此类研究提供了有效的手段[7-11]。本研究通过比较华根霉细胞总蛋白(全细胞蛋白)及膜蛋白的不同提取方法用于双向电泳研究,旨在建立优化的双向电泳条件,获得重复性好、分辨率高、无明显条纹、具有更多蛋白信息的华根霉全细胞蛋白及膜蛋白二维图谱,为华根霉及相关微生物的蛋白质组学研究奠定技术基础。
1 材料和方法
1.1 材料
1.1.1 菌种与培养基
菌种:华根霉(Rhizopuschinensis)CCTCCM201021,保存于中国典型培养物保藏中心。
孢子斜面培养基:马铃薯-葡萄糖琼脂培养基。
发酵培养基:蛋白胨40 g/L,一水合麦芽糖10 g/L,橄榄油34 g/L,K2HPO4·3H2O 2 g/L,MgSO4·7H2O 0.5 g/L,自然 pH。
1.1.2 试剂
IPG胶条(pH 3~10线性/pH 3~10非线性,24 cm)、两性电解质 Bio-Lyte(pH 3~10)、矿物油、ReadyPrepTMProtein Extraction Kit为 Bio-Rad公司产品。二硫苏糖醇(DTT)、溴酚蓝、N,N,N’,N’-四甲基乙二胺(TEMED)、硫脲、碳酸氢铵(NH4HCO3)购自Sigma公司。蛋白测定试剂盒、低熔点琼脂糖、尿素、蛋白酶抑制剂、甲叉双丙烯酰胺/丙烯酰胺溶液、过硫酸铵(APS)、十二烷基硫酸钠(SDS)、3-(3-胆固醇氨丙基)二甲氨基)-1-丙磺酸(CHAPS)、碘乙酰胺(IAA)、考马斯亮蓝G-250为上海生工产品。其他试剂均为分析纯试剂,购自国药集团试剂公司。
裂解液[29]:7 mol/L 尿素、2 mol/L 硫脲、40 g/L CHAPS、10 mg/mL DTT。
1.1.3 主要仪器
EttanTMIPGphor 3等电聚焦仪、EttanTMDALT Six垂直电泳系统、Image Scanner扫描仪,均为美国GE公司产品;立式冷冻离心机(3K15),为德国Sigma公司;Mini-BeadBeater 16,美国Biospec公司。
1.2 实验方法
1.2.1 菌种培养与制备
孢子培养:接种孢子斜面培养基,40℃下培养72 h。
孢子悬浮液的制备:用无菌生理盐水将生长于马铃薯-葡萄糖琼脂斜面的成熟华根霉孢子洗下,经两层擦镜纸过滤后制成孢子悬浮液,使用血球计数板计数,置于4℃待用。
菌体发酵培养:孢子悬浮液接种量5×107个/L,接种到20 mL培养基中,30℃,200 r/min,培养66 h。
菌体制备:收集发酵成熟的菌体,超纯水洗3次。称取湿菌体质量,将湿菌体与玻璃珠以1∶3质量比混合后液氮研磨至粉末状备用。
1.2.2 细胞总蛋白提取
采用机械法和化学裂解法相结合的方法,利用不同的提取液进行全细胞蛋白提取。
裂解液提取细胞总蛋白[29]:根据文献略有改动,将超声破碎改为了机械振荡破碎,具体操作如下:裂解液1 mL,加入10 μL蛋白酶抑制剂(Protein Cocktail for fungi)和两性电解质Bio-Lyte。混合均匀后加入液氮研磨的玻璃珠与菌体的混合物0.8 g,涡旋混匀后置于mini beads beater破碎仪破碎10 min(30 s破碎,30 s冰浴)。破碎后的固液混合物于4℃放置2 h,放置期间每0.5 h拿出涡旋2 min。12 000 r/min 4℃ 离心30 min,上清即为细胞总蛋白溶液。
ReadyPrepTMProtein Extraction Kit提取细胞总蛋白:按照说明书操作,操作终止于两相分层前。具体操作如下:称取0.5 g液氮研磨后菌体与玻璃珠的混合物,加入0.5 mL的 Buffer M1,涡旋混匀后置于mini beads beater破碎10 min(30 s破碎,30 s冰浴)。加入0.5 mL的Buffer M2,冰水浴,每隔60 s涡旋混匀60 s,重复5次,再冰水浴1 h,得到的固液混合物12 000 r/min 4℃ 离心30 min,上清液即为细胞总蛋白溶液。
1.2.3 膜蛋白提取
ReadyPrepTMProtein Extraction Kit提取膜蛋白:由于该试剂盒可进一步提取膜蛋白,将1.2.1中试剂盒提取细胞总蛋白溶液置于37℃保温30 min,每隔10 min漩涡振荡30 s;室温下,12 000 r/min离心5 min。下层即为提取的膜蛋白。
曲拉通X-100提取华根霉(Rhizopus chinensis)膜蛋白[26-27]:将发酵培养 66 h的华根霉菌体,研钵研磨并称重,丙酮与菌体以10∶1(体积质量比)的比例混合,置于磁力搅拌器上搅拌20 min洗去油脂,抽滤获得菌体干粉;以10∶1的体积质量比加入浓度为20 mmol/L的磷酸缓冲液(pH 6.2),于4℃下磁力搅拌20 min,4 ℃ 10 000 r/min离心30 min,弃上清液,重复以上操作3次;加入与上述磷酸缓冲液等体积的0.1% 的 Triton X-100,4℃下磁力搅拌器搅拌20 min,4℃ 10 000 r/min离心30 min,弃上清液,重复上述操作1次;加入上述等体积的1.5% 的Triton X-100,4℃磁力搅拌4 h,4℃ 10 000 r/min离心30 min,上清液即为膜蛋白溶液。
1.2.4 电泳样品预处理
TCA/丙酮沉淀蛋白:获得的蛋白溶液转移到50 mL离心管中,加入10倍体积的10%TCA/丙酮溶液,-20℃沉淀过夜,4℃ 12 000 r/min离心30 min,弃上清液;用等体积的丙酮悬浮洗涤沉淀,-20℃放置1 h,4℃12 000 r/min离心30 min,弃上清液,重复3次。得到沉淀的蛋白质,挥发掉丙酮后,即得到蛋白样品。
蛋白定量:将蛋白沉淀溶于上样水化液(7 mol/L尿素、2 mol/L 硫脲、40 g/L CHAPS、2 g/L 的 Bio-Lyte、65 mmol/L DTT、0.02 g/L 溴酚蓝)中,4 ℃放置3 h,每0.5 h漩涡振荡5 min(30 s冰浴,30 s振荡),4℃12 000 r/min离心30 min,使用非干扰型蛋白浓度测定试剂盒测定蛋白浓度。
1.2.5 双向电泳
操作过程按照美国GE公司的《双向电泳操作手册》进行,采用24 cm、pH 3~10的胶条(线性/非线性),上样体积 450 μL,细胞总蛋白上样量 1 080 μg,膜蛋白上样量600 μg,20℃被动水化12 h。转向等电聚焦,采用电压逐步优化方案优化等电聚焦程序,等电聚焦结束后立即进行胶条平衡,然后以恒功率进行二向SDS-PAGE,采用质量分数为12.5%丙烯酰胺凝胶,当溴酚蓝跑到凝胶底部时停止电泳,采用改良的考马斯亮蓝G-250染色法进行染色。GE公司的凝胶电泳图像分析系统Image Master Lab Scan扫描脱色后的凝胶,利用Bio-Rad公司的PDQuest 8.0.1软件分析处理图像。
2 结果与讨论
2.1 华根霉细胞总蛋白2-DE图谱的建立
本研究首先针对细胞总蛋白,利用两种细胞总蛋白提取方法,ReadyPrepTMProtein Extraction Kit与普通的裂解液提取法进行了华根霉细胞总蛋白的提取,用于2-DE分析。对两种提取方法提取细胞总蛋白的双向电泳效果作了比较,两种方法提取的细胞总蛋白2-DE图谱如图1所示。
由图1可见,采用试剂盒提取的细胞总蛋白2-DE图谱分辨率较高,较清晰,横纵条纹较少,无拖尾现象。对获得的二维图谱用PDQuest 8.0.1软件进行分析,结果如图2所示。试剂盒提取的细胞总蛋白在2-DE图谱上的蛋白点数可以覆盖裂解液提取得到蛋白点的86.1%,表明试剂盒可以提取大部分裂解液提取的细胞总蛋白点。此外,试剂盒提取的细胞总蛋白点比裂解液提取得到的蛋白点多了95个,说明试剂盒提取华根霉细胞总蛋白的效果较好,获得的2-DE图谱更加理想,可以得到更多的蛋白种类信息。
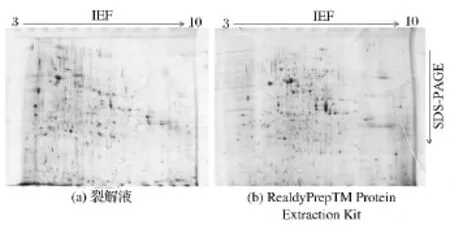
图1 不同提取方法华根霉细胞总蛋白2-DE图谱Fig.1 2-DE maps of Rhizopus chinesis total protein extracted by different extraction methods
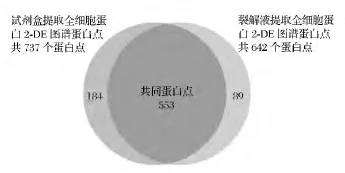
图2 两种提取方法得到的2-DE图谱蛋白点差异Fig.2 Difference of protein points on 2-DE maps by different extraction methods
预制胶条pH值范围也是影响双向电泳2-DE图谱结果的重要因素之一。宽pH值范围的IPG胶条,对于蛋白的覆盖率大,但是分辨度相对较低,而窄pH值范围的IPG胶条,虽然可以提高分辨率及灵敏度,但是会有部分蛋白丢失[30]。由图1可以发现,华根霉细胞总蛋白点主要集中在pH 4~7之间,在碱性端也有一些蛋白点。为了使蛋白点能够在较少损失的前提下,实现更有效的分离,获得分辨度高的理想2-DE图谱,本研究针对试剂盒提取的华根霉细胞总蛋白,进一步比较了pH 3~10线性与非线性IPG胶条的分离效果,其2-DE图谱如图3所示。可以看出,pH 3~10非线性IPG胶条的使用更加有利于蛋白的分离,蛋白点分布均匀,图谱分辨率高(图3(b))。
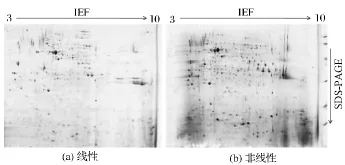
图3 细胞总蛋白2-DE图谱pH梯度优化Fig.3 Optimization of pH gradient on 2-DE maps of total protein
为验证2-DE图谱的重复性,采用上述建立的优化方法,利用试剂盒提取总蛋白,选用pH 3~10非线性IPG胶条,进行了3次生物学重复,获得的3次重复结果如图4。从结果来看,细胞总蛋白样品的3次重复实验获得的2-DE图谱蛋白分离效果均较好,分辨率较高。利用PDQuest 8.0.1软件分析,细胞总蛋白重复样品间的蛋白斑点匹配度可以达到87%,表明利用优化后的实验条件可以最终获得分辨率高、重复性好的华根霉总蛋白2-DE图谱,可用于其蛋白质组学研究。

图4 华根霉总蛋白2-DE重复性验证Fig.4 Repeatability of 2-DE maps on the total proteins extracted from Rhizopus chinesis
2.2 华根霉膜蛋白2-DE图谱的建立
为了获得更丰富的膜蛋白信息,针对华根霉膜蛋白,分别利用 ReadyPrepTMProtein Extraction Kit和Triton X-100两种方法提取膜蛋白。但是该试剂盒未能实现华根霉膜蛋白的提取,由于该试剂盒主要适用于酵母、细菌及动植物组织,对于丝状真菌华根霉可能并不适合,也可能由于本实验菌株华根霉菌体细胞内油脂含量比较高,试剂盒提取液无法在特定条件下分离膜蛋白。而采用Triton X-100提取得到了较好的膜蛋白样品,可用于双向电泳分析。
同样比较了pH 3~10线性与非线性IPG胶条对于Triton X-100提取的膜蛋白双向电泳的分离效果,结果如图5。选用pH 3~10线性的IPG胶条时,蛋白点主要集中在pH 4~7区域范围内,影响了蛋白点的分离及胶图的美观。选用pH 3~10非线性的IPG胶条,蛋白点分布更加均匀,有利于蛋白的分离,获得的图谱更加清晰,分辨率较好。用PDQuest 8.0.1软件分析,检测到蛋白点增加了43.6%。因此,对于膜蛋白也采用非线性的IPG胶条进行分离。
为验证华根霉膜蛋白2-DE图谱的重复性,利用Triton X-100提取膜蛋白,选用pH 3~10非线性IPG胶条的优化方法,同样进行了3次生物学重复,获得的3次重复结果如图6。从结果来看,膜蛋白样品的3次重复实验获得的2-DE图谱蛋白分离效果也均较好,分辨率较高。利用PDQuest 8.0.1软件分析,膜蛋白重复样品间的蛋白斑点匹配度高达94%,表明利用优化后的实验条件可以最终获得分辨率高、重复性好的华根霉膜蛋白2-DE图谱,可用于其蛋白质组学研究。
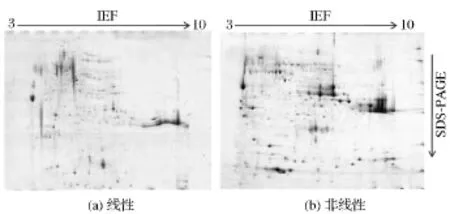
图5 膜蛋白2-DE图谱pH梯度优化Fig.5 Optimization of pH gradient on 2-DE maps of membrane protein
2.3 华根霉细胞总蛋白与膜蛋白2-DE的相关性分析
由于试剂盒的方法提取的细胞总蛋白可能含有膜蛋白,本研究将试剂盒提取的细胞总蛋白样品与膜蛋白样品的2-DE图谱进行了比较分析。利用PDQuest 8.0.1软件比较分析结果显示,细胞总蛋白2-DE图谱上共有蛋白点741个,膜蛋白2-DE图谱上共有蛋白点274个,蛋白点匹配情况如图7,说明用试剂盒提取细胞总蛋白样品可以提取分离一定量的膜蛋白,但是相较于单独提取的膜蛋白样品,仍有约45.3%的膜蛋白无法体现在细胞总蛋白2-DE图谱上。结果表明,试剂盒提取细胞总蛋白样品除了大量的胞内蛋白外,也包含部分膜蛋白;可以用于一般的差异蛋白质组学研究;而本研究膜蛋白提取方法可以获得较为丰富的华根霉膜蛋白,更适合于膜蛋白质组学研究。

图6 华根霉膜蛋白2-DE重复性验证Fig.6 Repeatability of 2-DE maps on the membrane proteins extracted from Rhizopus chinesis
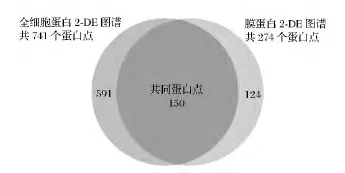
图7 细胞总蛋白与膜蛋白2-DE图谱蛋白点匹配Fig.7 Protein points matching on 2-DE maps of total proteins and membrane proteins
3 结论
本研究针对丝状真菌华根霉细胞总蛋白和膜蛋白,分别比较了不同蛋白样品的提取方法,并通过IPG胶条的pH梯度优化,获得了可用于蛋白质组学研究的较理想的2-DE图谱。分别采用ReadyPrepTMProtein Extraction Kit试剂盒提取细胞总蛋白,选用pH 3~10非线性IPG胶条;Triton X-100提取膜蛋白,选用pH 3~10非线性IPG胶条,可获得有效分离、较清晰、分辨度高的华根霉细胞总蛋白和膜蛋白2-DE图谱。3次生物学重复实验,细胞总蛋白重复样品间和膜蛋白重复样品间的蛋白斑点匹配度分别达到87%和94%,表明该方法重复性好。蛋白点匹配分析表明,利用ReadyPrepTMProtein Extraction Kit提取的细胞总蛋白用于双向电泳可以分离得到一定量的膜蛋白,总蛋白点数优于普通裂解液提取的细胞总蛋白,可以用于一次实验同时获得丰富胞内蛋白及部分膜蛋白信息的蛋白质组学研究,且经济省时。而膜蛋白提取方法可以获得较为丰富的华根霉膜蛋白,若想获得更加全面的膜蛋白信息,这种方法更为适合。本研究为基于蛋白质组学研究华根霉及相关微生物生理代谢机制奠定了技术基础。
[1] Gibbs P A,Seviour R J,Schmid F.Growth of filamentous fungi in submerged culture:Problems and possible solutions[J].Critical Reviews in Biotechnology,2000,20(1):17-48.
[2] Dufosse L,Fouillaud M,Caro Y,et al.Filamentous fungi are large-scale producers of pigments and colorants for the food industry[J].Current Opinion in Biotechnology,2014,26:56-61.
[3] Hevekerl A,Kuenz A,Vorlop K D.Filamentous fungi in microtiter plates-an easy way to optimize itaconic acid production with Aspergillus terreus[J].Applied Microbiology and Biotechnology,2014,98(16):6 983 - 6 989.
[4] Perez-Rodriguez N, Oliveira F, Perez-Bibbins B, et al.Optimization of xylanase production by Filamentous Fungi in solid-state fermentation and scale-up to horizontal tube bioreactor[J].Applied Biochemistry and Biotechnology,2014,173(3):803 -825.
[5] SHI X Z,SHA Y,Kaminskyj S.Aspergillus nidulans hypA regulates morphogenesis through the secretion pathway[J].Fungal Genetics and Biology,2004,41(1):75 -88.
[6] 邵臣斌,朱华跃,蒋茹,等.丝状真菌形态控制的分子机制研究[J].食品科技,2013(7):20-23.
[7] Bruneau J M,Magnin T,Tagat E,et al.Proteome analysis of Aspergillus fumigatus identifies glycosylphosphatidylinositol-anchored proteins associated to the cell wall biosynthesis[J].Electrophoresis,2001,22(13):2 812 - 2 823.
[8] Kim Y,Nandakumar M P,Marten M R.Proteome map of Aspergillus nidulans during osmoadaptation[J].Fungal Genetics and Biology,2007,44(9):886 - 895.
[9] Oda K,Kakizono D,Yamada O,et al.Proteomic analysis of extracellular proteins from Aspergillus oryzae grown under submerged and solid-state culture conditions[J].Applied and Environmental Microbiology,2006,72(5):3 448 -3 457.
[10] Ouyang H M,LUO Y M,ZHANG L,et al.Proteome analysis of Aspergillus fumigatus total membrane proteins identifies proteins associated with the glycoconjugates and cell wall biosynthesis using 2D LC-MS/MS[J].Molecular Biotechnology,2010,46(3):317 -319.
[11] Vodisch M,Scherlach K,Winkler R,et al.Analysis of the Aspergillus fumigatus proteome reveals metabolic changes and the activation of the pseurotin a biosynthesis gene cluster in response to hypoxia[J].Journal of Proteome Research,2011,10(5):2 508 -2 524.
[12] Knigge T,Letendre J,Monsinjon T.Sample preparation for two-dimensional gel electrophoresis:Considering the composition of biological material[J].Proteomics,2013,13(21):3 106-3 108.
[13] Roobol-Boza M,Dolby V,Doverskog M,et al.Membrane protein isolation by in situ solubilization,partitioning and affinity adsorption in aqueous two-phase systems-purification of the human type 1 11 beta-hydroxysteroid dehydrogenase[J].Journal of Chromatography A,2004,1 043(2):217-223.
[14] Bunai K,Yamane K.Effectiveness and limitation of twodimensional gel electrophoresis in bacterial membrane protein proteomics and perspectives[J].Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences,2005,815(1 -2):227 -236.
[15] Griffiths L G,Choe L,Lee K H,et al.Protein extraction and 2-DE of water and lipid-soluble proteins from bovine pericardium,a low-cellularity tissue[J].Electrophoresis,2008,29(22):4 508 -4 515.
[16] Rabilloud T.Membrane proteins and proteomics:Love is possible,but so difficult[J].Electrophoresis,2009,30(supplement 1):S174-S180.
[17] TAN S,TAN H T,Chung M C M.Membrane proteins and membrane proteomics[J].Proteomics,2008,8(19):3 924-3 932.
[18] 孔令琼,管政兵,张波,等.黄酒麦曲浸提液中宏蛋白质组的制备[J].食品与发酵工业,2012,38(3):7-11.
[19] 赵绍辉,周景文,堵国成,等.酿酒酵母蛋白质双向电泳条件优化及图谱建立[J].食品与生物技术学报,2014(3):235-240.
[20] ZHANG L,FENG D Q,FANG W X,et al.Comparative proteomic analysis of an Aspergillus fumigatus mutant deficient in glucosidase I(AfCwh41)[J].Microbiology-Sgm,2009,155:2 157 -2 167.
[21] Nandakumar M P,Marten M R.Comparison of lysis methods and preparation protocols for one-and two-dimensional electrophoresis of Aspergillus oryzae intracellular proteins[J].Electrophoresis,2002,23(14):2 216 - 2 222.
[22] 胡彬彬,林连兵,魏云林,等.一种高效的真菌总蛋白质提取方法[J].中国生物工程杂志,2013(9):53-58.
[23] Jastorff A M,Haegler K,Maccarrone G,et al.Regulation of proteins mediating neurodegeneration in experimental autoimmune encephalomyelitis and multiple sclerosis[J].Proteomics Clinical Applications,2009,3(11):1 273 - 1 287.
[24] BAO S J,GUO X Q,YU S Q,et al.Mycoplasma synoviae enolase is a plasminogen/fibronectin binding protein[J].Bmc Veterinary Research,2014,10:223.
[25] Kovach Z,Kaakoush N O,Lamb S,et al.Immunoreactive proteins of Campylobacter concisus,an emergent intestinal pathogen[J].Fems Immunology and Medical Microbiology,2011,63(3):387 -396.
[26] Hama S,Tamalampudi S,Fukumizu T,et al.Lipase localization in Rhizopus oryzae cells immobilized within biomass support particles for use as whole-cell biocatalysts in biodiesel-fuel production[J].Journal of Bioscience and Bioengineering,2006,101(4):328 -333.
[27] TENG Y,XU Y,WANG D.Production and regulation of different lipase activities from Rhizopus chinensis in submerged fermentation by lipids[J].Journal of Molecular Catalysis B-Enzymatic,2009,57(1 -4):292 -298.
[28] XU Y,WANG D,MU X Q,et al.Biosynthesis of ethyl esters of short-chain fatty acids using whole-cell lipase from Rhizopus chinesis CCTCC M201021 in non-aqueous phase[J].Journal of Molecular Catalysis B-Enzymatic,2002,18(1-3):29-37.
[29] ZHAO S H,ZHAO X R,ZOU H J,et al.Comparative proteomic analysis of Saccharomyces cerevisiae under different nitrogen sources[J].Journal of Proteomics,2014,101:102-112.
[30] 叶妙水,钟克亚,胡新文,等.双向凝胶电泳的实验操作及进展[J].生物技术通报,2006(3):5-10.
