组蛋白去乙酰化抑制剂largazole在抗hUCMSCs衰老中的作用
2015-05-11韩保卫王云帅闫红杰
韩保卫,王云帅,*,闫红杰
(1.郑州大学 附属洛阳中心医院 普外科,河南 洛阳471000;2.暨南大学 附属第二临床学院 普外科,广东 深圳518001)
间充质干细胞(mesenchymal stem cells,MSCs)是一种具有自我更新和分化能力,并且具有独特的免疫学特性的成体干细胞,已经广泛应用于临床治疗和再生医学实验中[1],然其体外培养扩增10代后会逐渐分化和衰老[2]。如何在体外扩增时保持MSCs的这些特性是目前面临的难题。研究发现MSCs 内的组蛋白乙酰化和去乙酰化在基因的调控中发挥着重要作用,在基因表达旺盛的区域乙酰化程度呈现上升趋势。组蛋白去乙酰化抑制剂(histone deacetylase inhibitor,HDACi)可以改变细胞生长的微环境,从而影响MSCs的生物学性状[3]。控制好基因特定位点组蛋白乙酰化程度,MSCs 对特性的维持将起到重要的作用[4-5]。本研究采用HDACi 小分子化合物largazole 作用于人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSCs),观察对hUCMSCs增殖和分化能力的影响。
1 材料和方法
1.1 材料
脐带来自暨南大学第二临床医学院产科,均获得产妇的知情同意和医学伦理委员会批准。主要试剂:largazole[6](获赠于香港理工大学叶涛教授研究组),单克隆抗体(BD Pharmingen 公司),hUCMSCs成骨/成脂诱导试剂盒(Cyagen 公司),F12-DMEM培养基,胎牛血清(Gibco 公司),EZ-ChIPTMChromatin Immunoprecipitation Kit、Acetyl-Histone H3 Immunoprecipitation Assay Kit(upstate 公司),CCK-8 试剂(日本同仁公司),引物(上海生工公司)。
1.2 方法
1.2.1 hUCMSCs 分离、培养和鉴定:利用酶消化法[7]对hUCMSCs 进行分离、培养。培养第3代hUCMSCs经 PE-CD34、PE-CD45、PE-CD90F、FITC-CD29、FITC-106和FITC-HLA-D,单克隆抗体行免疫荧光染色,流式细胞仪检测hUCMSCs表面标记。第3代hUCMSCs 接种到预置盖玻片的6孔板中,根据成脂/成骨诱导试剂盒进行培养,分别用茜素红及油红O 染色鉴定。
1.2.2 HDACi 对hUCMSCs增殖能力的影响:largazole溶于0.01% DMSO 溶液中(DMEM-F12,10%胎牛血清、抗生素)。取第4代hUCMSCs (2.0×104个/mL)以不同的largazole浓度接种96孔板(100 μL/孔)进行并在37℃下培养4 d。对照组分别加入含0.01% DMSO 溶液,10%胎牛血清、DMEM-F12、抗生素的培养基,实验组加入含largazole浓度为100、10 μmol/L,1 000、100、10 nmol/L 培养基;每个浓度设置3个复孔。CCK8 试剂盒检测细胞吸光度值(A)。
取第4代hUCMSCs 细胞,以5.0×103个/mL接种于96孔板,对照组加入10%胎牛血清培养基(F12,Hyclone);largazole 组加入筛选出最佳药物浓度为10 nmol/L largazole的培养基;37℃,5%CO2培养箱中培养。连续培养7 d,每天各组取3孔细胞采用CCK8 法进行检测,取均值绘制各组hUCMSCs增殖曲线。
1.2.3 HDACi 对hUCMSCs增殖、迁徙和分化基因mRNA 影响:将第3代hUCMSCs 接种10 cm的培养皿中,细胞贴壁后,根据筛选出的最佳hUCMSCs增殖的largazole浓度,加入培养基对hUCMSCs 进行培养。对照组:10%胎牛血清培养基(F12,Hyclone);largazole 组:为10 nmol/L largazole的培养基。置于37℃,5% CO2培养箱中培养,连续培养16代。
分别取第4,8,12和16代的hUCMSCs 细胞,通过酚-氯仿法将细胞中的RNA 提取出来,反转录成cDNA,按照试剂盒说明在ABI7300 机器上进行realtime PCR 实验,GAPDH 按照惯例作为同型对照。通过△△Ct 法进行数据分析,引物序列见表1。检测对hUCMSCs增殖(TERT,OCT4 和分化基因(OPN)mRNA表达影响。

表1 实时定量PCT引物序列Table1 Real-time PCR primer sequences
1.2.4 染色质免疫共沉淀(Chromatin Immunoprecipitation,CHIP)分析HDACi 对hUCMSCs组蛋白H3 乙酰化的影响:实验分对照组,largazole 组,加入largazole浓度同上,分别取hUCMSCs 培养第4,8,12和16代的细胞进行染色质免疫共沉淀分析(CHIP)。CHIP 按照EZ-ChIPTMChromatin Immunoprecipitation Kit (Millipore)说明书进行[8]。实时定量PCR 分析标本。各基因纯化后进行real-time PCR的引物序列见表2。

表2 实时定量PCT引物序列Table2 Real-time PCR primer sequences
数据按invitrogen 公司推荐的染色质免疫共沉淀分析方法进行处理(http://www.invitrogen.com/site/u./chip-analysis.html)。
1.3 统计学分析
本研究采用SPSS13.0 统计学软件进行统计分析,P<0.05 为差异有统计学意义。
2 结果
2.1 hUCMSCs的分离纯化和鉴定
分离贴壁生长的hUCMSCs 呈梭形或多角形(图1A),纯化的hUCMSCs 呈长梭形(图1B)。流式细胞术检测 hUCMSCs表面标志 CD29(99.86%)、CD90(99.94%)和CD105(99.94%)呈阳性表达,CD19 (2.69%)、CD45 (1.23%)、CD34 (1.45%)、CD106 (3.50%)和 HLA-DR(1.02%)呈阴性表达。成骨诱导2周后可见成骨结节,茜素红染色钙化结节呈红色的致密结节(图1C)。成脂诱导2周后可见诱导后的细胞变大,内含大小不等的脂肪颗粒小泡,油红O 染色脂肪滴染为红色(图1D)。

图1 分离纯化的hUCMSCs的形态Fig1 Morphological observation of hUCMSCs after purification(×100)
2.2 Largazole 对hUCMSCs增殖能力的影响
Largazole在10 nmol/L时培养5d时hUCMSCs增殖能力显著增强(图2A)。从增殖曲线图(图2B)可知,hUCMSCs 生长曲线分为潜伏期、对数增殖期和平台期。潜伏期1~2 d,对数增殖期2~5 d,然后进入平台期。Largazole 组hUCMSCs 在对数增殖期细胞增殖能力显著高于对照组 (P<0.05)。

图2 Largazole 作用于hUCMSCs 检测其增殖能力Fig2 Proliferative potential of largazole-treated hUCMSCs
2.3 HDACi 对hUCMSCs增殖、分化基因mRNA表达的影响
hUCMSCs 随着传代次数增加,hUCMSCs 形态变宽大和肥胖,hUCMSCs 自8代开始衰老,多能性基因OCT4,TERT mRNA,表达能力均从第8代开始下降,从12代到16代逐渐明显降低。成骨分化OPN mRNA 随传代次数表达明显增加,细胞成骨能力增强(图3)。在largazole 组发现hUCMSCs端粒酶基因TERT 和多能性基因OCT4表达自第4代均显著升高,8 和12代虽有下降,但仍显著高于对照组,到16代略高于对照组(图4A,B)。OPN mRNA的表达量在第8、12代,largazole 组相对于对照组抑制了OPN mRNA表达的上调(图4C)

图3 P4、P8、P12和P16 中相关基因TERT,OCT4 和OPN的表达水平Fig3 Analysis of TERT,OCT4 and OPN expression levels at culture passage P4,P8,P12,and P16 in the growth medium

图4 Largazole 处理hUCMSCs后细胞中TERT,OCT4 和OPN mRNA的相对表达量Fig4 The mRNA expression of TERT,OCT4 and OPN in hUCMSCs which had been treated with largazole
2.4 CHIP分析HDACi 对hUCMSCs组蛋白H3乙酰化水平
CHIP显示对照组hUCMSCs,TERT 和OCT4 基因启动子区域的H3K9/K14ac 乙酰化,从P4 开始呈逐渐下降趋势。OPN基因启动子区域的H3K9/K14ac乙酰化从P4 开始呈逐渐上升趋势(图5)。
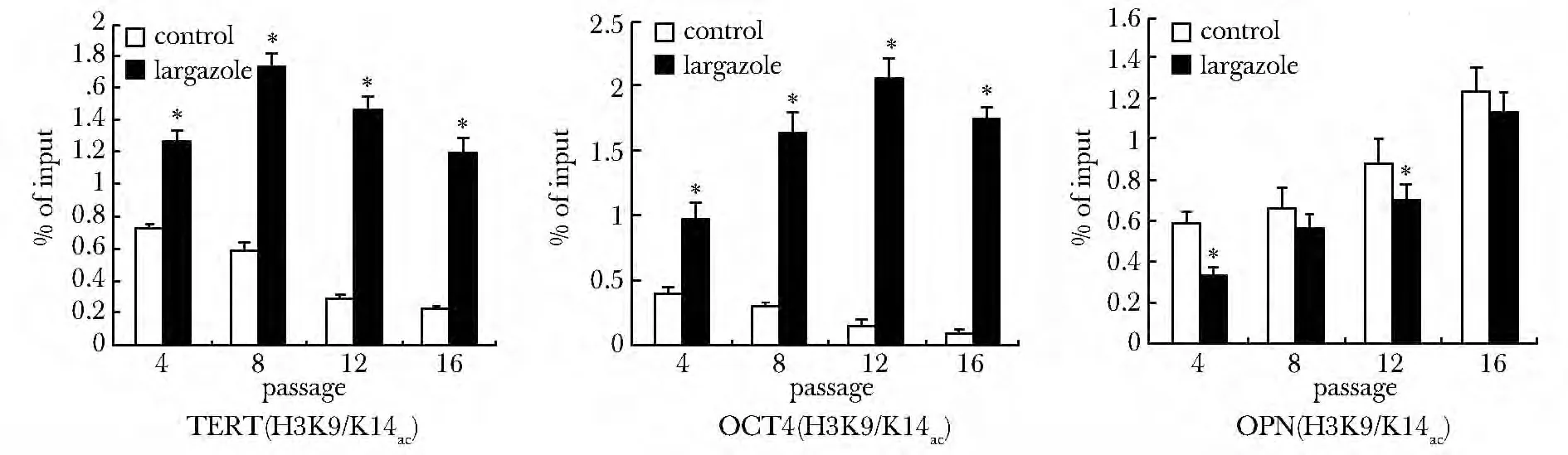
图5 CHIP分析TERT、OCT4 和OPN基因启动子区域组蛋白H3K9/K14ac的乙酰化程度Fig5 The change of TERT,OCT4 and OPN histone H3 acetylation by CHIP
Largazole 作用hUCMSCs后,TERT 和OCT4 基因启动子区域的水平明显高于对照组(P<0.01),并随着传代时间的增加修饰水平呈递增趋势,到16代逐渐延缓或呈轻度下降趋势(P<0.01)(图5A,B)。对于OPN基因启动子区域的H3K9/K14ac 修饰水平,largazole 组显著低于对照组(P<0.01),并随着传代时间的增加呈递增趋势(图5C)。
3 讨论
MSCs 在体外扩增过程中维持其干细胞生物学特性的方法探索一直是干细胞研究领域的热点问题[9]。研究发现,表观遗传中的组蛋白乙酰化相关修饰在基因的转录调控作用发挥着关键作用,如人类肝癌细胞中基因启动子区域的组蛋白H3K9ac 水平增高[10]。在胚胎干细胞(embryonic stem cells)分化的过程中,OCT4 和TERT的表达水平逐渐下降,当加入组蛋白去乙酰化酶抑制剂(Trichostatin A,TSA)后其表达水平显著升高[11]。MSC表达TERT 受到启动子区域乙酰化状态的抑制,TSA 可以克服TERT的抑制状态,增加启动子区域组蛋白的乙酰化水平[12],从而促进TERT 基因的转录表达[13]。因此,对MSCs的表观遗传中乙酰化修饰可能会维持干细胞生物学特性。组蛋白乙酰化抑制剂largazole,它是一种从蓝藻门的束藻属中分离得到小分子化合物,在高浓度下对癌细胞增殖具有明显的抑制作用,对正常细胞增殖无抑制作用[14]。本实验选择了largazole 不同浓度对hUCMSCs 进行培养,发现低剂量的largazole(10 nmol/L)对hUCMSCs 具有明显的增殖能力。利用该药物浓度对hUCMSCs 培养,绘制增殖曲线表明,largazole 作为一种新的HDACi,在低浓度下对hUCMSCs 具有一定的增殖作用。
CHIP分析这些基因启动子区域组蛋白H3 乙酰化的变化。在低剂量HDACi 培养hUCMSCs后,细胞增殖基因TERT、OCT4 启动子区域的组蛋白H3K9/K14ac 修饰水平较对照组明显增强,成骨分化基因OPN 启动子区域组蛋白H3K9/K14ac 修饰水平在P4~P12 减弱,然而P16 有增强趋势。表明低剂量HDACi 对hUCMSCs 作用,可通过修饰TERT、OCT4 基因启动子区域的组蛋白H3K9/K14ac,使hUCMSCs 细胞增殖的mRNA表达增强,成骨分化基因的表达减弱发挥作用。
综述所述,hUCMSCs 在体外扩增培养过程中,易于自主分化,最终导致其定向迁徙能力逐渐下降或衰老。HDACi 主要通过修饰OCT4 和TERT 基因启动子区域的组蛋白H3K9/K14ac,使hUCMSCs 细胞增殖、迁徙基因的mRNA表达增强,成骨分化基因OPN的表达减弱,从而维持hUCMSC 在体外扩增过程中的干细胞生物学特性,为hUCMSCs 在体外的大量扩增提供一种新的途径。
[1]Li Z,Liu C,Xie Z,et al.Epigenetic dysregulation in mes-enchymal stem cell aging and spontaneous differentiation[J].PLoS ONE,2011,6:e20526.
[2]Wagner W,Bork S,Lepperdinger G,et al.How to track cellular aging of mesenchymal stromal cells [J].Aging(Albany NY),2010,2:224-230.
[3]Wagner W,Horn P,Castoldi M,et al.Replicative senescence of mesenchymal stem cells:a continuous and organized process[J].PLoS ONE,2008,3:e2213.
[4]Sethe S,Scutt A,Stolzing A.Aging of mesenchymal stem cells[J].Ageing Res Rev,2006,5:91-116.
[5]Ruau D,Ensenat-Waser R,Dinger TC,et al.Pluripotency associated genes are reactivated by chromatin-modifying agents in neurosphere cells [J].Stem Cells,2008,26:920-926.
[6]Ren Q,Dai L,Zhang H,et al.Total synthesis of largazole[J].Synlett,2008,15:2379-2383.
[7]Seshareddy K,Troyer D,Weiss M.L,Method to isolate mesenchymal-like cells from Wharton's Jelly of umbilical cord[J].Methods Cell Biol,2008,86:101-19.
[8]Qi DL,Ohhira T,Fujisaki C,et al.Identification of PITX1 as a TERT suppressor gene located on human chromosome 5[J].Mol Cell Biol,2011,31:1624-1636.
[9]Hu Y,Cai K,Luo Z,et al.Regulation of the differentiation of mesenchymal stem cells in vitro and osteogenesis in vivo by microenvironmental modification of titanium alloy surfaces[J].Biomaterials,2012,33:3515-3528.
[10]Nishida H,Suzuki T,Kondo S,et al.Histone H3 acetylated at lysine 9 in promoter is associated with low nucleosome density in the vicinity of transcription start site in human cell[J].Chromosome Res,2006,14:203-211.
[11]Stewart R,Yang C,Anyfantis G,et al.Silencing of the expression of pluripotent driven-reporter genes stably transfected into human pluripotent cells [J].Regen Med,2008,3:505-522.
[12]MacDonald VE,Howe LJ.Histone acetylation:where to go and how to get there [J].Epigenetics,2009,4:139-143.
[13]Serakinci N,Hoare SF,Kassem M,et al.Telomerase promoter reprogramming and interaction with general transcription factors in the human mesenchymal stem cell[J].Regen Med,2006,1:125-131.
[14]Li S,Yao H,Xu J,et al.Synthetic routes and biological evaluation of largazole and its analogues as potent histone deacetylase inhibitors [J].Molecules,2011, 16:4681-4694.
