Runx3对人肝癌HepG2细胞增殖、凋亡及侵袭的影响
2015-05-11刘俊斌吴卫红靳君华
刘俊斌,吴卫红,靳君华
(内蒙古医科大学 附属医院 肝胆外科,内蒙古 呼和浩特010050)
肝细胞癌(hepatocellular carcinoma,HCC)简称肝癌,近年来,抑癌基因的失活在肝癌发生、发展中的作用愈来愈受到重视。Runt 相关转录因子3(runt related transcription factor 3,Runx3)是Runt 结构域转录因子家族成员,是一种新的抑癌基因,广泛表达于消化道上皮细胞、血液细胞及神经细胞等[1]。Runx3基因与人类多种肿瘤的发生、发展有着极其密切的系,在人类多种肿瘤的发病过程中起着重要的作用[2],因而受到国内外学者的广泛关注。Runx3基因与肿瘤的相关性研究主要集中于胃癌,研究表明Runx3基因作为一种新近发现的抑癌基因,其表达下调参与了胃癌的发生和发展[3]。前期有研究表明肿瘤抑制因子Runx3 可以抑制胃黏膜上皮细胞的增殖,促进细胞的凋亡[4]。Runx3基因与肝癌的相关研究主要从甲基化、杂合缺失进行[5-6],而Runx3 在肝细胞癌中的作用及其机制如何,目前国内外研究报道尚少。因此,本研究探讨Runx3基因在肝癌发生发展中的作用及意义,为肝癌发病机制的研究和肿瘤的基因治疗提供理论依据和治疗靶点。
1 材料与方法
1.1 材料
新生牛血清(fetal bovine serum,FBS)(华美生物工程有限公司);Trizol 试剂(Gibco);转染试剂LipofetamineTM2000(Invitrogen 公司);MTT(Sigma公司),AV/PI 双染凋亡检测试剂盒(BD 公司);Transwell 膜(Millipore 公司)。Runx3 和内参基因β-actin的引物序列(上海生工公司)。
1.2 方法
1.2.1 细胞培养:人肝癌细胞系HepG2(中科院上海细胞所),由本实验室保存。肝癌HepG2细胞以单层细胞贴壁的增殖方式培养于含10% FBS的DMEM 培养液中,置于37℃、5% CO2恒温细胞培养箱,每1~2 天换液1次。
1.2.2 Runx3基因siRNA 序列的设计及转染:siRNA 片段由上海生工合成。靶向Runx3的siRNA 序列为:5'-GATCCGTCGGAACTGAACCCATTCTTTCAA GAGAAGAATGGGTTCAGTTCCGAGGTTTTTTGGAAA-3'(正向)和5'-AGCTTTTCCAAAAAACCTCGGAAC TGAACCCATTCTTCTCTTGAAAGAATGGGTTCAGTT CCGACG-3'(反向)。制备终浓度为80 nmol/L的siRNA-脂质体复合物,实验组加入Runx3-siRNA 混合物,同时设置对照组(control)。将人肝癌HepG2细胞以每孔2×105个接种于6孔板,待细胞增殖至70%~80%时,更换无血清培养基,采用LipofetamineTM2000 将Runx3-siRNA转染细胞。
1.2.3 RNA 提取与qRT-PCR:采用Trizol 试剂提取HepG2细胞总RNA,按照试剂盒要求操作。Runx3 上游引物序列:5'-AGGCATTGCGCAGCTCAG CGGAGTA-3',下游引物序列:5'-TCTGCTCCGTGCT GCCCTCGCACTG-3',检测按实验室常规方法进行PCR扩增。以β-actin 为内参,依据2-ΔΔCT法计算各组细胞mRNA的相对表达量。
1.2.4 Western blot:提取细胞总蛋白,常规方法进行蛋白免疫分析。每个样品取40 μg 蛋白进行常规SDS-PAGE 电泳,蛋白浓度采用BCA 试剂盒测定。经电泳后转移至PVDF膜,10%脱脂奶粉4℃封闭PVDF膜过夜,加10%脱脂奶粉稀释好的一抗加于膜上,室温反应60 min;用TBST 缓冲液洗膜10 min×3次;加二抗37℃孵育45 min,TBST 缓冲液洗膜10 min×3次,滴加ECL 试剂,将PVDF膜放入X 片暗盒,在暗室中压片,显影。以β-actin 作为内参。
1.2.5 MTT法检测细胞增殖:转染后6 h,将细胞按组转接种到无菌的96孔板,置于37℃、5% CO2培养箱中培养,48 h 换液1次。实验分为空白对照组,脂质体组,NC-siRNA组和Runx3-siRNA组。待转染后24、48、72和96 h 分别进行MTT 检测。取出培养板,0.25%胰蛋白酶消化各组细胞,吸去胰蛋白酶,加入正常培养液继续培养60 min。每孔加入MTT 溶液(5 μg/L)20 μL,继续孵育4 h,弃上清,每孔加入150 μL DMSO,振荡10 min后进行比色测定,酶联免疫检测仪在490 nm 波长下读取A490值。每组实验重复3次。
1.2.6 Annexin V/PI 检测细胞凋亡:实验分组同上,转染后48 h,收集各组细胞并行细胞凋亡检测,具体操作方法参照试剂盒说明书进行。
1.2.7 Transwell 检测细胞的侵袭能力:实验分组同上,将培养的人肝癌HepG2细胞消化成单细胞悬液,无血清培养基洗3次,将细胞悬液调整成2×105个/mL备用。预先将Matrigel(提前12 h)用无血清培养基DMEM 稀释成1∶3浓度,均匀地铺满Transwell 小室上室的聚碳酸酯膜,室温放置1 h,使Matrigel 凝固形成基质膜。Transwell 下腔室加入700 μL含10% 胎牛血清的DMEM 培养基,小室内接种200 μL无血清细胞悬液,培养18 h后取出Transwell膜,预冷的PBS 洗涤2次,4%多聚甲醛固定15 min,0.1%结晶紫染色5~10 min,显微镜下拍照,统计穿过Transwell 膜的细胞数。实验重复3次。
1.3 统计学分析
采用SPSS13.0 统计软件进行t 检验及单因素方差分析,数据以平均数±标准差(±s)表示。
2 结果
2.1 Runx3转染效果鉴定
转染效果(图1A)对照组、脂质体组和NC-siRNA组中Runx3的mRNA表达水平无明显差异,相比而言,Runx3-siRNA组mRNA表达水平明显下降(P<0.05)。对照组、脂质体组和NC-siRNA组中Runx3 蛋白条带吸光度基本一致(图1B),与其相比,Runx3-siRNA组条带吸光度明显减弱(P<0.05)(图1C)。
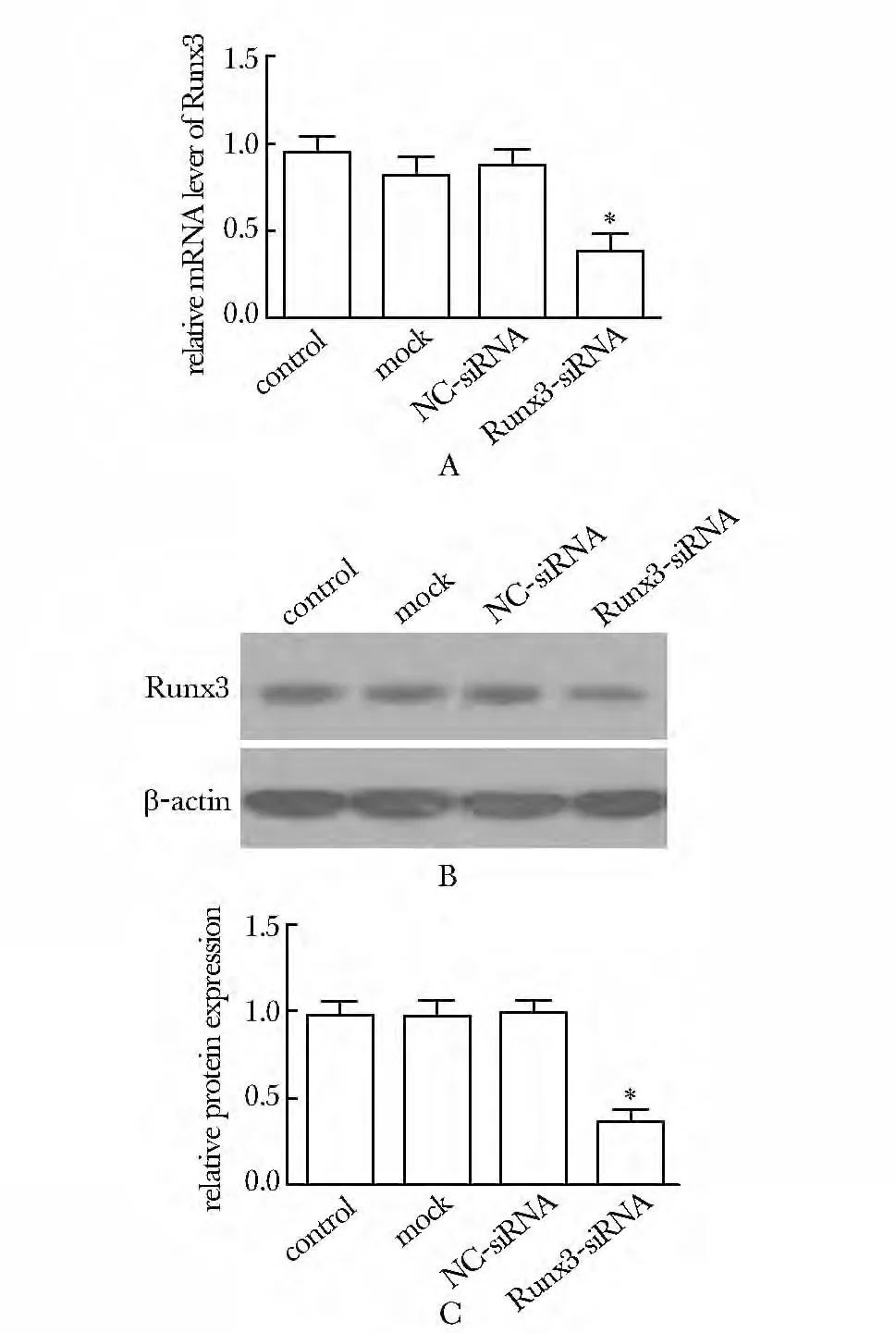
图1 Runx3转染效果Fig1 The transfection effect of Runx3
2.2 Runx3对HepG2细胞增殖的影响
对照组、脂质体组和NC-siRNA组在转染后各个时间点上的A490nm值无显著性变化。而与各组相比,Runx3-siRNA转染后HepG2细胞增殖活力下降,转染后第3天细胞增殖活力降低较为明显(P<0.05)(图2)。

图2 Runx3对HepG2细胞增殖的影响Fig2 Effect of Runx3 on HepG2 cells proliferation
2.3 Runx3对HepG2细胞凋亡的影响
转染48 h后,对照组、脂质体组和NC-siRNA组细胞凋亡率分别是(12.1%)、(12.0%)和(12.3%),无差异,而Runx3-siRNA组可以显著促进HepG2细胞的凋亡(29.9%)(图3)。
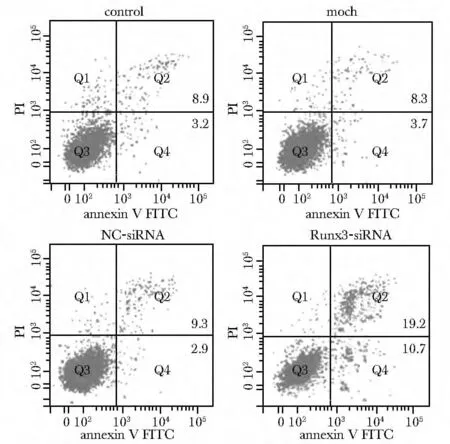
图3 Runx3对HepG2细胞凋亡的影响Fig3 Effect of Runx3 on HepG2 cell apoptosis
2.4 Runx3对HepG2细胞侵袭能力的影响
与对照组、脂质体组和NC-siRNA组相比,Runx3-siRNA转染后细胞的侵出小室数目明显降低(P<0.05)(图4)。

图4 Runx3对HepG2细胞侵袭的影响Fig4 Effect of Runx3 on HepG2 cells invasion
3 讨论
许多研究表明,Runx3基因在胃癌、结肠癌、胆道肿瘤、肺癌等人类多种肿瘤中存在启动子区域甲基化异常[7-9],在肝癌中也有报道[10-11],这是抑癌基因Runx3 失活的主要机制。肝癌的发生发展是多基因、多途径、多阶段共同作用的结果,与多种癌基因和抑癌基因变化有关。Runx3基因是哺乳动物中Runx 家族的进化基础,是近年来发现的一种新型抑癌基因[12],可能在肝癌、胃癌等多种肿瘤的发生发展过程中发挥重要作用。Runx3 蛋白在TGF-介导的细胞周期调控、细胞分化与凋亡过程中发挥重要作用[13]。肝细胞癌存在Runx3的高甲基化[14],提示Runx3基因在肝细胞癌中可能是一个关键性的肿瘤抑制基因。据报道,原发性肝癌存在着严重的TGF-β 信号传导障碍,这说明Runx3基因可能在HCC的发生发展过程中是关键性的肿瘤抑制基因,其功能失活可导致TGF-β/SMADS 信号通路削弱[15]。但是,关于Runx3 在肝癌HepG2细胞发生发展过程中的作用尚未见报道。本研究通过siRNA下调肝癌HepG2细胞中Runx3基因的表达,发现HepG2细胞增殖活力和侵袭能力均明显下降,凋亡增加,表明Runx3 与抑制肝癌细胞增殖、侵袭和促进调亡有一定关系,提示Runx3 在肝癌的发生和发展中可能发挥着重要作用,为肝癌的发病机制的进一步探索和基因靶向治疗的研究提供理论依据。
[1]卢燕辉,李建国.RUNX3 基因及其与肝癌的相关性研究[J].中国肿瘤外科杂志,2011,6:357-361.
[2]Bangsow C,Rubins N,Glusman G,et al.The<i >RUNX3</i > gene-sequence,structure and regulated expression[J].Gene,2001,279:221-232.
[3]Li Y,Ji X,Su Z,et al.Downregulation of Runx3 is closely related to the decreased Th1-associated factors in patients with gastric carcinoma[J].Tumor Biol,2014,1-10.
[4]Liu Z,Zhang X,Xu X,et al.RUNX3 inhibits survivin expression and induces cell apoptosis in gastric cancer[J].Eur J Cell Biol,2014,93:118-126.
[5]Xiao WH,Liu WW.Hemizygous deletion and hypermethylation of RUNX3 gene in hepatocellular carcinoma [J].World J Gastroentero,2004,10:376-380.
[6]Shiraha H,Nishina Si,Yamamoto K.Loss of runt‐related transcription factor 3 causes development and progression of hepatocellular carcinoma [J].J Cell Biochem,2011,112:745-749.
[7]Sato K,Tomizawa Y,Iijima H,et al.Epigenetic inactivation of the RUNX3 gene in lung cancer[J].Oncol Rep,2006,15:129-135.
[8]Saito M,Nishikawa J,Okada T,et al.Role of DNA methylation in the development of Epstein-Barr virus ‐ associated gastric carcinoma[J].J Med Virol,2013,85:121-127.
[9]Kang KA,Zhang R,Kim GY,et al.Epigenetic changes induced by oxidative stress in colorectal cancer cells:methylation of tumor suppressor RUNX3 [J].Tumor Biol,2012,33:403-412.
[10]Nishida N,Nagasaka T,Nishimura T,et al.Aberrant methylation of multiple tumor suppressor genes in aging liver,chronic hepatitis,and hepatocellular carcinoma[J].Hepatology,2008,47:908-918.
[11]Nomoto S,Kinoshita T,Kato K,et al.Hypermethylation of multiple genes as clonal markers in multicentric hepatocellular carcinoma [J].Brit J Cancer,2007,97:1260-1265.
[12]Bae SC,Takahashi Ei,Zhang YW,et al.Cloning,mapping and expression of<i > PEBP2αC</i >,a third gene encoding the mammalian Runt domain[J].Gene,1995,159:245-248.
[13]Ito Y.Oncogenic potential of the RUNX gene family:‘overview’[J].Oncogene,2004,23:4198-4208.
[14]肖文华,刘为纹.肝细胞癌RUNX3 基因甲基化与杂合缺失的分析及其意义[J].中华肝脏病杂志,2004,12:227-230.
[15]Song BC,Chung YH,Kim JA,et al.Transforming growth factor‐β1 as a useful serologic marker of small hepatocellular carcinoma[J].Cancer,2002,94:175-180.
