GSK-3β过表达促进人胶质瘤细胞增殖及侵袭
2015-05-11石歆
石 歆
(河南中医学院 第一附属医院 内科,河南 郑州450000)
胶质瘤是常见中枢神经细胞原发性肿瘤,具有较高的发病率和致死率。糖原合酶激酶-3(Glycogen Synthase Kinase-3β,GSK-3β)有GSK-3α 和GSK-3β 两种亚型,其功能失调与糖尿病、心血管疾病、神经退行性疾病等多种疾病的病理进程息息相关[1-3]。GSK-3β是GSK-3 研究较多的亚型,越来越多的研究表明,GSK-3β 与多种肿瘤的发生发展有关[4-5]。如GSK-3β 在乳腺癌中异常活化,抑制其表达后乳腺癌细胞的增殖力明显下降,同时细胞凋亡率增加[4]。但是,GSK-3β 在胶质瘤发展中的作用尚不清楚。因此,本研究体外分析GSK-3β 在胶质瘤细胞中的表达水平,同时探讨GSK-3β对胶质瘤细胞增殖及侵袭的影响及作用机制,从而为进一步明确GSK-3β 在胶质瘤发生发展中的作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞系:正常人星形胶质细胞1800(Sciencell 公司);人恶性胶质瘤细胞A172、T98G、U87 和U251(ATCC 公司)。
1.1.2 试剂:新生牛血清(华美生物工程有限公司);RPMI 1640 培养基(Hyclone 公司);DMEM 培养基、Trizol 和cDNA 合成试剂盒(Invitrogen 公司);噻唑蓝(MTT)(北京索莱宝科技有限公司);Lipofectamine 2000(Sigma 公司);抗人GSK-3β、PAX3 及Ki67的抗体(Cell Signaling Technology);实时荧光定量PCR 试剂盒(TaKaRa 公司)。
1.2 方法
1.2.1 细胞的培养:将正常人星形胶质细胞1800和T98 胶质瘤细胞置于RPMI 1640 培养液中,3~4 d换一次液。人胶质瘤细胞A172、U87 和U251 细胞培养于DMEM 培养基中,所有细胞均置于37℃、5% CO2培养箱中培养。
1.2.2 GSK-3β 重组表达载体的构建:根据已知人GSK-3β 序列设计相应表达引物,具体为:上游,5'-G CGAATTCCGAAGAGAGTGATCATGTCAG-3',含EcoRⅠ酶切位点(斜体);下游,5'-CGCTCGAGGGCTGCTC GGGACTGTTCAGG-3',含XhoⅠ酶切位点(斜体)。以本实验室前期合成的人一链cDNA 为模板进行PCR扩增,将扩增产物酶切后连接到酶切好的pcDNA3.1(+)载体上,构建重组表达载体pcDNA3.1(+)-GSK-3β(rGSK-3β)。将构建的GSK-3β 重组载体经LipofectamineTM2000 转染人U87 胶质瘤细胞,设置载体对照组(vector)和未处理组。
1.2.3 PAX3 siRNA转染:将U87 细胞接种于12 孔培养板中,待细胞增殖达到70%~80%汇合时,用无血清DMEM 稀释细胞。将制备的100 nmol/L siRNA-脂质体复合物采用LipofetamineTM2000 转染细胞,48 h后收集细胞,进行转染效果评估。本实验设置空白对照组、scramble siRNA(NC)组和PAX3 siRNA转染组。PAX3 siRNA 序列为:上游,5'-CGC AUCCUGAGAAGUAAAUdTdT-3';下游,5'-AUUUAC UUCUCAGGAUGCGdTdT-3';scramble siRNA 序列为:上游,5'-UUCUCCGAACGUGUCACGUTT-3';下游,5'-ACGUGACACGUUCGGAGAATT-3'。所 用 序列均由上海生工合成。
1.2.4 RNA的提取和cDNA 合成:Trizol 提取上述处理细胞的总RAN,一链cDNA 合成按照RevertAidTMFirst Strand cDNA Synthesis Kit 操作说明书进行。
1.2.5 实时定量RT-PCR:GSK-3β 引物序列为(上游5'-AGTGGTGAGAAGAAAGATGAG-3';下游,3'-TGACATAAATCACAGGGAG-5');PAX3的引物序列为(上游,5'-CCGACTTGGAGAGGAAGGA-3';下游,5'-CATCTGATTGGGGTGCTGA-3')。具体按操作SYBR 荧光定量PCR 试剂盒进行操作。
1.2.6 Western blot 分析:采用细胞裂解液裂解不同处理组细胞,BCA 试剂盒分析蛋白浓度。加入约25 μg 蛋白样品进行SDS-PAGE 电泳,半干转法将目标蛋白转移至NC 膜上。加入5%脱脂奶粉,4℃过夜;TBST 洗涤后分别加入抗人GSK-3β、PAX3 一抗和HRP 标记的二抗。用ECL 显影,β-actin 为内参。
1.2.7 MTT 测细胞增殖:按2×104个/孔将细胞接种于96孔板中,各组处理方法如前。待培养板重复吸收上清后,每孔加入20 μL MTT(5 g/L),4 h后加入150 μL DMSO。低速振荡10 min 使结晶物充分溶解,将样品置于酶标仪上测定490 nm 处A值。
1.2.8 Transwell 分析细胞的侵袭能力:将Transwell小室用预热的无血清培养基处理15~30 min;取200 μL 不同处理组无血清细胞悬液接种于上腔室,下室加入700 μL 含10%胎牛血清的DMEM,室温下培养24 h。取Transwell 膜,洗涤2次后用4%多聚甲醛固定25 min,HE染色后显微镜下随机选取9个视野进行观察,统计穿膜细胞数。
1.3 统计学分析
2 结果
2.1 GSK-3β 在胶质瘤细胞中高表达
与正常人星形胶质细胞1800 相比,4种人胶质瘤细胞中GSK-3βmRNA 水平明显增高,且GSK-3β在U87 中的mRNA 水平约是1800 细胞的3.64倍(P<0.05)(图1A)。此外,与1800 细胞相比,上述4种人胶质瘤细胞中GSK-3β的表达水平明显增加(图1B)。
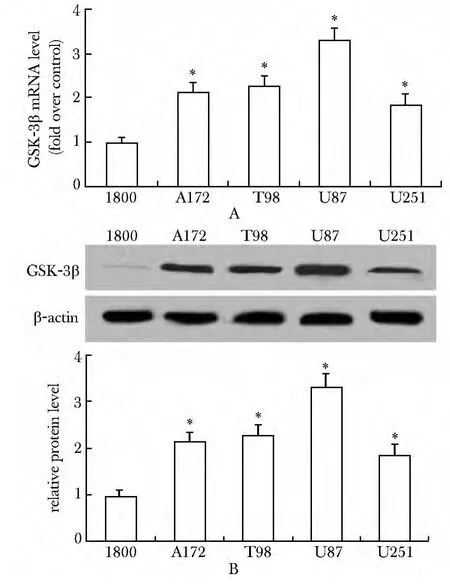
图1 GSK-3β 在胶质瘤细胞中的表达水平Fig1 The expression levels of GSK-3β in glioma cells
2.2 rGSK-3β转染效果
rGSK-3β转染后胶质瘤细胞中rGSK-3β的蛋白水平明显高于对照组(图2A),约是对照组的3.45倍(P<0.05)(图2B)。

图2 rGSK-3β转染效果评估Fig2 Effect of rGSK-3β transfection
2.3 GSK-3β对胶质瘤细胞增殖的影响
与对照组和空载体处理组相比,GSK-3β过表达后细胞的存活率明显增加(图3A)(P<0.05),同时细胞增殖标记分子Ki67 蛋白明显增加(图3B)(P<0.05)。
2.4 GSK-3β对胶质瘤细胞侵袭的影响
GSK-3β过表达后侵出小室的细胞数目明显高于对照组和载体处理组(P<0.05)(图4)。
2.5 GSK-3β对胶质瘤细胞中PAX3表达水平的影响
GSK-3β过表达后U87 细胞中PAX3的mRNA水平明显增高,约是对照组的3.2倍(P<0.05)(图5A);同时伴随有PAX3 蛋白水平的上调(图5B)(P<0.05)。
2.6 PAX3 在GSK-3β 介导的细胞增殖及侵袭中的作用
与control 和NC组相比,PAX3 siRNA转染明显U87 细胞中PAX3的蛋白水平(图6A 和6B)(P<0.05)。同时GSK-3β过表达诱导的细胞存活率(图6C)和侵袭细胞的数目明显降低明显下降(图6D)(P<0.05)。
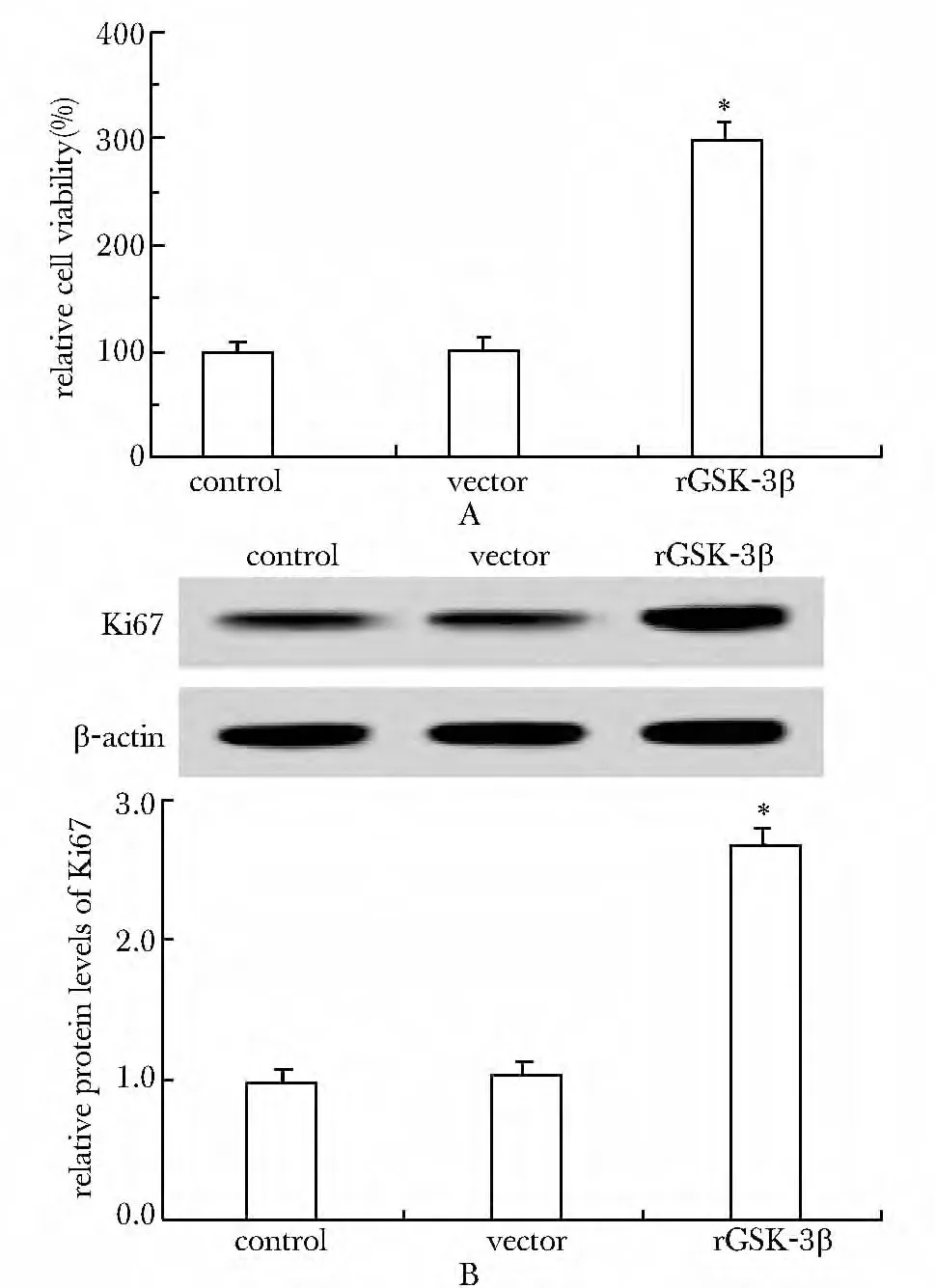
图3 GSK-3β对U87 细胞增殖的影响Fig3 Effect of GSK-3β on cell proliferation
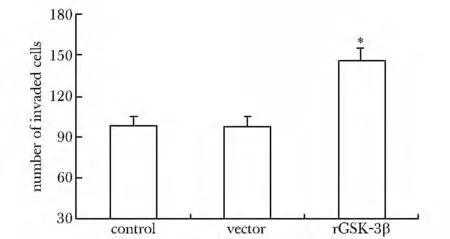
图4 GSK-3β对U87 细胞侵袭能力的影响Fig4 Effect of GSK-3β on cell invasion
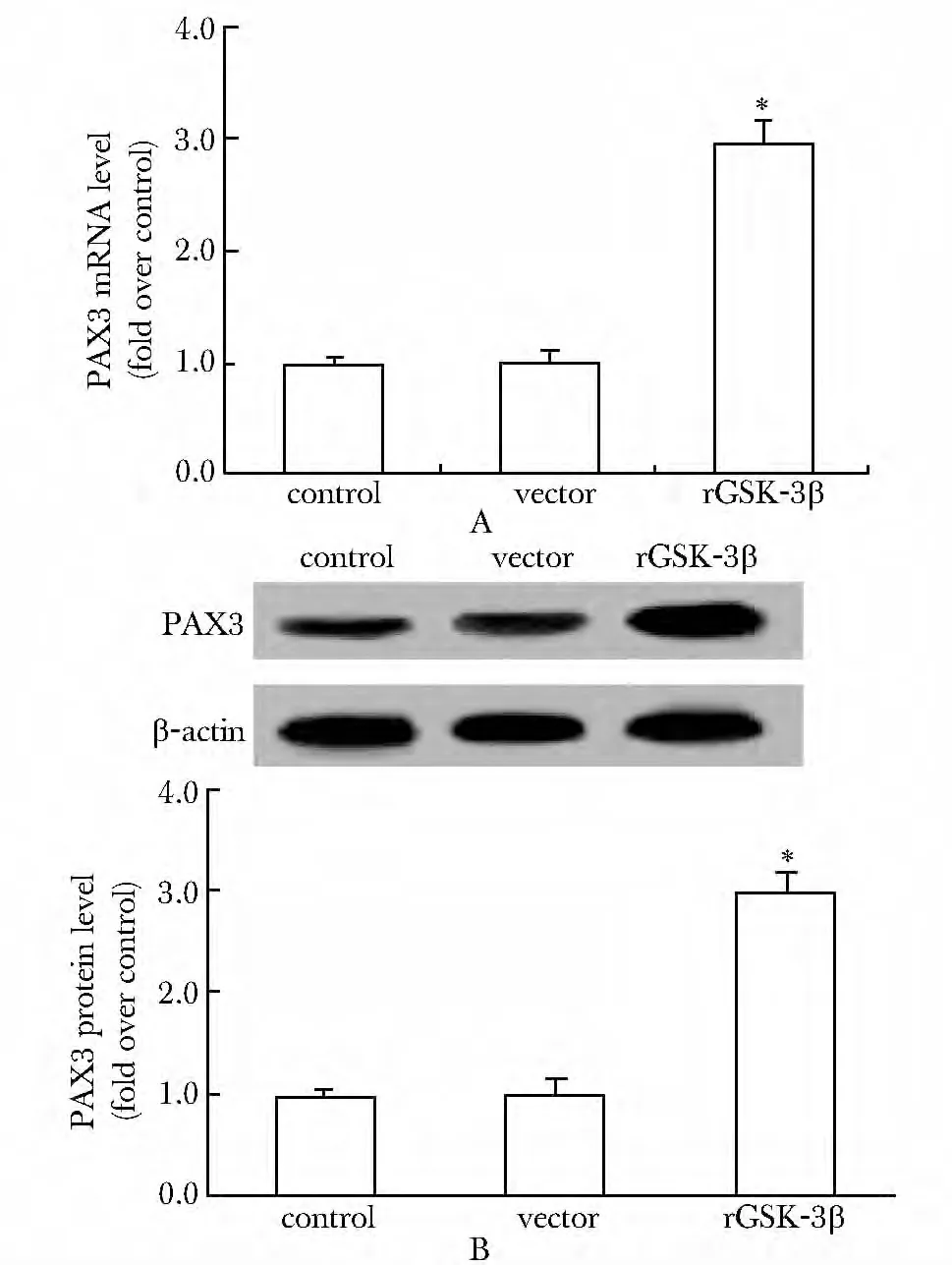
图5 GSK-3β对细胞中PAX3表达水平的影响Fig5 Effect of GSK-3β on PAX3 expression

图6 PAX3 在GSK-3β 介导的细胞增殖及侵袭中的作用Fig6 Function of PAX3 on GSK-3β-induced cell proliferation and invasion
3 讨论
近年来,越来越多研究证明,GSK-3β 不仅参与糖尿病、炎性反应及阿尔茨海默病等疾病的进程,还与多种肿瘤的发生发展密切相关[6-7]。但是,GSK-3β 在胶质瘤中的作用及其机制尚不清楚。本研究证实,与正常人星形胶质细胞1800 相比,人胶质瘤细胞A172、T98、U87 和U251 细胞中GSK-3β的表达明显增高,提示GSK-3β 在胶质瘤发生发展中起重要作用。
已知胶质瘤细胞的增殖及侵袭在胶质瘤的恶性进程中起关键作用,是影响患者预后和存活的关键。目前为止,对GSK-3β 在肿瘤发展中的作用有两种截然不同的观点,有研究表明,GSK-3β 具有促进肿瘤细胞增殖、转移及肿瘤发展进程的作用[6,8];也有研究证实GSK-3β 具有抗肿瘤发生发展的潜在作用[9]。为进一步分析GSK-3β 在胶质瘤中的功能,成功构建了GSK-3β过表达细胞模型。GSK-3β过表达后胶质瘤细胞增殖能力明显增加,同时伴随有侵袭细胞数目的增加,表明GSK-3β 具有促胶质瘤细胞增殖及侵袭的潜能。
PAX3是已知的调控神经元发育的关键转录因子,近年来发现其在多种肿瘤组织中高表达,与黑素瘤、横纹肌肉瘤、成神经细胞瘤等肿瘤的发展息息相关[6,10]。近期研究表明,PAX3 在胶质瘤中表达水平较高,与胶质瘤细胞的增殖、侵袭及肿瘤发生有关[11]。此外,GSK-3 能够上调PAX3的水平,从而有利于人黑素瘤细胞的存活及生长[6]。本研究证实,GSK-3β过表达促进胶质瘤细胞中PAX3的水平。进一步分析发现,PAX3 沉默后GSK-3β过表达诱导的细胞的增殖能力明显下降,同时侵袭细胞的数目降低,提示GSK-3β 可能通过调控PAX3 来影响胶质瘤细胞的增殖及侵袭进程。
综述所述,本研究证实了GSK-3β 在胶质瘤细胞中的作用及其分子机制。因此,本研究将为新型抗胶质瘤药物的研制提供新的研究方向。
[1]Vigneron F,Dos Santos P,Lemoine S,et al.GSK-3β at the crossroads in the signalling of heart preconditioning:implication of mTOR and Wnt pathways[J].Cardiovasc Res,2011,90:49-56.
[2]Chaves Santos C,Chaves R,Cristina Borges A,et al.Homology-based design for selective GSK-3 peptide inhibitors:patent applications and type 2 diabetes mellitus[J].Curr Signal Trans Therapy,2013,8:156-164.
[3]del Ser T,Steinwachs KC,Gertz HJ,et al.Treatment of Alzheimer's disease with the GSK-3 inhibitor tideglusib:a pilot study[J].J Alzheimers Dis,2013,33:205-215.
[4]Shao J,Teng Y,Padia R,et al.COP1 and GSK3β cooperate to promote c-Jun degradation and inhibit breast cancer cell tumorigenesis[J].Neoplasia,2013,15:1075-1085.
[5]Tsukigi M,Bilim V,Yuuki K,et al.Re-expression of miR-199a suppresses renal cancer cell proliferation and survival by targeting GSK-3β[J].Cancer lett,2012,315:189-197.
[6]Kubic JD,Mascarenhas JB,Iizuka T,et al.GSK-3 promotes cell survival,growth,and PAX3 levels in human melanoma cells [J].Mol Cancer Res, 2012, 10:1065-1076.
[7]Koo J,Yue P,Gal AA,et al.Maintaining glycogen synthase kinase-3 activity is critical for mTOR kinase inhibitors to inhibit cancer cell growth[J].Cancer Res,2014,74:2555-2568.
[8]Ban JO,Kwak DH,Oh JH,et al.Suppression of NF-κB and GSK-3β is involved in colon cancer cell growth inhibition by the PPAR agonist troglitazone[J].Chem Biol Interaet,2010,188:75-85.
[9]Ma R,Wei Y,Huang X,et al.Inhibition of GSK 3β activity is associated with excessive EZH2 expression and enhanced tumour invasion in nasopharyngeal carcinoma[J].PLoS one,2013,8:e68614.doi:10.1371/journal.pone.0068614.
[10]Crose LE,Galindo KA,Kephart JG,et al.Alveolar rhabdomyosarcoma-associated PAX3-FOXO1 promotes tumorigenesis via Hippo pathway suppression[J].J Clin Invest,2014,124:285-296.
[11]Xia L,Huang Q,Nie D,et al.PAX3 is overexpressed in human glioblastomas and critically regulates the tumorigenicity of glioma cells[J].Brain Res,2013,1521:68-78.
