T-cadherin在非小细胞肺癌中的表达及其恶性生物学特征关系
2015-05-10杨军平田昌隆
杨军平,田昌隆
(江西中医药大学附属医院检验科,江西 南 昌330006)
目前原发性非小细胞肺癌是我国城市当中发病率最高的恶性肿瘤,其发病率呈不断上升趋势[1,2]。该病病因至今尚未完全明确,目前认为吸烟是其最重要的高危因素,由于烟草中多链芳香烃类化合物和亚硝胺可通过多种机制导致支气管上皮细胞DNA损伤,使得癌基因激活和抑癌基因失活或表达下降从而导致细胞分裂失控,细胞粘附性下降,最终癌变,因此研究细胞粘附因子对攻克肿瘤细胞的转移和浸润具有重要的意义。 已有研究表明,T-cadherin表达的下调与肝癌、结肠癌、宫颈癌和鼻咽癌的发生和转移有关[3-7],但是该基因的表达下调是否与非小细胞肺癌的发生和转移有关尚无定论。
1 材料与方法
1.1 材料
1.1.1 材料来源 本实验选用非小细胞肺癌组织标本50例全部来自于2011年6月至2013年9月在江西省中医院胸外科进行非小细胞肺癌根治术的患者。术后将肿瘤及周边组织石蜡包埋。
1.1.2 临床资料 实验组非小细胞肺癌标本50例,组织标本全部来自于江西省中医院胸外科非小细胞肺癌患者手术切除的标本,所有患者术前均未接受过放疗或化疗,手术患者均病理诊断为非小细胞肺癌,按组织学分型为鳞状细胞癌占32例,腺癌16例,腺鳞癌2例,男性39例,女性11例,患者年龄分布从42.5岁至73.2岁,平均年龄61.4岁。标本取自肉眼可见肿瘤区(未坏死)。
非小细胞肺癌的肿瘤病理分期标准:结合有关肿瘤、附近淋巴结和远处器官转移的信息,而分期用来指特定的TNM分组。分组分期使用数字0和罗马数字ⅠⅡⅢⅣ来描述。T代表肿瘤(其大小以及在肺内和邻近器官的扩散程度),N代表淋巴结扩散,M表示转移(扩散到远处器官)。对照组(1)癌旁正常肺组织50例,取距离同一实验组肿瘤组织边缘5cm以上的远癌正常肺组织为对照。对照组(2)良性病变肺组织20例,组织标本取自江西省中医院胸外科2011年6月至2013年9月间8例肺结核球、10例支气管扩张、2例肺错构瘤患者手术切除的肺组织。
1.1.3 主要试剂 兔抗人T-cadherin多克隆抗体(I抗),购自美国 eBioscience公司。DAB显色试剂盒购自于上海波谷生物科技有限公司;羊抗兔Ⅱ抗、0.1 M 磷酸钠、0.25 M NaCl(pH7.6)和 15 mg/ml BSA购自生兴生物技术(南京)有限公司。即用型免疫组化S-P试剂盒购自于上海倍尼菲生物科技有限公司。
1.2 方法
1.2.1 调查、收集临床资料 查阅病历,收集患者年龄、肿瘤大小、组织类型、组织分级、临床分期、淋巴结转移情况等全部资料并录入SPSS19.O软件数据库。所有标本切片请江西省中医院病理科有经验的主任医师指导复查。
1.2.2 按常规方法进行玻片处理及切片制备。
1.2.3 实验方法 组织切片按常规方法进行脱蜡水化后,用0.03%H2O2在室温条件下处理15~30 min,以封闭内源性过氧化酶的活性,然后通过煮沸法进行抗原修复,再采用兔抗人T-cadherin多克隆抗体为一抗进行免疫组织化学染色,具体方法如下:先滴加正常山羊血清封闭液,室温孵育10min,甩去多余液体,滴加预稀释I抗(兔抗人T-cadherin多克隆抗体,工作浓度1:100)50μl,将组织切片放入4℃冰箱中保存过夜(PBS液替代I抗作阴性对照),取出组织切片37℃下复温30min,用PBS液冲洗5min,重复3次,擦干组织周围残留的PBS液后,再滴加生物素标记的Ⅱ抗,室温静置1h,PBS液冲洗5min,重复3次,滴加HRP标记链亲和素(辣根酶标记的链霉卵白素),室温静置15min,PBS液冲洗5min,重复3次,擦干残留的PBS,最后在暗室中取1ml去离子水,分别滴加DAB显色试剂盒中A、B、C试剂各一滴,混匀后立即滴加切片,置暗盒中室温下显色,显微镜下控制显色反应时间约3min,蒸馏水终止反应,用自来水充分冲洗10min后,苏木精复染1min,流水冲洗返蓝2 min,0.5%盐酸酒精分化2s,流水冲洗2min,递升梯度酒精脱水,二甲苯透明,中性树胶封片,镜下观察。
1.2.4 结果判定 T-cadherin的免疫组化染色以细胞膜及胞质中出现黄色或棕黄色颗粒者为阳性染色。评分标准参照Bames[8]等提出的基于3个参数的半定量计数方法,即染色强度、阳性细胞数和两者记分的乘积。染色强度计分标准为:无色为0分,浅黄色为1分,中度着色为2分,深棕黄色为3分。阳性细胞数目计分标准为:100倍光镜下任意选取10个视野,200倍光镜下观察每一视野,连续观察计数100个细胞,记录其中阳性细胞数,根据阳性细胞所占百分比进行评分,计算阳性细胞百分数后从0到4评分:0分:<10%阳性细胞数;1分:11%~30%阳性细胞数;2分:31%~50%阳性细胞数;3分:51%~75%阳性细胞数;4分:>76%阳性细胞数。两者相乘计分之积为最后得分:0分为(-),1~2分为(+),3~4 分为(++),大于 4 分为(+++)。评分(-)和(+)视为T-cadherin阴性表达,(++)和(+++)视为 T-cadherin阳性表达。如在同一标本中存在多个不同评分的视野,则取最大值和最小值的平均值做为免疫组化评分。
1.2.5 统计学分析 应用SPSS 19.0统计软件对实验结果进行分析处理,组间阳性率的比较及阳性率与临床病理特征之间的相关性分析用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 T-cadherin在非小细胞肺癌组织、癌周组织和良性病变肺组织中的表达 在50例非小细胞肺癌组织标本中,T-cadherin阳性表达率为20%(10/50),对照组1含50例癌周组织标本,T-cadherin阳性表达率为62%(31/50),对照组2含20例良性病变标本,T-cadherin阳性表达率为65%(13/20)(见表1),非小细胞肺癌组织、癌周5cm外的正常肺组织及良性肺肿瘤组织率差异有统计学意义 (P<0.05)。T-cadherin在非小细胞肺癌组织中的细胞免疫组化染色后的镜下形态见图1所示。
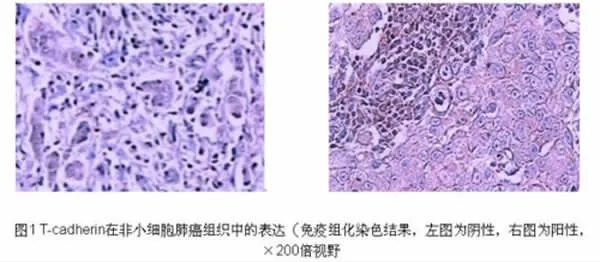
图1 T-cadherin在非小细胞肺癌组织中的表达(免疫组化染色结果,左图为阴性,右图为阳性,×200倍视野)
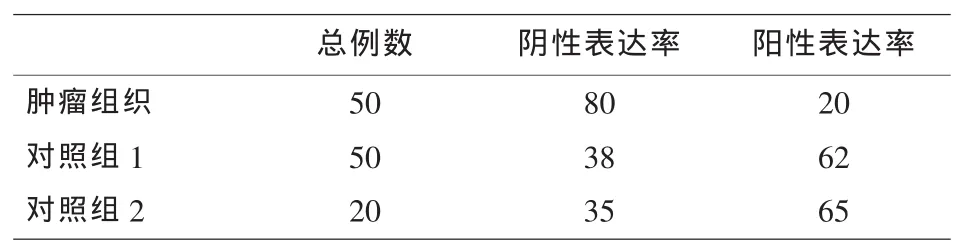
表1 T-cadherin在非小细胞肺癌组织、癌周组织和良性病变肺组织中的表达情况(%)
2.2 T-cadherin基因在有无肺门和/或纵膈淋巴结转移的非小细胞肺癌组织中的表达 表2所示为按有无淋巴结转移(肺门和/或纵膈淋巴结)来分析T-cadherin的表达情况,其中有淋巴结转移的非小细胞肺癌组织中T-cadherin阳性表达率为4.17%,而无淋巴结转移的非小细胞肺癌组织中T-cadherin阳性表达率为34.6%。经χ2检验,有淋巴结转移的非小细胞肺癌组织与无淋巴结转移的非小细胞肺癌组T-cadherin阳性表达率差异有统计学意义(P<0.05)。
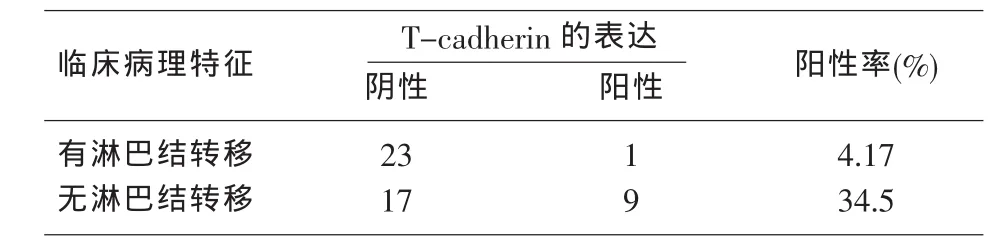
表2 T-cadherin基因在有无肺门和/或纵膈淋巴转移非小细胞肺癌组织中的表达情况
2.3 基于临床病理特性分型的T-cadherin的表达表3所示为按照TNM分期来分析,TNM分期I期非小细胞肺癌组织中T-cadherin阳性表达率为70%,TNM分期Ⅱ期非小细胞肺癌组织中T-cadherin阳性表达率为10.5%,TNM分期Ⅲ及IV期非小细胞肺癌组织中T-cadherin阳性表达率为4.76%。两两比较,TNM分期I期非小细胞肺癌组织与TNM分期Ⅱ期非小细胞肺癌组织中T-cadherin阳性表达率有统计学差异(P<0.05)。TNM分期Ⅱ期非小细胞肺癌组织与TNM分期Ⅲ及IV期非小细胞肺癌组织中T-cadherin阳性表达率无统计学差异(P>0.05)。

表3 T-cadherin基因在各TNM分期的非小细胞肺癌组织中表达情况
2.4 T-cadherin基因在不同分化程度的非小细胞肺癌组织中的表达 表4所示为按肿瘤组织分化程度来分析,将其分高中分化组和低分化组。高中分化的非小细胞肺癌组织中T-cadherin阳性表达率为19.23%,而低分化的非小细胞肺癌组织中T-cadherin阳性表达率为20.83%。经χ2检验,高中分化的非小细胞肺癌组织与低分化的非小细胞肺癌组织中T-cadherin阳性表达率相比无统计学差异(P>0.05)。

表4 T-cadherin基因在不同分化程度的非小细胞肺癌组织中表达情况
2.5 T-cadherin基因在各组织学分型的非小细胞肺癌组织中的表达 表5所示为按病理学分类分析,由于鳞腺癌样本只有两例,且无阳性表达,统计误差可能过大,暂不将鳞腺癌做统计学分析,鳞状细胞癌组织中T-cadherin分子阳性表达率为9.38%(3/32),而腺癌组织中T-cadherin分子阳性表达率为43.75%(7/16)。经χ2检验,鳞状细胞癌与腺癌中T-cadherin分子阳性表达有统计学差异 (P<0.05)。
3 讨论
细胞黏附分子(Cell adhesion molecule,CAM)是介导细胞与细胞或细胞与细胞外基质相互接触和结合的一类糖蛋白分子[9-11],Cadherin家族成员主要包括 E-cadherin、N-cadherin、P-cadherin、T-cadherin[12,13]。正常细胞在cell adherin的作用下发生黏附,从而不易脱落和转移,但当Cadherin表达下降时,细胞的黏附力会下降,从而导致细胞的移动[14-16]。T-cadherin表达的下调与肿瘤的发生已经被广泛的接受了,但是T-cadherin表达的下调是否与非小细胞肺癌的发生和转移有关尚无定论。本研究探讨了非小细胞肺癌组织、癌周组织和良性病变肺组织中T-cadherin表达水平,并从有无淋巴结转移,TNM分期,病理学分类及分化程度四个因素来分别讨论,以期发现T-cadherin在非小细胞肺癌患者中的表达及其恶性生物学特征关系。
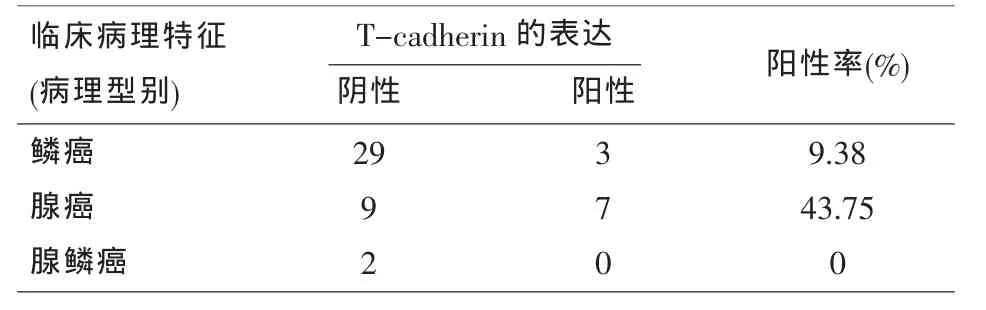
表5 T-cadherin基因在各组织学分型的非小细胞肺癌组织中表达情况
从本研究中可以看到,非小细胞肺癌组织、癌周5cm外的正常肺组织、肺结核球、支气管扩张、错构瘤肺组织中的T-cadherin表达情况,发现正常肺组织、癌周组织、肺结核球、支气管扩张、错构瘤肺组织中绝大多数细胞均呈强阳性或阳性染色,细胞浆内不染色,而在肺腺癌组织中肿瘤细胞呈黄色到棕黄色染色,且染色数量较前明显减少。非小细胞肺癌组织、癌周5cm外的正常肺组织及良性肺肿瘤组织率差异有统计学意义(P<0.05)。我们推论肿瘤组织与癌周正常组织中T-cadherin表达的显著差别,可能与两者间细胞转移能力差别存在一定的相关性。T-cadherin分子是细胞外的黏蛋白分子,其水平下降可以导致细胞黏附力下降,从而细胞移动、转移能力增强。这与以往相关研究结果相似。
非小细胞肺癌组织与良性肺病变组织中的T-cadherin阳性表达率具有统计学差异(P<0.05)。良性病变与恶性肿瘤间最重要的差异是转移能力,我们推测T-cadherin表达的下降与肿瘤细胞的恶变存在密切联系。
良性肺病变组织中及癌周正常组织中T-cadherin表达则基本相似,无统计学差异(P>0.05),由此推论由于癌周组织和良性病变组织细胞转移能力弱,而肺肿瘤细胞有明显的迁移能力,而T-cadherin分子正是细胞黏附分子的一员,其表达的下降导致肿瘤细胞迁移能力增强,而在非肿瘤细胞中则无这种情况。
本研究还揭示了T-cadherin在有无淋巴结转移的表达差异。无淋巴结转移的肿瘤细胞之间可能通过T-cadherin的作用而发生黏附,不易脱落,而有肺门淋巴结转移或纵膈淋巴结转移的肿瘤细胞T-cadherin表达下降,因细胞间的黏附力减弱,易引起肿瘤细胞沿淋巴管转移到附近淋巴结。T-cadherin表达下降,使肿瘤细胞黏附性下降,细胞迁移能力增强,因此更容易出现淋巴结转移。
T-cadherin与肿瘤的发生、转移有着密切的联系,可能扮演抑癌基因的角色。从实验中我们可以看到,TNM分期I期非小细胞肺癌组织中T-cadherin阳性表达率最高,I期非小细胞肺癌没有肺内转移及肺外转移,Ⅱ期非小细胞肺癌侵犯脏层胸膜或者出现转移到同侧支气管周围或同侧肺门和肺动脉淋巴结,其细胞T-cadherin阳性表达率已经有明显下降,而TNM分期Ⅲ及IV期非小细胞肺癌已经有明显转移灶出现,推测T-cadherin表达下降,使肿瘤细胞黏附性下降,细胞迁移能力增强,因此更容易发生转移。
按肿瘤组织分化程度来分析,高分化的非小细胞肺癌组织与低分化的非小细胞肺癌组织中T-cadherin阳性表达无统计学差异(P>0.05)。就实验结果来看,鳞癌与腺癌中的分化高低与T-cadherin阳性表达率无相关性。按病理学分类分析,鳞癌与腺癌组织中T-cadherin阳性表达有统计学差异(P<0.05)。我们推测这与鳞癌细胞间有桥粒联接,张力微丝附着有关。鳞癌其生长速度较慢,因此转移较晚。而腺癌出现转移则较早出现。
综上所述,在非小细胞肺癌患者中,T-cadherin的表达与肿瘤的发生和转移呈负相关性。非小细胞肺癌组织中T-cadherin表达下调与肿瘤TNM分期以及淋巴结转移有相关性。腺癌发生与T-cadherin表达下调存在相关性。
[1]孙哲,李勇,陈声波.恶性肿瘤特异性生长因子在恶性肿瘤患者的检测及其临床意义[J].实验与检验医学 ,2008,26(6):692-670.
[2]贺霄羽,熊莺,孙午.IL13RA2 SNPs与非小细胞肺癌的相关性研究[J].实验与检验医学,2012,30(3):219-221.
[3]熊小蔚,崔明.T-cadherin与肿瘤[J].医学综述,2010,16(8:1170-1172.
[4]张志发,黄志勇,陈孝平,等.T-cadherin启动子甲基化与人肝癌T-cadherin表达的关系 [J].世界华人消化杂志,2008,16(11):1194-1198.
[5]董超,任艳鑫,杨润祥,等.T-cadherin和LMP-1在鼻咽癌中的表达及相关性研究[J].昆明医科大学学报,2012,33(12):55-60.
[6]戴志慧,严群,李兆明,等.结直肠癌中T-cadherin分子表达异常及意义[J].华中科技大学学报(医学版),2008,37(1):121-122,132.
[7]李龙,王月玲.T-cadherin与宫颈癌关系的研究[J].广西医学,2013,35(10):1280-1283.
[8]Barens DM,Meyer JS,Conzalez,et al.Relationship index in brease carcinoma in situ[J].Breast cancer Res Treat,1991,18(3):11-17.
[9]Simin A,Durrieu MC.Strategies and results of atomic force microscopy in the study of cellular adhesion[J].Micron,2006,37(1):1-13.
[10]韩永军,车向明,许延发.肥胖结肠癌患者血清Chemerin与MMPs及粘附因子相关性研究[J].陕西医学杂志,2015,44(3):313-315.
[11]方居正,夏艳斐,黄巧婵,等.温阳益肾法对慢性心衰患者细胞粘附因子水平的影响[J].光明中医,2013,28(9):1821-1822.
[12]Angst BD,MarcozziC,MageeAl.The cadherin supeffamily:diversity in from and function[J].Jo Cell Science,2001,114(pt 4):629-641.
[13]操龙斌,李继霞,周克元.T-钙粘附素在肿瘤发生发展中的作用[J].中国生物化学与分子生物学报,2015,31(3):232-238.
[14]KollerE,RansehB.Differential targeting of T-cadherin and N-cadherin in polarized Epithelial cells[J].J Biol Chem,1996,271(47):30061-30067.
[15]PhilippovaM,IvanovD,TkachukV,et al.Polarisation of T-cadherin to the leading edge of migrating vascular cells in vitro:a function in vascular cell motility[J].Histochem CellBiol 2003,120(5):353-360.
[16]HugC,Wang J,Ahmad NS,et al.T-cadherin is a receptor forhexameric and high-molecular-weight forms of Acrp30 adiponectin[J].Proc Natl Acad Sci U SA,2004,101(28):10308-10313.
