姜黄素对宫颈癌荷瘤裸鼠的抑瘤作用*
2015-05-10游赣花张学愈潘年松张卫霞涂铭旌
游赣花, 罗 俊, 张学愈, 潘年松**, 张 珏, 张卫霞, 涂铭旌, 盛 勇
(1.贵州省食品药品检验所 药理毒理室, 贵州 贵阳 550004; 2.贵州医科大学 药理教研室, 贵州 贵阳 550004; 3.遵义医药高等专科学校 天然药物教研室, 贵州 遵义 563002; 4.四川大学 材料学院, 四川 成都 610065)
姜黄素对宫颈癌荷瘤裸鼠的抑瘤作用*
游赣花1, 罗 俊2, 张学愈3, 潘年松3**, 张 珏3, 张卫霞2, 涂铭旌4, 盛 勇4
(1.贵州省食品药品检验所 药理毒理室, 贵州 贵阳 550004; 2.贵州医科大学 药理教研室, 贵州 贵阳 550004; 3.遵义医药高等专科学校 天然药物教研室, 贵州 遵义 563002; 4.四川大学 材料学院, 四川 成都 610065)
目的: 探讨姜黄素对宫颈癌Hela细胞荷瘤裸鼠的抑瘤作用。方法: 40只雌性裸鼠腋下接种Hela细胞构建荷瘤模型,随机分为姜黄素低、中、高剂量组、5-氟尿嘧啶(5-Fu)组及模型组,分别腹腔注射压榨法提取姜黄素60、120、240 mg/kg,5-Fu 20 mg/kg及等量生理盐水,0.2 mL/只, 隔天1次,连续给药10次;观察肿瘤生长情况、抑瘤率、病理组织学改变,检测细胞周期及凋亡率。结果: 姜黄素低、中、高剂量组的抑瘤率分别为20.14%,32.43%,59.56%,呈剂量依赖性升高;病理切片可见姜黄素给药组细胞核固缩、裂解,肿瘤组织内有炎性细胞浸润,纤维结缔组织增生明显,血管数量减少;姜黄素各给药组的肿瘤细胞凋亡率为12.79%, 16.23%,21.90%,较模型组明显增加(P<0.05), 且肿瘤细胞主要被阻滞于G2/M期。结论: 压榨法提取姜黄素可显著抑制宫颈癌裸鼠移植瘤的增殖,其机制可能与姜黄素诱导癌细胞凋亡有关。
姜黄素; 宫颈肿瘤; 癌; 裸鼠; 凋亡
宫颈癌是发生在宫颈阴道部或移行带的鳞状上皮细胞与宫颈管内膜的柱状上皮细胞交界处的恶性肿瘤,全球每年约9%的女性新发癌症病例为宫颈癌,约8%的女性癌症患者死于此病[1]。因此,研究安全有效的宫颈癌治疗方法和抗癌药物具有重要意义。姜黄素是从姜科姜黄属植物姜黄、莪术、郁金等的根茎中提取的一种天然有效成分,对前列腺癌PC-3细胞、头颈癌Cal27细胞、乳腺癌MCF-7细胞等均有明显抑制作用[2-4],但关于姜黄素对宫颈癌Hela细胞的作用及其机制方面的研究报道较少。本研究建立宫颈癌裸鼠模型,使用姜黄素干预,观察抑瘤率、肿瘤细胞病理形态改变及凋亡情况,研究姜黄素对宫颈癌荷瘤裸鼠的抑瘤作用。
1 材料和方法
1.1 材料
Balb/c雌性裸鼠40只,3~4周龄,体重14~16 g,购自中科院实验动物中心湖南分中心,合格证编号HNASLKJ20113600,饲养于贵阳医学院动物中心无特定病原体(SPF)的动物隔离器内,温度22~26 ℃,相对湿度40%~60%,明暗各12 h。温莪术购于四川省崇州市双郁金合作社,经鉴定确认。5-氟尿嘧啶(10 mL/支,天津金耀氨基酸有限公司),姜黄素标准品(贵州迪大科技有限责任公司,含量≥98%,批号201104)。
1.2 药品制备
温莪术鲜品压榨药渣(已用压榨法去油):经折干率和压榨率计算,183.00 g温莪术鲜品压榨药渣相当于温莪术药材干品80.00 g,加入15倍质量分数80%的乙醇,水浴回流1.5 h,用微孔滤膜抽滤后再提取一次。合并乙醇提取液,于旋转蒸发器上回收溶剂至乙醇提取液成稠膏(约100 mL);在稠膏中加入95%的乙醇400 mL,超声提取0.5 h后用微孔滤膜抽滤,提取2次(第2次加入95%的乙醇100 mL),合并滤液后于旋转蒸发器上蒸干溶剂,收集压榨后的姜黄素膏于棕色瓶中,挥干溶剂后密闭,室温避光保存。经高效液相色谱仪鉴定,姜黄素含量为1.20 mg/g。
1.3 动物建模及分组给药
于裸鼠左侧腋窝皮下注射Hela细胞悬液(3×106个/只,0.2 mL),共接种40只。7 d后接种Hela细胞的裸鼠均出现直径大约5 mm的皮下结节,移植瘤模型建立。接种后第8 天将已建立皮下移植瘤模型的40 只裸鼠随机分为5 组(n=8):姜黄素低、中、高剂量组(60 mg/kg、120 mg/kg、240 mg/kg),模型组,5-Fu组(20 mg/kg),腹腔注射给予相应药物,0.2 mL/只,模型组同法给予等量生理盐水, 隔天1次,连续给药10次。
1.4 观察指标
隔天测量1 次裸鼠体重、肿瘤的最大径(a)和最小径(b),并根据公式:V=ab2/2(单位mm3)计算肿瘤体积。结束治疗后第2 天,所有裸鼠摘眼球取血处死,完整剥出瘤组织并精确称重。计算抑瘤率,公式为:(1-治疗组平均瘤重/模型组平均瘤重)×100%。切取小块瘤组织标本,10%中性甲醛固定、脱水,常规石蜡包埋,并制成4 μm的切片行HE染色,光镜下进行病理学观察。瘤体标本制成约0.5 mm×0.5 mm大小,PBS洗两遍,机械粉碎,过滤,制成细胞悬液;PBS离心,洗两遍,75%乙醇5 mL,4 ℃固定过夜,PBS洗两遍,取约为1×106/mL细胞1 mL,加0.5 g/L碘化丙啶(PI)溶液1 mL,避光染色30~45 min,上流式细胞仪进行细胞周期和凋亡的检测。
1.5 数据统计

2 结果
2.1 瘤重和瘤体积
姜黄素各剂量组瘤重、瘤体积与模型组比较明显降低(P<0.05),随给药剂量的增加,姜黄素各剂量组裸鼠瘤重减轻,差异有统计学意义(P<0.05); 姜黄素低、中、高剂量组的抑瘤率呈剂量依赖性升高。见表1。
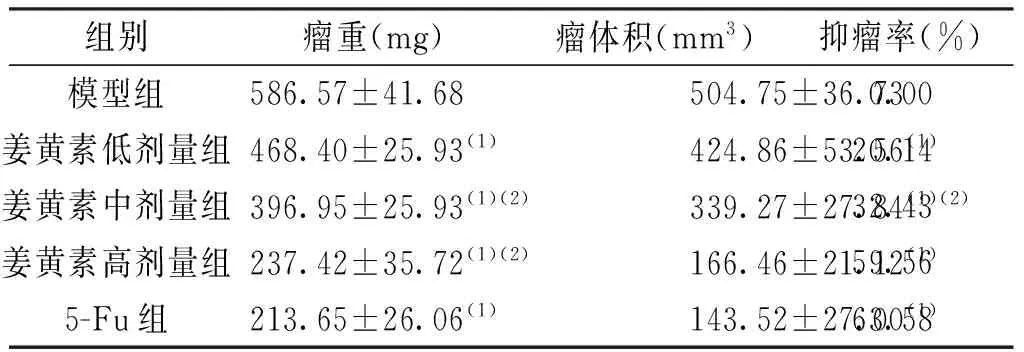
表1 姜黄素对荷瘤裸鼠瘤重、瘤体积的影响(n=8)
(1)与模型组比较,P<0.05;(2)与上一组比较,P<0.05
2.2 病理学改变
病理切片结果显示,姜黄素各给药组随剂量的增加,可出现炎性细胞浸润,细胞核固缩、裂解,血管数量显著减少,纤维结缔组织增生,以及瘤床内片状坏死等形态学改变。5-Fu组细胞内可见大量空泡,细胞核固缩、裂解,肿瘤组织内有较多的坏死组织和炎性细胞浸润,有出血灶及明显的纤维化形成。模型组可见病理性核分裂象,细胞被纤维组织分隔成大小不等的癌巢,组织外层可见较多新生血管。见图1。

注:A为模型组,B为姜黄素低剂量组,C为姜黄素中剂量组,D为姜黄素高剂量组,E为5-Fu组
2.3 肿瘤组织细胞周期和凋亡率
姜黄素各剂量组G0/G1细胞比模型组少,其中高剂量组与模型组比较差异有统计学意义(P<0.05);姜黄素各剂量组S期细胞比模型组少,中、高剂量组与模型组比较差异有统计学意义(P<0.05);姜黄素各剂量组G2/M期细胞比模型组多,且细胞主要阻滞于G2/M期,其中高剂量组与模型组比较差异有统计学意义(P<0.05);姜黄素各剂量组细胞凋亡率较模型组明显升高(P<0.05),且姜黄素随给药剂量的增加,细胞凋亡率亦随之增加(P<0.05)。见表2。

表2 姜黄素对荷瘤裸鼠肿瘤组织的细胞周期和凋亡率的影响(%,n=8)
(1)与模型组比较,P<0.05;(2)与上一组比较,P<0.05
3 讨论
姜黄素的抗肿瘤作用于1985年由印度学者Kuttan首次提出,并逐渐成为国内外学者研究的热点。姜黄素可以用于防治肿瘤,对多种肿瘤细胞的产生、增殖、转移均有抑制作用,如结肠癌、胃癌、白血病等。姜黄素可以作为抗突变剂和抗癌剂,美国国立肿瘤研究所已将其列为第3代癌症化学预防药,有希望成为一种具有广泛应用前景的抗癌新药。
本课题的前期研究表明,姜黄素在体外能够显著抑制Hela细胞株的生长,且发现姜黄素的4种提取方法中压榨法提取的姜黄素体外抑瘤效果最好。本实验结果表明,姜黄素各剂量组均有较好的抑瘤效果,姜黄素低、中、高剂量组瘤重及瘤体积依次降低,抑瘤率依次升高,且呈现剂量依赖性;病理切片可见在不同剂量姜黄素作用下,瘤细胞出现不同程度的核固缩、凋亡小体形成等形态学改变;流式细胞仪检测到凋亡峰,细胞凋亡率12.79%~21.90%,且随给药剂量的增加,细胞凋亡率亦随之增加;S期细胞减少,同时G2/M期细胞增多,上述结果均表明,诱导宫颈癌Hela细胞凋亡可能是姜黄素的抗肿瘤机制之一。
自1972年由Kerr[5]等首先提出凋亡概念并对其形态进行了描述。随后人们在对凋亡形态、基因蛋白调控等方面开展了大量的研究,并发现肿瘤的发生与细胞增殖和细胞凋亡异常相关[6],通过诱导肿瘤细胞凋亡是药物发挥抗肿瘤作用的一个重要机理[7-8]。本课题组将进行凋亡相关基因表达及相关信号转导通路方面的研究,进一步探索姜黄素发挥抗肿瘤作用的机制。
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer Clin, 2011 (2):869-901.
[2] Wei X,Zhou D,Wang H,et al.Effects of pyridine analogs of curcumin on growth,apoptosis and NF-κB activity in prostate cancer PC-3 cells[J].Anticancer Res, 2013 (4) :1341-1350.
[3] Xi Y,Gao H,Callaghan MU,et al.Induction of BCL2-Interacting Killer,BIK, is mediated for anti-cancer activity of curcumin in human head and neck squamous cell carcinoma cells[J].J Cancer, 2015 (4):327-332.
[4] Li Q,Chen J,Luo S,et al.Synthesis and assessment of the antioxidant and antitumor properties of asymmetric curcumin analogues[J]. Eur J Med Chem, 2015(3):461-469.
[5] Kerr JF, Wyllie AH, Currie AR. Apoptosis:a basic biological phenomenon with wide ranging implication in tissue kinetics[J].Br J Cancer, 1972(4):239-257.
[6] Kamesaki H. Mechanisms involved in chemotherapy-induced apoptosis and their implications in cancer chemotherapy[J]. Int J Hematol, 1998(1):29-43.
[7] Yang L, Cui Y,Shen J,et al.Antitumor activity of SA12, a novel peptide, on SKBr-3 breast cancer cells via the mitochondrial apoptosis pathway[J]. Drug Des Devel Ther, 2015 (9):1319-1330.
[8] Choi DW, Lim MS, Lee JW,et al. The cytotoxicity of Kahweol in HT-29 human colorectal cancer cells is mediated by apoptosis and suppression of heat shock protein 70 expression[J]. Biomol Ther (Seoul), 2015(2):128-133.
(2015-05-20收稿,2015-06-30修回)
中文编辑: 吴昌学; 英文编辑: 赵 毅
Anti-Tumor Effects of Curcumin on Cervical Cancer Tumor-bearing Nude Mice
YOU Ganhua1, LUO Jun2, ZHANG Xueyu3, PAN Niansong3, ZHANG Jue3, ZHANG Weixia2, TU Mingjing4, SHENG Yong4
(1.DepartmentofPharmacologyandToxicology,GuizhouInstituteforFoodandDrugControl,Guiyang550004,Guizhou,China;2.DepartmentofPharmacology,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China;3.DepartmentofNaturalMedicine,ZunyiMedicalandPharmaceuticalCollege,Zunyi563002,Guizhou,China;4.CollegeofMaterial,SichuanUniversity,Chengdu610065,Sichuan,China)
Objective: To investigate the anti-tumor effects of curcumin on nude mice with cervical cancer. Method: Forty nude female mice were inoculated Hela cells in axillary skin, and dividing into five groups randomly: the low, medium, high dose group of curcumin (60 mg/kg, 120 mg/kg, 240 mg/kg), the 5-Fu group and the model group. Then, injecting the curcumin, which from pressing 60, 120, 240 mg/kg, 5-Fu 20 mg/kg and equal amount of normal saline into mice with intraperitoneal injection way, 0.2 mL for each at the frequency of one time every other day for 10 times. The tumor growth,anti-tumor rate and histopathology were observed. Meanwhile, the cell cycle and apoptosis rate were also detected. Results: The anti-tumor rates of the low, medium, high dose groups of curcumin were 20.14%,32.43%,59.56% respectively, which indicated dose-dependent;according to the results of pathological section, these groups curcumin cell nucleus pyknosis,lysis,meanwhile the inflammatory cell infiltration in tumor tissue,and the proliferation of fibrous connective tissue was significantly, however the number of blood vessels decreased. The flow cytometry results showed that the tumor cell apoptosis rates of the low,medium,high dose groups of curcumin were 12.79%,16.23%, 21.90%. Comparing with the model group, they were increased significantly (P<0.05) , and most of tumor cell was blocked in the G2/M phase. Conclusion: Curcumin from pressing can inhibit the cervical cancer proliferation in nude mice significantly,the mechanism may be rlated to the apoptosis of cancer cells induced by curcumin.
curcumin; cervix neoplasms; carcinoma; nude mice; apoptosis
贵州省教育厅自然科学研究项目[黔教科(2009)0101号]; 贵州省科技计划项目[黔科合SY(2008)3027]
时间:2015-08-07
http://www.cnki.net/kcms/detail/52.5012.R.20150807.2228.002.html
R979.1
A
1000-2707(2015)09-0915-04
**通信作者 E-mail:783044500@qq.com
