萼脊兰总RNA提取方法的比较研究
2015-05-10蒋素华李艳辉王洁琼王默霏
蒋素华,李艳辉,王洁琼,梁 芳,王默霏,崔 波
(1.郑州师范学院生物工程研究所,河南 郑州450044;2.河南农业大学生命科学学院,河南郑州450002;3.封丘县农业局,河南 新乡453300)
萼脊兰(Sedirea japonica)是兰科(Orchidaceae)萼脊兰属(Sedirea)植物,主要产于中国浙江(文成)、云南西部(盈江),生长于海拔600~135 0 m的疏林树干上或山谷岩壁上,在日本(琉球群岛)、朝鲜半岛南部也有少见,是一种观赏价值很高的附生兰,因其花小而素雅,其花色清丽,具有奇妙的幽香,观赏期长,养护简单且耐寒,故越来越受到人们的亲睐[1-3]。随着分子生物学在花卉相关研究及其在育种过程中的应用,近几年来兰科植物相关基因成为当今研究的热点,对萼脊兰相关基因的研究也是刚刚起步[4-6]。本试验采用Trizol法、CTAB法、RNA prep Pure Plant Kit方法分别从萼脊兰的根、叶、花葶、花萼、花瓣、柱头、唇瓣中提取总RNA,比较3种总RNA提取方法的优劣,分析所提萼脊兰不同组织总RNA的质量高低。RNA分离提取是分子生物学研究的基本内容,也是功能基因组学研究技术的重要基础。因此,萼脊兰不同组织总RNA提取和质量的研究对于萼脊兰基因克隆、定量PCR、Northern杂交分析、cDNA文库的构建等提供科技支撑。
1 材料与方法
1.1 材料
以郑州师范学院兰花工程技术研究中心温室的萼脊兰为试材。将盛花期新鲜的萼脊兰根、叶、花葶、花萼、花瓣、唇瓣、柱头用剪刀取下,迅速放入液氮中速冻,然后放于-80℃冰箱保存备用。
1.2 玻璃器皿及研钵的处理
普通玻璃、金属药匙和研钵于200℃烘烤8 h。用于RNA电泳的电泳槽先用去污剂洗干净,双蒸水冲洗3~4遍,自然干燥后,用灭菌的 0.1%DEPC浸泡24 h。塑料制品等用 0.1%DEPC水37℃浸泡过夜后高压灭菌。
1.3 试剂
CTAB提取 RNA缓冲液为:2%CTAB,2%PVP,25 mmol·L-1EDTA,100 mmol·L-1Tris-Cl pH 值 8.0,2.0 mol·L-1NaCl,0.5 g·L-1Spermidine(亚精胺)。灭菌后加入体积分数2%β-巯基乙醇。
SSTE buffer 为:1.0 mol· L-1NaCl,0.5%SDS,10 mol·L-1Tris-Cl pH 值 8.0,1.0 mol·L-1EDTA。
V(氯仿)∶V(异戊醇)=24∶1,将氯仿和异戊醇按体积24∶1的比例混匀,置棕色瓶中,4℃保存。
V(酚)∶V(氯仿)∶V(异戊醇)=25∶24∶1,饱和酚、氯仿、异戊醇体积比为25∶24∶1混匀,置棕色瓶中,4℃保存。
DEPC(焦碳酸二乙酯)、氯仿、异丙醇、无水乙醇、EDTA(乙二胺四乙酸)、Tris、冰醋酸、PVP、Na-CI、CTAB、NaAc、LiCl。
1.4 仪器
-80℃超低温冰箱、鼓风干燥箱、Quawell Q5000微量紫外可见分光光度计(200~850 nm全波长扫描核算蛋白测定仪)、电泳仪及电泳槽、凝胶成像系统、高速冷冻离心机、实施荧光定量PCR仪、旋涡混合器。
1.5 方法
1.5.1 CTAB法 65°C水浴中预热30 mL CTAB提取液。液氮中研磨0.5 g冷冻的材料。转移样品至有 CTAB提取液的离心管中,立即激烈涡旋30 s,短时放回65°C水浴中4~5 min。加入等体积的氯仿/异戊醇并涡旋混合,4℃下12 000 r·min-1离心15 min。将上清液转移至一新离心管。重复抽提1次。将上清转移至另一新离心管中,加入 8 mol·L-1LiCl,使 LiCl的终浓度为2 mol·L-1,4℃下沉淀过夜。4℃离心1 h,弃上清液,用500 μL体积分数70%乙醇洗沉淀,然后用500 μL无水乙醇洗沉淀。用500 μL SSTE溶解沉淀,转移至1.5 mL离心管中,加入等体积的酚:氯仿:异戊醇抽提1次。加入2倍体积的冰浴无水乙醇,在-80℃沉淀30 min。4℃离心20 min沉淀RNA。先用400 μL体积分数70%乙醇洗沉淀,然后用400 μL无水乙醇洗沉淀,吹干后加入65 μL DEPC水溶解RNA。
用DNase处理提取的 RNA:用65 μLDEPC水溶解 RNA沉淀,加入10×DNase assay buffer 7.5 μL ,RNase inhibitor 1.0 μL,DNaseⅠ1.5 μL 37 ℃水浴20 min,调整样品体积至250 μL,加入1/10体积 3 mol·L-1NaAc(pH=5.2),即 25 μL,涡旋混匀。加入2倍体积冷的无水乙醇,混匀后,储存在-20℃ 30 min。4℃离心20 min,沉淀 RNA(全速),用体积分数70%乙醇洗沉淀,然后用无水乙醇洗沉淀,吹干后,用适量DEPC水溶解RNA。置-80℃冰箱中保存。
1.5.2 Trizol法 参照 invitrogen Trizol试剂盒说明书进行。
1.5.3 RNA prep Pure Plant Kit法 参考天根科技有限公司RNA prep Pure Plant Kit提取说明书方法。
1.5.4 完整性检测 取2 μLRNA 样品在1.2%的琼脂糖凝胶上电泳检测总 RNA的28S、18S和5S。
1.5.5 总RNA的浓度及纯度测定 利用Quawell Q5000微量紫外可见分光光度计测定总RNA的A260/A280的值和A26 0/A230的值,同时测定其浓度。
1.5.6 实时荧光定量 PCR(qRT-PCR)检测qRT-PCR对cDNA的纯度和质量都有较高的要求,为了验证不同组织总RNA的可用性效果,进行实时荧光定量PCR验证。
分别提取萼脊兰不同组织的总 RNA,使用TaKaRa的PrimeScript RT reagent Kit With gDNA E-raser试剂盒反转录合成cDNA第一链。以内参基因 18S-F:5’GAACGAGACCTCAGCCTGCTA3’和18S-R:5’CATCACGGACCTGTTATTGC3’为引物,对所得的cDNA进行表达分析。采用三步法qRT-PCR,20 μL 反应体系包括 10 μL 2 × SYBR®Premix Ex TaqTMII(TaKaRa)、0.8 μL 的上下游基因特异性引物及各个样本的 cDNA2.0 μL,并补dH2O至20 mL。反应程序为:预变性95℃ 30 s;95℃变性15 s;退火15 s;72℃延伸30 s,40个循环,扩增产物于1%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 RNA完整性检测
分别将3种方法提取的萼脊兰7个不同组织的总RNA样品进行琼脂糖凝胶电泳分析(图1),结果显示 CTAB法提取的 RNA 28S、18S、5S条带清晰,表明所提取的总RNA基本没有降解。Trizol法提取的RNA 28S、18S、5S条带3个组织中的条带较清晰,其余4个组织中的总RNA条带亮度较差。RNA prep Pure Plant Kit提取的 RNA根、花萼、花瓣28S、18S条带较清晰,其余组织中的28S、18S、5S不清晰,RNA质量很差。
2.2 样品的浓度与纯度
高纯度 RNA 的 OD260/OD280应介于 1.8 ~2.0,OD260/OD230应大于2.0,CTAB法提取的7个组织的总 RNA OD260/OD280介于1.8 ~2.0,说明样品未受污染,RNA较纯;RNA的质量浓度在200~500 g·L-1;Trizol法提取的不同组织的总RNA的纯度和浓度只有叶、花葶、花萼、唇瓣OD260/OD280介于1.8~2.0,说明 RNA 较纯,其余的组织 OD260/OD280在1.8以下,表明有蛋白质、多糖或多酚残留,RNA 的质量浓度在 50~300 g·L-1。RNA prep Pure Plant Kit提取的RNA只有根、花萼、花瓣OD260/OD280介于 1.8 ~2.0,其余 4 个组织的总RNA OD260/OD280均低于 1.8,RNA 的质量浓度在50~100 g·L-1。3种方法提取的总 RNA的OD260/OD230都低于2.0,说明RNA被碳水化合物,盐类或有机溶剂污染。可见CTAB法提取的总RNA质量优与Trizol法和RNA prep Pure Plant Kit。
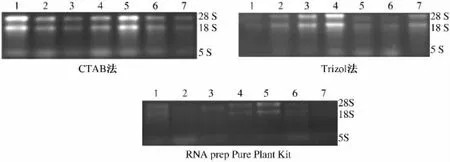
图1 CTAB法、Trizol法、RNA prep Pure Plant Kit提取总RNAFig.1 Total RNA was extracted with CTAB method,Trizol method and RNA prep Pure Plant extract Kit
2.3 不同组织总RNA进行实时荧光定量PCR检测
为进一步确定利用CTAB法提取的不同组织总RNA的质量高低,对提取的总RNA分别做荧光定量PCR,扩增内参基因18S。由扩增曲线(图2)可知,扩增曲线平行性好,表明各反应管的扩增效率相近;由溶解曲线(图3)可知,TM值在80~90℃,说明无引物二聚体存在,溶解曲线为单一峰,并且波峰位置重叠,说明没有非特异性扩增产物。本试验将内参基因18S的荧光定量PCR产物电泳检测,结果显示(图4),18S条带亮且单一,不含引物二聚体,说明利用CTAB法提取的不同组织的总RNA完全可以满足荧光定量PCR的要求,为下一步目的基因的表达分析奠定了良好基础。
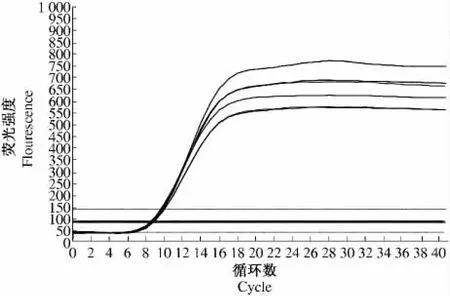
图2 18S基因扩增曲线Fig.2 Amplification curve of 18S gene
3 讨论
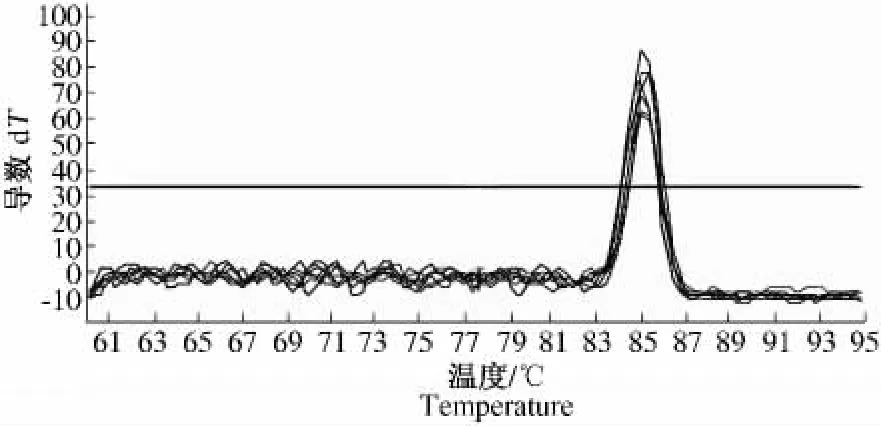
图3 18S基因溶解曲线Fig.3 Melting curve of 18S gene
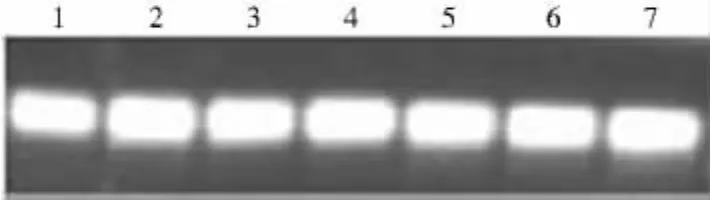
图4 18S基因实时荧光定量PCR扩增Fig.4 Real time PCR of 18S gene
植物组织总RNA的提取是分子生物学研究中的基础,更是研究中的难点。不同的植物种类,甚至同一种植物不同组织、不同时间的同一组织材料都会因为其中化学组成的不同而需要对其总RNA提取的方法做出相应调整[7-10]。Trizol法步骤繁琐,试剂配制麻烦,在提取过程中RNA容易丢失而影响RNA的浓度;针对植物多糖、多酚RNA prep Pure Plant Kit试剂盒法的适用性虽较为普遍,操作简单,但是成本高,RNA得率低。CTAB法提取过程耗时较长,但是操作步骤灵活,提取的RNA浓度高,适合萼脊兰不同组织总RNA的提取。
萼脊兰不同组织中的总RNA的提取过程中,利用CTAB法,萼脊兰根、花瓣、花葶、花萼、唇瓣、柱头较好提取,提取过程中没有出现粘稠状的物质,而在叶片中出现粘稠状物质,这可能是因为不同发育时期糖分代谢不同[11],赵春喜等[12]也认为植物成熟组织常富含多糖;而多糖的许多理化性质又与RNA相似,在提取中与RNA以复合体形式存在,增大了提取难度。在溶解RNA时,该复合体难溶于水,因而出现溶解后呈黏稠状的胶质溶液[13-14]。
对基因表达进行定量检测时常使用β-肌动蛋白基因、28S和18S rRNA等看家基因作为内部参照,这些基因被认为在某些类型细胞中的表达是恒定的[15-16]。本试验采用内参基因18S进行QRTPCR检测RNA质量,为基因表达分析奠定了基础。
[1] 张玉武,杨红萍,陈 波,等.中国兰科植物研究进展概述[J].贵州科学,2009,27(4):78-85.
[2] JAAKOLA L,PIRTTILA A M,HALONEN M,et al.I-solation of high quality RNA from bilberry(Vaccinium myrtillus L.)fruit[J].Mol Biotechnol,2001,19:201-203.
[3] MALNOY M,REYNOIRD J P,MOURGUES F,et al.A method for isolating total RNA from pear leaves[J].Plant Mol Biol Reptr,2001,19:69 - 69.
[4] 王卜琼,李枝林,余朝秀.兰花育种研究进展[J].园艺学报,2005,32(3):551-556.
[5] 崔 波,马 杰,张仙云,等.萼脊兰的组织培养和快速繁殖[J].植物生物学通讯,2008,44(2):22-23.
[6] 崔 波,沈俊辉,顾东亚,等.萼脊兰胚培养与快速繁殖研究[J].安徽农业科学,2009,37(13):5861-5863.
[7] 朱永平,田 璐,武芸芸,等.墨兰舌瓣总RNA提取方法比较研究[J].现代农业科技,2010,14(2):25-28.
[8] 阮桢媛,陈晓鸣,杨子祥.角倍总 RNA提取方法建立及ACTIN基因片段克隆[J].林业科学研究,2012,25(5):551 -557.
[9] 林 莹,陈晓静.番木瓜果肉RNA提取方法的比较[J].亚热带农业研究,2008,4(3):229-232.
[10]王玉成,杨传平,姜 静.木本植物组织总RNA提取的要点与原理[J].东北林业大学学报,2002,30(2):1-4.
[11]孟晓庆,侯智霞,张 兰,等.榛子总RNA提取方法的比较研究[J].西北农林科技大学学报:自然科学版,2013,41(3):75-80.
[12]赵春喜,马利华,杨同文.改进的CTAB法提取中华芦荟叶总RNA[J].安徽农业科学,2008,36(16):6671- 667.
[13]李 宏,王新力.植物组织RNA提取的难点及对策[J].生物技术通报,1999(1):36-39.
[14] WANGS X,HUNTER W,PLANT A.Isolation and purification of functional total RNA from woody branches and needles of Sitka and white spruce[J].Biotechniques,2000,28:292 -296.
[15]朱芷葳,董常生.持家基因作为相对定量内标物的稳定性比较[J].生物技术通讯,2006,17(5):807-809.
[16]高志民,彭镇华,李雪平,等.毛竹苯丙氨酸解氨酶基因的克隆及组织特异性表达分析[J].林业科学研究,2009,22(3):449-453.
