脯氨酸对盐胁迫条件下大麦叶片Rubisco酶活性的影响
2015-05-10熊大斌曹玲珑李冬兵牛洪斌
熊大斌,曹玲珑,李冬兵,邓 利,尹 钧,牛洪斌
(河南农业大学国家小麦工程技术研究中心,河南郑州450002)
盐害是限制作物生长和生产力的主要逆境因子之一。据统计,世界耕地中20%以上的雨养种植区,近50%的灌溉面积均受到不同程度的盐害影响[1]。盐胁迫直接和间接影响植物的多种生理生化过程,包括蛋白质合成,能量和脂质代谢和光合作用[2]。其中包括影响光合关键酶Rubisco(核酮糖 -1,5 -二磷酸羧化酶/加氧酶;EC4.1.1.39)的活性。研究表明,盐胁迫在提高Rubisco加氧酶活性的同时降低其羧化酶活性[3]。为应对包括盐胁迫在内的逆境胁迫,植物体形成了一系列的应对措施,其中最主要的方式之一就是通过渗透调节缓解伤害[4-7]。植物体内参与渗透调节的物质种类众多,主要是各种类型的低相对分子质量分子,如脯氨酸、谷氨酸、氨基乙酸、甜菜碱、肉碱、甘露醇、山梨醇、果糖、多元醇、海藻糖、蔗糖和多种低聚糖[8-12]。脯氨酸作为最重要的渗透调节物质可维护植物细胞膜的完整性,保护多种重要蛋白质的功能[13-14],并可以提高植物细胞内各种活性氧清除酶的活性,缓解上述胁迫条件下产生的各种活性氧对植物的伤害[2]。此外,脯氨酸还可以作为碳、氮源储备,以供植物生长发育的需求[14-15]。大麦(Hordeum vulgare)是重要的耐非生物胁迫的作物之一[16]。本研究分析盐胁迫条件下外源脯氨酸对大麦幼苗的保护作用,为深入探究麦类作物耐盐机制奠定基础。
1 材料与方法
1.1 植物材料和胁迫处理
大麦(Hordeum vulgare cv.Yupi No.1)幼苗培养在生长箱中,温度设置为24℃/20℃,12 h光照/12 h黑暗,光照度为 3 000 lx,相对湿度为45%,每天更换Hoagland培养液。在苗龄为15 d时进行外源脯氨酸和盐胁迫处理,共设置3个处理:P(50 mmol·L-1脯氨酸),N(50 mmol·L-1NaCl) 和 N+P(50 mmol·L-1NaCl+50 mmol·L-1脯氨酸),以及对照(无添加剂)。每个处理200株,至少5次重复。在不同的胁迫时间下(0,2,4,8,12 d)收取各处理的叶片,迅速用液氮冷冻并储存在-80℃,测定核酮糖-1,5-二磷酸羧化酶和加氧酶活性,抗氧化酶活性和类囊体膜蛋白。所有酶活性分析均采用大麦幼苗上部顶叶。
1.2 核酮糖-1,5-二磷酸羧化酶/加氧酶的纯化和活化
核酮糖-1,5-二磷酸羧化酶/加氧酶的粗提取、纯化及活性激活采用 SIVAKUMAR等[17]和SERVAITES等[18]的方法。基本操作程序如下:将50 g 的叶片在 100 mL pH 8.0 的 50 mmol·L-1Tris-acetate buffer(20 mmol·L-1Mg(OAc)2,0.1 mmol·L-1EDTA,50 mmol·L-1β-mercaptoethanol,和 2%PVP) 中匀浆,16 000 r·min-1离心 15 min后取上清液,并先后用含有17.5%的PEG-4000柱和CL-6B柱。纯化后的Rubisco溶解于50 mmol·L-1Tris-acetate buffer(pH 8.0,20 mmol·L-1Mg(OAc)2,6 mmol·L-1NaHCO3,0.1 mmol·L-1EDTA,0.1 mmol·L-1DTT)28 ℃放置10 min,终质量浓度调整为5 g·L-1。羧化酶和氧化酶的测定均采用SIVAKUMAR等[19]的方法。
1.3 抗氧化酶活性的测定
各取150 mg大麦幼苗叶片,分别用1 mL pH 7.6 含有 0.1 mmol·L-1EDTA 的 50 mmol·L-1HEPES-KOH缓冲液匀浆[用于超氧化物歧化酶(SOD)分析],1 mL pH 7.6 的 50 mmol·L-1磷酸缓冲液(含有质量浓度为2%PVP,体积分数为1%Triton X-100,用于抗坏血酸过氧化物酶(APX)分析),1 mL pH 6.8 的50 mmol·L-1磷酸缓冲液[用于过氧化氢酶(CAT)分析]。SOD活性的测定采用分光光度计法,APX活性的测定采用ASADA等[20]方法,CAT 活性的测定采用 CAKMAK 等[21]改良法。酶活性通过每分每毫克蛋白质分解成过氧化氢的量来计算,采用的过氧化氢消光系数是3.94 ×104L·mol-1·cm-1。
1.4 类囊体膜的制备和SDS-PAGE电泳
大麦类囊体膜蛋白质的分离采用LI等[22]的方法,SDS-PAGE电泳根据REZNICK等[23]的方法进行。利用软件VDS(Pharmacia Biotech,Uppsala,Sweden)对目的蛋白质Rubisco的含量进行测定,并以空白泳道背景信号作为对照。
1.5 质谱及蛋白质鉴定
SDS-PAGE电泳及蛋白质染色后,切去差异表达蛋白质(约55 kD),无菌水冲洗并送交公司(Gene Core Bio Technologies公司,上海)进行MALDI-TOF和串联质谱(MS/MS)分析,鉴定该蛋白质。利用MASCOT软件对测定数据进行分析,并判定蛋白质种类。
2 结果与分析
2.1 外源脯氨酸对盐胁迫条件下大麦幼苗叶片Rubisco活性的影响
在盐胁迫下大麦叶片中羧化酶的活性被抑制,外源脯氨酸的添加可以延缓活性的丧失。与N处理相比,在胁迫4,8和12 d时N+P处理组羧化酶活性丧失分别降低了6.7%,11.6%和30.7%(图1)。相比之下,盐胁迫可以显著激活Rubisco的氧化酶活性,外源脯氨酸的添加可以延缓该活性的上升。经过胁迫处理8 d时N处理组样品的Rubisco的氧化酶活性比CK提高了42.2%,N+P处理组样品的活性在2,4,8,12 d时的氧化活性分别是N处理样品的88.4%,78.1%,88.9%和93.5%(图2)。
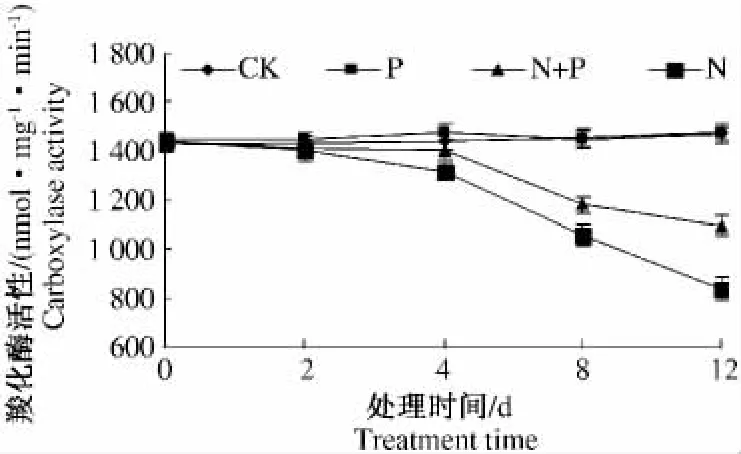
图1 外源脯氨酸的添加对盐胁迫条件下大麦叶片中Rubisco羧化酶酶活性的影响Fig.1 The interaction between exogenously supplied proline and salinity stress on the activity of ribulose-1,5-bisphosphate carboxylase
2.2 外源脯氨酸对大麦幼苗叶片Rubisco大亚基在叶绿体膜上富集和降解的影响
在盐胁迫条件下,N处理组大麦叶片来源类囊体膜蛋白质电泳显示,在55 kD处出现差异表达蛋白质,而在非胁迫样品中未检测到相应条带(图3-a)。肽指纹图谱分析结果显示,该差异蛋白质与Rubisco大亚基高度同源,与小麦(GenBank登录号 14017580和 32966580),Psathyrostachys huashanica(GenBank登录号51859667),冰草属Cristatum(GenBank登录号61378600)和大麦属Bulbosum(GenBank登录号31087905)等Rubisco大亚基的覆盖率分别为32%,31%,30%和30%,覆盖区段氨基酸一致性在98.6%以上,据此推断该特异诱导蛋白质为大麦Rubisco大亚基(表1)。

图2 外源脯氨酸的添加对盐胁迫条件下大麦叶片中Rubisco氧化酶酶活性的影响Fig.2 The interaction between exogenously supplied proline and salinity stress on the activity of ribulose-1,5-bisphosphate oxygenase in barley
在脯氨酸存在条件下,在盐胁迫2 d后N+P组电泳图谱显示可以微弱地诱导出Rubisco大亚基,并在12 d(图3-b)时达到表达高峰 (图3-b)。与N+P组相比,N组Rubisco大亚基在各处理时间段上的表达量分别是N+P组的219.6%(2 d),119.6%(4 d)和257.3%(8 d)(图4),表明添加脯氨酸可以缓解Rubisco大亚基在类囊体膜上的富集降解。

图3 盐胁迫条件下大麦类囊体膜蛋白质的SDS-PAGE电泳结果Fig.3 SDS-PAGE electrophoresis of barley thylakoid membrane protein in salinity stress

表1 类囊体膜上Rubisco大亚基(~55 kD)的LC-MALDI-MS/MS鉴定结果Table 1 Tryptic peptide fragment sequences released from the ~55 kD protein,as determined by LC-MALDI-MS/MS
2.3 外源脯氨酸对盐胁迫条件下大麦叶片抗氧化酶活性的影响
外源添加脯氨酸对大麦叶片中SOD,APX和CAT活性影响结果见表2。相对于N处理,脯氨酸的存在可以提高SOD的活性(11%~64%)。在盐胁迫处理2和4 d后,APX活性在N和N+P处理组间无显著差异,然而至第8天,N+P处理组的活性比N处理组高19%,第12天时高出15%。CAT的活性变化与APX类似,在处理2和4 d时N和N+P处理组间的活性无显著差异,但是在第8天时,N+P处理组比N处理组高23%,在第12天时高出48%。
3 讨论
在50 mmol·L-1NaCl胁迫处理下,大麦幼苗叶片中的Rubisco羧化酶活性显著降低,氧化酶活性升高。前人研究报道,在脯氨酸存在下可以缓解盐胁迫引起的Rubisco氧化酶活性增加[19],这与本研究结果相符。外源添加脯氨酸对植物的另一个显著效果是可以有效地缓解盐胁迫逆境下植物叶片中的羧化酶活性的降低。Rubisco在植物叶片中大量存在,在C3植物叶片可溶性蛋白质中约占50%[24],在 C4植物中含量约为 1/3[25]。Rubisco全酶是由8个55 kD的大亚基和8个15 kD的小亚基组成的复合体。前者是由叶绿体的Rubisco L基因编码的[26],后者小亚基是由一种细胞核Rubisco L基因家族编码的[27]。Rubisco非常敏感,尤其是在非生物胁迫条件下更易被降解[28-32]。对于小麦来说,在非生物胁迫条件下Rubisco的羧化酶活性和氧化酶活性均非常敏感,并极易与叶绿体内膜上的可溶性酶复合物交联和易位,并被迅速地降解[33]。体外试验表明,体外氧化条件可以刺激Rubisco与叶绿素中的不溶性蛋白质组交联聚合,并被部分降解[34]。本研究同样发现,在盐胁迫条件下Rubisco异常地在叶绿体类囊体组分中积累,表明了即使在低盐浓度胁迫下也会产生和氧化条件下的类似反应,而体外施加脯氨酸可以有效地缓解上述效应,表明外源脯氨酸可以缓解盐胁迫对大麦植株的危害。由盐胁迫导致的植物体内渗透压失调和离子紊乱可以刺激细胞内活性氧浓度的上升[2],因此,包括 APX,SOD 和 CAT在内的抗氧化酶在清除活性氧方面所发挥的作用极其重要[2]。前人研究结果表明,脯氨酸可以保护因干旱[35]、盐[36]或者紫外线的辐射[4]而诱发的氧化胁迫。本研究表明,外源脯氨酸可以激活SOD,APX和CAT等抗氧化酶的活性,并与HOQUE等[37]的研究结果相吻合。

图4 不同盐胁迫处理后大麦幼苗叶片Rubisco大亚基含量的变化Fig.4 Changes of Rubisco large subunit content in barley seedling leaf after different treatments

表2 外源添加脯氨酸对盐胁迫条件下大麦叶片中抗氧化酶类活性的影响Table 2 The interaction between exogenously supplied proline and salinity stress on the activity of the antioxidant enzymes SOD,APX and CAT
上述研究结果表明,脯氨酸可以对盐胁迫下的大麦提供有效的保护作用,主要是通过减缓Rubisco羧化酶活性的降低,以及减少Rubisco在类囊体膜上异常积累程度等方式发挥作用的。
[1] ZHU J K.Plant salt tolerance[J].Trends in Plant Science,2001,6(2):66-71.
[2] PARIDA A K,DAS A B.Salt tolerance and salinity effects on plants:a review[J].Ecotoxicology and Environmental Safety,2005,60(3):324-349.
[3] REDDY M P,SANISH S,IYENGAR E R R.Photosynthetic studies and compartmentation of ions in different tissues of Salicornia brachiata Roxb.under saline conditions[J].Photosynthetica,1992,26:173 -179.
[4] ZHU J K.Salt and drought stress signal transduction in plants[J].Annual Review of Plant Biology,2002,53:247.
[5] HONGBO S,ZONGSUO L,MINGAN S.Osmotic regulation of 10 wheat(Triticum aestivum L.)genotypes at soil water deficits[J].Colloids Surf B Biointerfaces,2006,47(2):132-139.
[6] VALLIYODAN B,NGUYEN H T.Understanding regulatory networks and engineering for enhanced drought tolerance in plants[J].Curr Opin Plant Biol,2006,9(2):189-195.
[7] CHEN S,GOLLOP N,HEUER B.Proteomic analysis of salt-stressed tomato(Solanum lycopersicum)seedlings:effect of genotype and exogenous application of glycinebetaine[J].J Exp Bot,2009,60(7):2005-2019.
[8] FOUGERE F,LE R D,STREETER J G.Effects of salt stress on amino acid,organic acid and carbohydrate composition of roots,bacteroids and cytosol of alfalfa(Medicago sativa L.) [J].Plant Physiol,1991,96(4):1228-1236.
[9] YOSHIBA Y,KIYOSUE T,NAKASHIMA K,et al.Regulation of levels of proline as an osmolyte in plants under water stress[J].Plant Cell Physiol,1997,38(10):1095-1102.
[10] SMIRNOFF N.Plant resistance to environmental stress[J].Current Opinion in Biotechnology,1998,9(2):214-219.
[11] JOUVE L,HOFFMANN L,FHAUSMAN J.Polyamine,carbohydrate,and proline content changes during salt stress exposure of aspen(Populus tremula L.):involvement of oxidation and osmoregulation metabolism[J].Plant Biol(Stuttg),2004,6(1):74-80.
[12]PETERSEN C R,HOLMSTRUP M,MALMENDAL A,et al.Slow desiccation improves dehydration tolerance and accumulation of compatible osmolytes in earthworm cocoons(Dendrobaena octaedra savigny)[J].J Exp Biol,2008,211(12):1903 -1910.
[13] HOQUE M A,BANU M N,OKUMA E,et al.Exogenous proline and glycinebetaine increase nacl-induced ascorbate-glutathione cycle enzyme activities,and proline improves salt tolerance more than glycinebetaine in tobacco bright yellow-2 suspension-cultured cells[J].J Plant Physiol,2007,164(11):1457 -1468.
[14] SOBAHAN M A,ARIAS C R,OKUMA E,et al.Exogenous proline and glycinebetaine suppress apoplastic flow to reduce Na(+)uptake in rice seedlings[J].Bioscience,Biotechnology and Biochemistry,2009,73(9):2037-2042.
[15] HARE P D,CRESS W A.Metabolic implications of stress-induced proline accumulation in plants[J].Plant Growth Regulation,1997,21(2):79-102.
[16] WIDOD O,PATTERSON J H,NEWBIGIN E,et al.Metabolic responses to salt stress of barley(Hordeum vulgare L.)cultivars,Sahara and Clipper,which differ in salinity tolerance[J].J Exp Bot,2009,60(14):4089-4103.
[17] SIVAKUMAR P,SHARMILA P,SARADHI P P.Proline suppresses rubisco activity in higher plants[J].Biochem Biophys Res Commun,1998,252(2):428-432.
[18] SERVAITES J C.Binding of a phosphorylated inhibitor to ribulose bisphosphate carboxylase oxygenase during the night[J].Plant Physiol,1985,78(4):839 - 843.
[19] SIVAKUMAR P,SHARMILA P.Proline alleviates saltstress-induced enhancement in ribulose-1,5-bisphosphate oxygenase activity[J].Biochem Biophys Res Commun,2000,279(2):512-515.
[20] ASADA K.Chloroplasts:formation of active oxygen and its scavenging[J].Methods in Enzymology,1984,105:422-429.
[21] CAKMAK I,HORST W J.Effect of aluminum on lipid peroxidation,superoxide dismutase,catalase and peroxides activities in root tips of soybean(Glycine max)[J].Plant Physiol,1991,83:463 -468.
[22] LI Q Y,NIU H B,YIN J,et al.Protective role of exogenous nitric oxide against oxidative-stress induced by salt stress in barley(Hordeum vulgare)[J].Colloids Surf B Biointerfaces,2008,65(2):220 -225.
[23] REZNICK A Z,PACKER L.Oxidative damage to proteins:spectrophotometric method for carbonyl assay[J].Methods in Enzymology,1994,233:357.
[24] SPREITZER R J,SALVUCCI M E.Rubisco:structure,regulatory interactions and possibilities for a better enzyme[J].Annu Rev Plant Biol,2002,53:449-475.
[25] SUGIYAMA T, MIZUNO M, HAYASHIM.Partitioning of nitrogen among ribulose-1,5-bisphosphate carboxylase/oxygenase,phosphoenolpyruvate carboxylase,and pyruvate orthophosphate dikinase as related to biomass productivity in maize seedlings[J].Plant Physiol,1984,75(3):665 -669.
[26] COEN D M,BEDBROOK J R,BOGORAD L,et al.Maize chloroplast DNA fragment encoding the large subunit of ribulose bisphosphate carboxylase[J].Proc Natl Acad Sci,1977,74:5487 -5491.
[27] JENSEN R G,BAHR J G.Ribulose-1,5-bisphosphate carboxylase-oxygenase[J].Annu Rev Plant Physiol,1977,28:379 -400.
[28] DEMIREVSKA-KEPOVA K,FELLER U.Heat sensitivity of rubisco,rubisco activase and rubisco binding protein in higher plants[J].Acta Physiologiae Plantarum,2004,26(1):103-114.
[29] HERRMANN B,FELLER U.CO2,light and temperature influence senescence and protein degradation in wheat leaf segments[J].Physiologia Plantarum,1998,103(3):320-326.
[30] MARTINEZ D E,COSTA M L,GUIAMET J J.Senescence-associated degradation of chloroplast proteins inside and outside the organelle[J].Plant Biol(Stuttg),2008,10:15-22.
[31]NAKANO R,ISHIDA H,MAKINO A,MAE T.In vivo rragmentation of the large subunit of ribulose-1,5-bisphosphate carboxylase by reactive oxygen species in an intact leaf of cucumber under chilling-light conditions[J].Plant Cell Physiol,2006,47(2):270 -276.
[32]GREGERSEN P L,HOLM P B,KRUPINSKA K.Leaf senescence and nutrient remobilisation in barley and wheat[J].Plant Biol(Stuttg),2008,10:37 -49.
[33] MEHTA R A,FAWCETT T W,PORATH D,et al.Oxidative stress causes rapid membrane translocation and in vivo degradation of ribulose-1,5-bisphosphate carboxylase/oxygenase[J].J Biol Chem,1992,267(4):2810-2816.
[34] DESIMONE M,HENKE A,WAGNER E.Oxidative stress induces partial degradation of the large subunit of ribulose-1,5-bisphosphate carboxylase/oxygenase in isolated chloroplasts of barley[J].Plant Physiol,1996,111:789-796.
[35] SHETTY K.Role of proline-linked pentose phosphate pathway in biosynthesis of plant phenolics for functional food and environmental applications:a review[J].Process Biochemistry,2004,39:789-804.
[36] JALEEL C A,MANIVANNAN P,LAKHMANAN G M,et al.NaCl as a physiological modulator of proline metabolism and antioxidant potential in phyllanthus amarus[J].C R Biol,2007,330(11):806 -813.
[37]HOQUE M A,OKUMA E,BANU M N,et al.Exogenous proline mitigates the detrimental effects of salt stress more than exogenous betaine by increasing antioxidant enzyme activities[J].J Plant Physiol,2007,164(5):553-561.
