大鼠颅骨成骨细胞和骨细胞的分离纯化与比较研究
2015-05-09谢艳芳陈克明马小妮石文贵
谢艳芳,陈克明,马小妮,石文贵,周 建
骨科基础研究
·论著·
大鼠颅骨成骨细胞和骨细胞的分离纯化与比较研究
谢艳芳,陈克明,马小妮,石文贵,周 建
目的 探讨大鼠颅骨中骨细胞和成骨细胞的分离纯化方法,并分别比较细胞形态、碱性磷酸酶(alkaline phosphatase, ALP)活性和成骨特异性蛋白的表达情况。方法 分别采用序列酶消化和EDTA螯合法,从SPF级新生SD大鼠的颅骨中分离培养骨细胞和成骨细胞,对其进行HE染色、Ⅰ型胶原免疫组化染色、骨钙素(BGP)免疫荧光染色;采用偶氮偶合法对两种细胞ALP进行染色,并检测其活性;应用蛋白质印迹(Western blot)检测两种细胞的Ⅰ型胶原和BGP的表达量。结果 细胞形态学观察及HE染色表明,骨细胞多呈星状或树枝状且有较多突触,而成骨细胞呈长梭形且突触较少;Ⅰ型胶原免疫组化染色与Western blot结果表明,Ⅰ型胶原在成骨细胞中表达量较高,呈棕黄色,骨细胞中表达量较低;而BGP免疫荧光染色与Western blot显示,成骨细胞中BGP表达较低,而在骨细胞中表达较高,细胞荧光染色与HE染色结果相似;ALP染色结果表明,ALP在成骨细胞中表达较高,骨细胞中表达较低;ALP活性检测与ALP染色结果相似。结论 采用序列酶消化及EDTA螯合法,可以从大鼠颅骨中分离得到较纯的骨细胞及成骨细胞,利用HE染色、免疫组化、免疫荧光染色、Western blot等技术,可以对骨细胞和成骨细胞进行分离纯化与研究。
骨细胞;成骨细胞;免疫组化;胶原Ⅰ型;骨钙素;大鼠, Sprague-Dawley
成骨细胞作为骨修复与骨重建的主要承担者,被认为是药物、电磁场等治疗骨质疏松症研究的基础[1]。然而最新研究表明,占骨组织 90%~95%的骨细胞才是骨代谢调节的“大脑”[2]。骨细胞是位于骨基质内矿化陷窝的一种高度分化细胞,研究表明,骨细胞不同于位于骨基质表面的成骨细胞,其主要任务不是合成骨基质和分泌矿物盐,而是感受来自体内血液及神经免疫系统的一系列信号,决定是否启动骨吸收或骨形成的关键细胞,因而在防治骨质疏松等骨代谢性疾病中占有比成骨细胞更重要的位置[3]。本课题组前期研究已证实,黄酮类化合物、超低频电磁场等都具有促进成骨细胞成熟矿化的能力[4],对于骨细胞,这些治疗方法是否同样有效,对于骨质疏松症治疗新途径的开发具有重要意义。然而由于目前可供体外实验研究的骨细胞系较少,并且有效稳定的骨细胞分离方法尚不十分明确[5]。因此,本研究旨在建立完善的从大鼠颅骨中分离纯化骨细胞和成骨细胞的方法,并从细胞形态、碱性磷酸酶(ALP)活性和成骨特异性蛋白的表达等对二者进行比较研究,为今后黄酮类化合物、超低频电磁场等治疗骨质疏松症的机制研究提供帮助。
1 材料与方法
1.1 实验动物与试剂 SPF级新生SD大鼠10只,购自甘肃中医学院SPF级动物实验中心,许可证号:SCXK(甘) 2004-0006-152;α-MEM培养基(Gibco, USA);胎牛血清FBS(HyClone);新生牛血清CS(PAA)胰蛋白酶、Ⅰ型胶原酶、Ⅱ型胶原酶(Sigma公司);ALP测定试剂盒(南京建成生物工程研究所);免疫组化染色试剂盒(北京博奥森);DAB显色试剂盒(中杉金桥);Ⅰ型胶原(Collagen-Ⅰ)、骨钙素(BGP)一抗购自abcam公司;辣根过氧化物酶标记的二抗(北京中杉金桥公司);BCA蛋白定量试剂盒;FITC标记的免疫荧光二抗(KPL公司),伊红、苏木素(上海源叶公司)。
1.2 仪器 正置荧光显微镜(OLYMPUS, Japan),CO2细胞培养箱(Thermo Revco,USA),倒置相差显微镜(OLYMPUS, Japan),台式高速冷冻离心机(Heraeus, German),紫外分光光度计(Bio-Rad公司),数码凝胶图像分析仪(bio-Tanon),电泳仪、电转移仪和酶标仪均为Bio-Rad公司产品。
1.3 实验方法
1.3.1 成骨细胞的分离培养:将乳鼠置于75%乙醇中浸泡处死,在无菌条件下取其颅骨并去除骨膜及结缔组织,磷酸盐缓冲液(PBS)(pH=7.8)清洗3次;将骨片剪碎(大小约1 mm×1 mm×1 mm),转移至培养瓶中,0.25%胰酶消化2次(37℃,每次10 min),弃上清液,0.1%的Ⅱ型胶原酶消化10 min,弃上清;再用0.1%的Ⅱ型胶原酶消化4次( 37℃,每次20 min),收集合并上清液,加入5 ml含血清的培养基中止酶消化,150目滤网过滤3次,1000 r/min离心10 min; 弃上清,加入培养基(α-MEM培养基,内含10% FBS,青霉素、链霉素各100 U/ml),吹打均匀并计数。原代细胞悬液以3×105个/ml接种于大皿中培养,每皿10 ml,37℃、5%CO2和饱和湿度条件下培养,每3 d换液1次,培养至细胞铺满80%皿底后,胰蛋白酶消化传代(标记为P1 代),此为成骨细胞的分离培养方法。
1.3.2 骨细胞的分离培养:骨细胞的序列消化分离、培养及传代,主要参考Lee等[6]分离方法,经过改进,具体分离、培养和传代步骤如下:将分离成骨细胞时消化剩余的骨碎片弃去上清液后,PBS清洗骨片3次,用0.02% EDTA溶液(含0.1%的小牛血清白蛋白)第6次消化骨片,弃去上清液,PBS清洗骨片3次。紧接着用0.1%的Ⅰ型胶原酶消化第7次(37℃,每次20 min),收集上清到新的培养瓶中,并加入5 ml含血清的培养基中止酶消化。交替利用0.02% EDTA溶液和0.1%的Ⅰ型胶原酶化第8次和第9次,收集并合并上清液,每次交替都用PBS溶液清洗骨片3次。将上清150目滤网过滤3次,1000 r/min离心10 min后弃上清,加入培养基(α-MEM培养基,内含5%胎牛血清和5%的小牛血清,青霉素、链霉素各100 U/ml),吹打均匀并计数。原代细胞悬液以3×105个/ml接种于Ⅰ型胶原酶包裹的10 cm大皿中,37℃、5%CO2和饱和湿度条件下培养,每3天更换1次培养基,至细胞铺满80%皿底后胰蛋白酶消化传代。
1.3.3 HE染色:将P1代细胞进行爬片培养,3 d后取出爬片并用PBS漂洗3次,4%的多聚甲醛固定10 min,PBS漂洗3次后用0.1% TritonX-100透膜20 min,PBS漂洗3次。向爬片滴加1 ml苏木素染液进行初染,10 min后流水冲洗,滴加盐酸乙醇封化液封化1 s,将爬片立刻放入流水冲洗15 min。再加入1 ml伊红染液进行复染,5 min后依次经过低浓度到高浓度的乙醇溶液进行脱水,每次2 min,最后将爬片浸泡于二甲苯溶液中2 min后封片。正置荧光显微镜进行形态学观察。
1.3.4 Ⅰ型胶原的免疫组化染色:将P1代细胞进行爬片培养,3 d后取出爬片并用PBS漂洗3次,4%的多聚甲醛固定10 min,PBS漂洗3次后用0.5% Triton-X100透膜20 min,PBS漂洗3次后滴加3% 过氧化氢并37℃孵育15~20 min,已消除内源性过氧化物酶。PBS漂洗3次后滴加山羊血清工作液并37℃孵育,15~20 min后倾去勿洗,滴加Ⅰ型胶原抗体(1∶500)并4℃过夜,PBS漂洗3次,每次3 min,之后滴加相应的二抗工作液,37℃孵育60 min,PBS漂洗3次每次3 min,最后利用DAB显色剂进行显色,流水冲洗后封片,正置荧光显微镜观察两种细胞的形态。
1.3.5 骨钙素(BGP)免疫荧光染色:将P1代细胞进行爬片培养,3 d后取出爬片并用PBS漂洗3次,4%的多聚甲醛固定10 min,PBS漂洗3次后用0.5% Triton-X100透膜20 min,PBS漂洗3次后滴加山羊血清工作液并37℃孵育,15~20 min后倾去勿洗,滴加BPG抗体(1∶500)并4℃过夜,PBS漂洗3次每次3 min,之后滴加FITC标记的免疫荧光二抗并37℃避光孵育。60 min后PBS漂洗3次,每次3 min。封片后置于正置荧光显微镜下,488 nm波长的激发下进行比较观察。
1.3.6 ALP的偶氮偶合法染色:将P1代细胞进行爬片培养,3 d后取出爬片并用PBS漂洗3次,4%的多聚甲醛固定30 s,PBS漂洗3次,后转入基质液(20 ml,pH=8.9的巴比妥钠-HCL缓冲液中含α-萘基磷酸钠和固蓝RR盐各20 mg)中反应15 min,当出现黄褐色斑点时弃去基质液,PBS液冲洗3次后封片,置于正置荧光显微镜下进行比较观察。
1.3.7 ALP活性测定:将两种原代细胞以5×104个/孔接种于6孔板,每3天更换一次培养基,6 d后测定ALP活性,具体方法如下:弃培养液,PBS洗3次,每孔加入缓冲液和基质液各0.3 ml混匀,37℃水浴15 min后,加入0.9 ml显色液,520 nm测定酚标准及样本吸光值,根据公式换算为金氏单位。
1.3.8 蛋白质印迹(Western blot)分析:将两种P1细胞分别以5×104个/ml接种于中皿,3 d后提取总蛋白,利用Western blot检测骨细胞和成骨细胞中Ⅰ型胶原的表达量。具体方法如下:将贴壁细胞4℃预冷的PBS漂洗2遍后,加入500 μl的细胞裂解液(50 mmol/L Tris-HCl、pH=8.0、150 mmol/L NaCl、100 mg/L PMSF、1 mg/L抑蛋白酶肽、1%吐温-20、0.5%去氧胆酸钠、1% SDS)于冰上静置30 min使细胞充分裂解。4℃ 12 000 r/min离心15 min,取上清,用BCA法进行总蛋白浓度的测定。95℃变性4 min,各组取含20 μg蛋白质样品,经12% SDS-PAGE分离后,将蛋白质转移至聚偏氟乙烯(PVDF)膜上,5%脱脂奶粉室温下摇床振荡封闭2 h,然后分别加入Ⅰ型胶原一抗(1:1 000稀释),4℃过夜。次日加入辣根过氧化物酶标记的二抗(1:10 000稀释) 37℃孵育2 h,每进行下一步实验前PVDF膜均用4℃预冷的TBST摇床漂洗4次,每次8 min,用增强化学发光法检测目的蛋白,X光片的曝光时间视实验效果而定,灰度值使用Image-Pro plus 6.0软件扫描测定。

2 结果
2.1 成骨细胞与骨细胞的形态学结果 光学显微镜下成骨细胞形态多呈梭形或成纤维细胞样形态,骨细胞则形态较丰满,有多个突触结构,呈星状或树枝状,细胞间通过突触互相连接;经HE染色后可见成骨细胞和骨细胞在形态方面存在明显差别,成骨细胞呈长梭形,而骨细胞因有较多突触而呈放射状,细胞间几乎没有突触连接,而骨细胞呈放射状,并通过大量的树突结构相互连接,见图1。
2.2 Ⅰ型胶原免疫组化染色结果 成骨细胞Ⅰ型胶原表达量较高呈深棕黄色,而骨细胞中Ⅰ型胶原的表达量明显较低,呈浅棕色,见图2。

图1 成骨细胞和骨细胞的形态学观察
A.光学显微镜下成骨细胞(×20);B.光学显微镜下骨细胞(×20);C.成骨细胞HE染色(×40);D.骨细胞HE染色(×40)
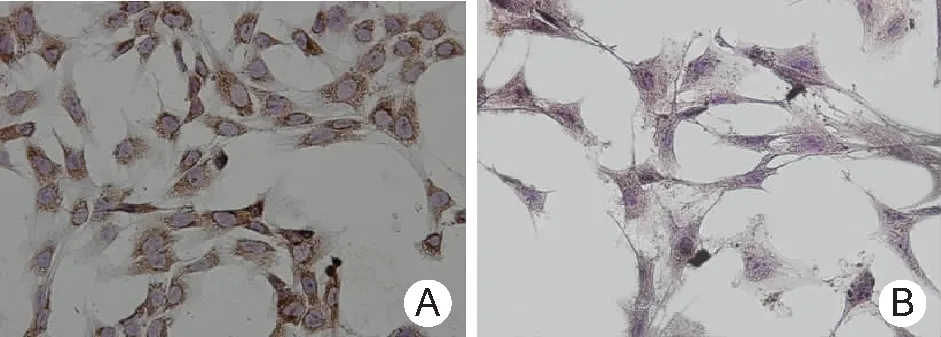
图2 成骨细胞和骨细胞中Ⅰ型胶原免疫组化染色结果(DAB×40)
A.成骨细胞;B.骨细胞
2.3 BGP免疫荧光染色结果 BGP在成骨细胞中表达较低,在骨细胞中表达较高,细胞形态与HE染色结果相似,见图3。
2.4 ALP免疫组化染色结果 ALP免疫组化染色结果呈棕黄色,由染色结果可见,成骨细胞的ALP活性显著高于骨细胞,见图4,此结果与Van der Plas等[7]报道相同。
2.5 ALP活性检测结果 骨细胞ALP活性低于成骨细胞,差异有统计学意义(P<0.01),见表1。

图3 成骨细胞和骨细胞中骨钙素免疫荧光染色结果(×40)
A.成骨细胞;B.骨细胞

图4 成骨细胞和骨细胞中碱性磷酸酶免疫组化结果(偶氮偶合染色×20)
A.成骨细胞;B.骨细胞
2.6 BGP和Ⅰ型胶原定量分析 使用Image-Pro plus 6.0软件分别对成骨细胞和骨细胞的BGP分泌量和Ⅰ型胶原分泌量灰度值进行扫描测定得知,在骨细胞中BGP相对光密度值明显高于成骨细胞,而成骨细胞中Ⅰ型胶原的相对光密度值明显高于骨细胞,见表2。Western blot检测结果表明,成骨细胞中BGP表达低于骨细胞,而成骨细胞Ⅰ型胶原表达量高于骨细胞(P<0.01),见图5。

表1 成骨细胞与骨细胞内碱性磷酸酶检测结果
注:D(λ)520为吸光值;bP<0.01

表2 成骨细胞与骨细胞中骨钙素与Ⅰ型胶原相对光密度值比较
注:bP<0.01

A B
图5 成骨细胞和骨细胞中骨钙素与Ⅰ型胶原蛋白质印迹检测结果
3 讨论
骨质疏松是一种老年人易发的疾病,研究表明,外力作用于骨细胞会影响骨组织的形态及密度,在骨质疏松中缺乏机械刺激和骨密度降低密切相关[8]。成骨细胞作为骨细胞的前体,在骨重建中发挥着重要作用,多年来对骨代谢的研究多以成骨细胞为基础[9],而忽略了对骨细胞的深入研究。目前对于骨细胞研究主要集中于以下几方面:①骨细胞是矿化骨基质中的唯一细胞,其不仅是骨的结构成分,并可作为内分泌细胞来调节成骨细胞和破骨细胞的活性[10],调节着骨骼的塑形过程。②骨细胞作为力的感应细胞,可以感受多种外界机械性信号[11]。③骨细胞是如何将外界机械性信号转变为内在化学信号的,如物理刺激后骨细胞内前列腺素(PEG2)、环腺苷酸(cAMP)和一氧化氮(NO)等含量的改变[12-13]。
在骨骼转化的过程中,由于成骨细胞和破骨细胞的数量较少且分布在骨组织表面。而骨细胞的数量占到骨组织细胞数量的95%,并且在成熟的骨组织内。因此骨细胞在时间和空间上会发出指令决定进行补充哪种细胞,是进行破骨细胞的吸收还是进行成骨细胞的骨形成过程[14],骨细胞均匀分布在矿化的骨基质中并形成了相互交联的细胞网络,当骨组织受力后会导致骨陷窝-微管网络内的细胞间质液流动,从而对骨细胞产生一种力学信号[15-16]。近期研究表明骨细胞有传递应力的作用,因此可以作为外界应力的感应器。外界流体刺激骨细胞可释放PEG2,还可产生较高的NO[17-18],NO具有影响破骨细胞的形成和活性的功能,从而降低骨吸收能力[19]。此外,还有cAMP、类胰岛素生长因子1、钙离子、三磷酸腺苷等也可能会参与。但是目前对于骨细胞受外界刺激产生哪种特异生物化学信号及骨细胞受力的主要作用机制还不太明确,以及骨细胞是如何将这些力学刺激在细胞中转化为化学信号并传递到其他细胞中去的。对于上述问题的研究,需要我们分离出较纯的骨细胞。大鼠成骨细胞的分离技术目前已比较成熟[20],在此基础上,本文建了稳定地从大鼠颅骨中分离骨细胞和成骨细胞的方法。
成骨细胞向骨细胞成熟矿化的过程中,会伴有一些标志性指标的改变,这就为我们对骨细胞的研究提供了基础[21-22],如ALP是骨形成过程的早期产物,其表达增加说明骨形成处于活跃期,但随着成骨细胞向骨细胞转变,ALP活性下降。这种标志性蛋白还有BGP、Ⅰ型胶原、牙本质基质蛋白1[23]等,本研究利用免疫组化染色、免疫荧光化学染色和Western blot等方法对这些指标进行检测,结果表明成骨细胞和骨细胞中ALP、BGP、Ⅰ型胶原的表达存在明显差异,可以作为今后骨细胞鉴定的成熟指标。
前期我们以成骨细胞为研究基础,发现黄酮类化合物及电磁场等都能显著促进成骨细胞的成熟矿化,为抗骨质疏松症新方法的研究做出了贡献,而骨细胞作为骨代谢的调控者,为我们对黄酮类化合物以及电磁场的抗骨质疏松症的研究开辟了新途径。
[1] Zhou J, Ming L G, Ge B F,etal. Effects of 50 Hz sinusoidal electromagnetic fields of different intensities on proliferation, differentiation and mineralization potentials of rat osteoblasts[J].Bone, 2011,49(4):753-761.
[2] Neve A, Corrado A, Cantatore F P. Osteocytes: central conductors of bone biology in normal and pathological conditions[J].Acta Physiol (Oxf), 2012,204(3):317-330.
[3] Paic F, Igwe J C, Nori R,etal. Identification of differentially expressed genes between osteoblasts and osteocytes[J].Bone, 2009,45(4):682-692.
[4] 周建,陈克明,葛宝丰,等.不同强度正弦交变磁场对体外培养成骨细胞增殖与分化影响[J].中国骨质疏松杂志,2010,16(7):469-472.
[5] 孙联文,杨肖,张恺,等.骨细胞的体外分离培养及鉴定[J].中国骨质疏松杂志,2009,15(9):629-631.
[6] Lee K L, Hoey D A, Spasic M,etal. Adenylyl cyclase 6 mediates loading-induced bone adaptation in vivo[J].FASEB J, 2014,28(3):1157-1165.
[7] van der Plas A, Aarden E M, Feijen J H,etal. Characteristics and properties of osteocytes in culture[J].J Bone Miner Res, 1994,9(11):1697-1704.
[8] Bonewald L F, Johnson M L. Osteocytes, mechanosensing and Wnt signaling[J].Bone, 2008,42(4):606-615.
[9] Roforth M M, Fujita K, McGregor U I,etal. Effects of age on bone mRNA levels of sclerostin and other genes relevant to bone metabolism in humans[J].Bone, 2014,59:1-6.
[10]Bonewald L F. The amazing osteocyte[J]. J Bone Miner Res, 2011,26(2):229-238.
[11]谷国良.骨细胞的功能:生物学研究和机理探讨[J].中华骨质疏松和骨矿盐疾病杂志,2009,2(1):1-12.
[12]Whitfield J F. The solitary (primary) cilium-a mechanosensory toggle switch in bone and cartilage cells[J]. Cell Signal, 2008,20(6):1019-1024.
[13]Kwon R Y, Temiyasathit S, Tummala P,etal. Primary cilium-dependent mechanosensing is mediated by adenylyl cyclase 6 and cyclic AMP in bone cells[J].FASEB J, 2010,24(8):2859-2868.
[14]MacDougall M, Gu T T, Luan X,etal. Identification of a novel isoform of mouse dentin matrix protein 1: spatial expression in mineralized tissues[J].J Bone Miner Res, 1998,13(3):422-431.
[15]Gu G, Nars M, Hentunen T A,etal. Isolated primary osteocytes express functional gap junctions in vitro[J].Cell Tissue Res, 2006,323(2):263-271.
[16]Cheng B, Zhao S, Luo J,etal. Expression of functional gap junctions and regulation by fluid flow in osteocyte-like MLO-Y4 cells[J].J Bone Miner Res, 2001,16(2):249-259.
[17]Petersen D N, Tkalcevic G T, Mansolf A L,etal. Identification of osteoblast/osteocyte factor 45 (OF45), a bone-specific cDNA encoding an RGD-containing protein that is highly expressed in osteoblasts and osteocytes[J].J Biol Chem, 2000,275(46):36172-36180.
[18]Yoshiko Y, Wang H, Minamizaki T,etal. Mineralized tissue cells are a principal source of FGF23[J].Bone, 2007,40(6):1565-1573.
[19]Frost H M. Measurement of human bone formation by means of tetracycline labelling[J].Can J Biochem Physiol, 1963,41:31-42.
[20]明磊国,陈克明,葛宝丰,等.淫羊藿苷与染料木黄酮对体外培养成骨细胞增殖及矿化成熟影响的对比研究[J].中国中药杂志,2011,36(16):2240-2245.
[21]Ma H P, Ming L G, Ge B F,etal. Icariin is more potent than genistein in promoting osteoblast differentiation and mineralization in vitro[J].J Cell Biochem, 2011,112(3):916-923.
[22]吴胜东,葛建军,鲍峰,等.犬骨髓间充质干细胞的分离、培养、纯化及鉴定[J].武警医学院学报,2009,18(1):15-19,封2.
[23]Stern A R, Stern M M, Van Dyke M E,etal. Isolation and culture of primary osteocytes from the long bones of skeletally mature and aged mice[J].Biotechniques, 2012,52(6):361-373.
Isolation and Identification and Comparative Study of Calvarial Osteoblasts and Osteocytes of Rats
XIE Yan-fang, CHEN Ke-ming, MA Xiao-ni, SHI Wen-gui, ZHOU Jian
(Osteology Institution, Lanzhou General Hospital of Lanzhou Military Area Command, Lanzhou 730050, China)
Objective To discuss methods of isolation and purity of rats' calvarial osteoblasts and osteocytes, and to respectively compare the cellular morphous, the activity of alkaline phosphatase (ALP) and the expression of osteoblast specific protein. Methods Osteoblasts and osteocytes were isolated from skull tissues of neonatal SD rats using sequential collagenase and ethylene diamine tetraacetic acid (EDTA) digestion. The cells were identified with hematoxylin and eosin (HE), immunohistochemistry of collagen Ι and immunofluorescence of osteocalcin (BGP) staining. ALP of the two kinds of cells were stained using azo and coupling method, and the activity was detected. Expressions of collagen Ι and BGP of the two kinds of cells were examined by Western blotting. Results The cell morphology after HE staining showed that osteocytes were star-shaped or dendrite-shaped within more dendrites, while osteoblasts were spindle-shaped with less dendrites. Immunohistochemistry staining and Western blotting showed that BGP expression was low in osteoblasts, while the expression was high in osteocytes. The results of fluorescence and HE staining were similar. ALP staining showed that osteoblast had a high expression in osteoblasts, and a low expression in osteocytes. The results of activity detection and staining of ALP were similar. Conclusion The pure calvarial osteocytes and osteoblasts in rats can be isolated by sequential collagenase and EDTA digestion. Osteocytes and osteoblasts may be identified, purified and studied using methods of HE, immunohistochemistry and immunofluorescence staining and Western blotting.
Osteocytes; Osteoblasts; Immunohistochemistry; Collagen Ι; Osteocalcin; Rats, Sprague-Dawley
国家自然科学基金(81270963,81471090)
730050 兰州,兰州军区兰州总医院骨科研究所
陈克明,E-mail:chenkm@lut.cn
R329.2
A
2095-140X(2015)03-0001-05
10.3969/j.issn.2095-140X.2015.03.001
2014-08-15 修回时间:2014-11-28)
