肉鸡屠宰生产链中沙门氏菌耐药基因检测与耐药相关性分析
2015-05-08赖海梅邹立扣刘书亮韩新锋罗佩文夏小龙李建龙
赖海梅,邹立扣,刘书亮,2,*,韩新锋,2,周 康,2,罗佩文,夏小龙,李建龙
(1.四川农业大学食品学院,四川雅安 625014;2.四川省农产品加工及贮藏工程重点实验室,四川雅安 625014;3. 四川农业大学都江堰校区微生物学实验室,四川都江堰 611830)
肉鸡屠宰生产链中沙门氏菌耐药基因检测与耐药相关性分析
赖海梅1,邹立扣3,刘书亮1,2,*,韩新锋1,2,周 康1,2,罗佩文1,夏小龙1,李建龙1
(1.四川农业大学食品学院,四川雅安 625014;2.四川省农产品加工及贮藏工程重点实验室,四川雅安 625014;3. 四川农业大学都江堰校区微生物学实验室,四川都江堰 611830)
目的:了解肉鸡屠宰生产链沙门氏菌耐药性与耐药基因的相关性。方法:采用纸片扩散法对肉鸡屠宰生产链分离鉴定的72株沙门氏菌进行10种抗生素敏感性实验;采用PCR方法检测耐药沙门氏菌相应的耐药基因。结果:72株肉鸡屠宰生产链中沙门氏菌对萘啶酸(100%)的耐药率最高;对氨苄西林、甲氧苄啶/磺胺甲恶唑、环丙沙星、四环素、庆大霉素耐药率分别为69.44%、54.17%、38.89%、34.72%、13.89%。72株沙门氏菌中有67株至少含有一种耐药基因,blaTEM、blaCMY-2、sul2、sul3、tetB和tetC耐药基因较为普遍,其耐药菌blaTEM、blaCMY-2、sul2、sul3、tetB和tetC基因检出率分别为96.08%、100%、94.87%、71.79%、78.38%和100%。结论:沙门氏菌对常见抗生素具有不同程度的耐药性,且耐药基因普遍存在于耐药菌株中,药敏实验结果与耐药基因检测结果有很高的一致性(≥75%)。
肉鸡屠宰生产链,沙门氏菌,敏感性实验,耐药基因

表1 PCR扩增引物
沙门氏菌是肠杆菌科中最重要的病原菌之一,该菌呈全球性分布,绝大多数沙门氏菌可通过食品污染危害人类健康。随着抗生素在畜禽养殖业的广泛应用,沙门氏菌对常见抗生素和常规剂量的抗生素产生耐药性甚至多重耐药性,给兽医临床诊断和治疗带来了极大危害。许多编码耐药性的基因可在动物和人类病原菌间水平传播,危害养殖业和人类健康[1-2]。目前,各类抗生素耐药机制较为复杂且已知的耐药基因都有几种至几十种[3-4]。国内外对畜禽沙门氏菌耐药性及耐药基因研究报道逐渐增多,但对肉鸡屠宰生产链沙门氏菌耐药基因的检测情况不多,且沙门氏菌耐药基因检出情况在不同年份和不同地区均存在一定差异[5-10]。本实验对肉鸡屠宰生产链沙门氏菌进行了耐药性分析,并设计了11对耐药基因引物,检测沙门氏菌耐药基因携带情况,为研究肉鸡屠宰生产链沙门氏菌耐药性与耐药基因的关系提供参考,也为控制肉鸡屠宰生产链沙门氏菌的耐药性提供基础数据。
1 材料与方法
1.1 材料与仪器
沙门氏菌 均分离于某肉鸡屠宰场(粪样31株,屠宰场生产环节肉鸡胴体表面12株,分割鸡肉产品29株);质控菌株:大肠杆菌ATCC25922和大肠杆菌ATCC35218 四川农业大学食品学院四川省农产品加工及贮藏工程重点实验室保存;DNA Marker DL2000、琼脂糖、2×PCR mix等 购于宝生物(大连)有限公司;培养基M-H琼脂、M-H肉汤 购自青岛高科园海博生物技术有限公司;青霉素类:氨苄西林(AMP,10μg/片)、阿莫西林/克拉维酸(AMC,20/10μg/片);头孢类:头孢曲松(CRO,30μg/片),氨基糖苷类:庆大霉素(CN,10μg/片)、大观霉素(SH,100μg/片),四环素类:四环素(TET,30μg/片),氯霉素类:氟苯尼考(FLO,75μg/片),磺胺类:甲氧苄啶/磺胺甲噁唑(SXT,1.25/23.75μg/片),喹诺酮类:萘啶酸(NAL,30μg/片)、环丙沙星(CIP,5μg/片) 均购自赛默飞世尔生物化学(北京)有限公司。
DHP-9162 恒温培养箱 上海一恒科技有限公司;BSC-1300ⅡA2 型生物安全柜 苏州安泰空气技术有限公司;SORVALL 离心机 美国科俊仪器有限公司;Milli-Q超纯水系统 Millipore公司;C1000 Thermal Cycler PCR仪、PowerPac Basic电泳仪、水平电泳槽、凝胶成像系统 Bio-RAD。
1.2 实验方法
1.2.1 药敏实验 以大肠杆菌ATCC25922和大肠杆菌ATCC35218为质控菌株,采用纸片扩散法测定72株沙门氏菌对以上10种抗菌药敏感性实验。具体方法及判断标准参考美国临床实验室标准化协会(CLSI 2010)手册的纸片扩散法[11]。耐药率计算:耐药率(%)=(耐药菌株数/菌株总数)×100。
1.2.2 沙门氏菌耐药基因的PCR检测 根据药敏实验结果判断耐药表型,以耐药菌作为实验菌株。
菌株CEH-ST79的发酵液对马铃薯干腐病的活体试验结果显示(表3),菌株CEH-ST79发酵液可明显抑制马铃薯干腐病病原菌。其中,发酵液对病原菌65B-2-6具有高抑制活性,抑制率为73.83%,病斑深度为0.51 cm,坏果率为37%;对病原菌青9A-5-2具有中等的抑制活性,抑制率为50.19%,病斑深度为1.22 cm,坏果率为56%;对病原菌青9A-4-13具有弱的抑制活性,抑制率为28.13%,病斑深度为1.67 cm,坏果率为100%。
1.2.2.1 模板的制备 采用热裂解法[12-13]提取沙门氏菌DNA,取1.5mL培养18~24h的沙门氏菌培养液,12000r/min离心2min,沉淀用1mL灭菌超纯水反复洗两次,12000r/min离心2min,沉淀加100μL 1×TE(pH8.0)溶液重悬细胞,100℃水浴10min,再置于冰水浴5min,12000r/min离心2min,上清液即为PCR模板,-20℃保存备用。
1.2.2.2 PCR反应 根据Genbank和文献[14-19]设计11对引物(表1),分别扩增β-内酰胺类耐药基因、氨基糖苷类耐药基因、四环素耐药基因、氟苯尼考耐药基因和磺胺类耐药基因。PCR扩增条件:94℃ 10min;94℃ 40s,55~72℃ 1min,72℃ 40s,30个循环;72℃ 10min。4℃保存。随机选取沙门氏菌菌株PCR产物送上海英俊生物技术有限公司克隆测序。
2 结果与分析
2.1 肉鸡屠宰生产链中沙门氏菌耐药性
采用纸片扩散法检测72株沙门氏菌对10种抗生素的敏感性。结果表明,沙门氏菌对萘啶酸的耐药率最高,耐药率达100%;对氨苄西林、磺胺甲恶唑、四环素、环丙沙星耐药率较高,分别为69.44%、54.17%、51.39%、38.89%;对庆大霉素、阿莫西林/克拉维酸、头孢曲松、氟苯尼考和大观霉素耐药率较低(图1)。肉鸡屠宰生产链不同环节沙门氏菌耐药性差异较大(图2)。屠宰加工生产链各环节沙门氏菌仅有分割鸡肉产品对头孢曲松表现出较低的耐药率,鸡粪和屠宰加工生产环节肉鸡胴体表面分离的沙门氏菌均对头孢曲松敏感;鸡粪和分割鸡肉产品沙门氏菌对氟苯尼考、庆大霉素和大观霉素表现出较低的耐药率,屠宰加工生产环节肉鸡胴体表面的沙门氏菌对氟苯尼考、庆大霉素和大观霉素均敏感;屠宰加工生产链各环节沙门氏菌对氨苄西林和环丙沙星耐药的耐药率较高,且耐药率表现为分割鸡肉产品>鸡粪>屠宰生产环节肉鸡胴体表面;屠宰加工生产链各环节沙门氏菌对四环素耐药率较高,对阿莫西林/克拉维酸耐药率较低,且耐药率均表现为分割鸡肉产品>屠宰生产环节肉鸡胴体表面>鸡粪;屠宰加工生产链各环节沙门氏菌对萘啶酸耐药率均高达100%。
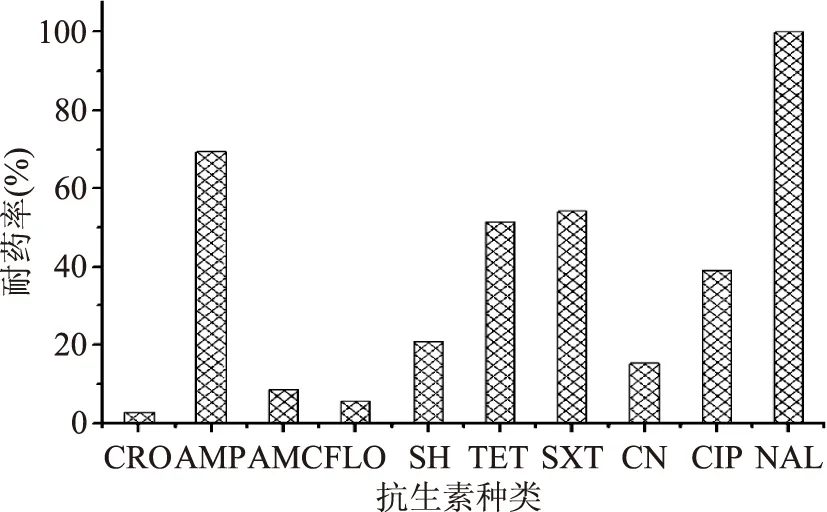
图1 肉鸡屠宰生产链中沙门氏菌对10种抗生素的耐药率(n=72)Fig.1 Resistance rate of Salmonella 10 antimicrobials from broiler slaughterhouse production chain(n=72)

图2 肉鸡屠宰生产链不同环节沙门氏菌耐药性Fig.2 Drug resistance of Salmonella from different broiler slaughterhouse production chain
2.2 β-内酰胺类耐药基因的流行
51株对头孢曲松或氨苄西林或阿莫西林/克拉维酸耐药的沙门氏菌中,50株同时扩增到blaTEM和blaCMY-2基因,有1株只扩增到blaTEM基因,表型耐药与耐药基因100%符合。其中,21株鸡粪沙门氏菌同时扩增到blaTEM和blaCMY-2基因;6株屠宰生产环节肉鸡胴体表面沙门氏菌同时扩增到blaTEM和blaCMY-2基因;24株分割鸡肉产品沙门氏菌,有23株扩增到blaTEM和blaCMY-2基因,只有1株扩增到blaTEM基因(见表2)。
2.3 磺胺类耐药基因的流行
39株对甲氧苄啶/磺胺甲噁唑耐药的沙门氏菌中,有36株扩增到sul1或sul2或sul3基因,有3株未扩增到sul1或sul2或sul3基因,耐药表型与耐药基因型符合率为92%。其中,15株鸡粪沙门氏菌中,有3株扩增到sul2基因,6株同时扩增到sul2和sul3基因,6株同时扩增到sul1、sul2和sul3基因;9株屠宰生产环节肉鸡胴体表面沙门氏菌中,有7株扩增到sul1或sul2或sul3基因,1株扩增到sul2和sul3基因,6株同时扩增到sul1、sul2和sul3基因;15株分割鸡肉产品沙门氏菌中,有1株扩增到sul2基因,5株扩增到sul1和sul2基因,5株扩增到sul2和sul3基因,3株扩增到sul1、sul2和sul3基因(见表2)。
2.4 四环素耐药基因的流行
37株对四环素耐药的沙门氏菌中,有33株扩增到tetA或tetB或tetC基因,表型耐药与耐药基因符合率为89.2%。其中,15株鸡粪沙门氏菌中,5株仅扩增到tetC基因,1株仅扩增到tetB基因,3株同时扩增到tetB和tetC基因;6株对屠宰生产环节肉鸡胴体表面沙门氏菌全部同时扩增到tetA、tetB和tetC基因;22株分割鸡肉产品沙门氏菌中,1株仅扩增到tetC基因,1株仅扩增到tetB基因,1株扩增到tetA和tetB基因,7株同时扩增到tetB和tetC基因,8株同时扩增到tetA、tetB和tetC基因(见表2)。
2.5 氟苯尼考耐药基因的流行
4株对氟苯尼考耐药的沙门氏菌中,有3株扩增到flor基因,表型耐药与耐药基因符合率为75%。其中,1株鸡粪沙门氏菌扩增到flor基因;2株分割鸡肉产品沙门氏菌扩增到flor基因,1株分割鸡肉产品未扩增到flor基因(见表2)。

表2 沙门氏菌分离菌株耐药基因检测情况
2.6 庆大霉素耐药基因的流行
10株对庆大霉素耐药的沙门氏菌,有8株扩增到aac(3)-Ⅱ或aac(3)-Ⅳ基因,耐药表型与耐药基因80%符合。其中,2株鸡粪沙门氏菌中,只有1株扩增到aac(3)-Ⅱ基因;7株分割鸡肉产品沙门氏菌中,有1株扩增到aac(3)-Ⅱ基因,6株同时扩增到aac(3)-Ⅱ和aac(3)-Ⅳ基因(见表2)。
3 讨论
3.1 沙门氏菌对抗生素的耐药性
近年来,随着抗生素的滥用,世界各地报道沙门氏菌耐药性越来越强,耐药谱不断扩大。本实验对72株沙门氏菌的耐药性检测显示,沙门氏菌分离株对萘啶酸、氨苄西林、磺胺甲恶唑、四环素、环丙沙星耐药率较高,表明该肉鸡屠宰生产链中沙门氏菌耐药性不容乐观。这与Mąka等[19],杨保伟等[20]结果相似,肉鸡养殖场应停止该类药物的使用,可选择性使用大观霉素和庆大霉素,并建议使用阿莫西林/克拉维酸、头孢曲松、氟苯尼考。本实验中,沙门氏菌对萘啶酸耐药率最高,这可能与肉鸡养殖过程中相应抗生素的滥用有关。朱恒文等[21]、张玮等[6]均表明沙门氏菌对抗生素的耐药性最强与相应抗生素的大量使用有关。同时,相关研究表明[22-23],细菌耐药性的产生反映了畜禽养殖中抗生素的盲目使用。
本实验中,肉鸡屠宰生产链中沙门氏菌对10种抗生素耐药性存在较大差异,不存在耐药率沿生产链降低的趋势,沙门氏菌对四环素和阿莫西林/克拉维酸的耐药率沿肉鸡屠宰生产链有所升高。侯小刚等[24]对四川主要肉品生产链中沙门氏菌的分离鉴定、耐药性分析及PFGE分析表明,猪肉和鸭肉生产链中沙门氏菌对萘啶酸、环丙沙星、氨苄西林、阿莫西林/克拉维酸、氟苯尼考、庆大霉素的耐药率从养殖场到市场都有不同程度的降低,而对甲氧苄啶/磺胺甲噁唑的耐药率有所上升,表明猪肉和鸭肉生产链中沙门氏菌对抗生素耐药率不存在沿生产链降低的趋势。
3.2 沙门氏菌耐药基因流行
本实验对5类抗生素表型耐药的沙门氏菌携带相应耐药基因的检测结果表明,总体上耐药基因与耐药表型的检测结果基本一致,但在本实验中有2株磺胺类、1株氟苯尼考和2株庆大霉素耐药菌株中,均未检测到相应的耐药基因,可能是携带其他耐药基因或存在其他耐药机制。赵玉林等[25]对鸡源多重耐药沙门氏菌耐药基因的检测,blaTEM-1、tetA和tetB基因检出率最高,且耐药表型与耐药基因检测结果基本一致。廖成水等[26]对鸡源性致病性沙门氏菌新近分离株的耐药性与耐药基因研究中,有部分耐药菌株未能检测到相应的耐药基因,推测其可能是因为该菌株含有其他耐药基因或存在其他耐药机制。本实验中,72株肉鸡屠宰生产链中沙门氏菌,β-内酰胺类耐药基因blaTEM和blaCMY-2;磺胺类sul2和sul3;四环素tetB和tetC;氨基糖苷类aac(3)-Ⅱ和aac(3)-Ⅳ;氟苯尼考flor检出率≥75%,表明这些耐药基因在该屠宰生产链中沙门氏菌较为普遍。不同国家,不同地区沙门氏菌流行情况及临床抗生素使用习惯的不同,直接导致耐同种药物的沙门氏菌携带的耐药基因不同。李郁等[7]对屠宰生猪多重耐药沙门氏菌耐药基因的检测,tetB、aph(3)-Ⅱa和flor基因检出率较高。张玮等[7]对健康猪直肠粪便中沙门氏菌耐药基因的检测,tetB、aph(3)-Ⅱa和cmlA基因检出率较高。Ahmed A M等[27]对分离于埃及病鸡肉中的多重耐药沙门氏菌耐药基因的检测,blaTEM-1、blaCMY-2、flor、tetA基因检出率较高。
沙门氏菌对喹诺酮类药物耐药主要是因为DNA解旋酶和拓扑异构酶基因突变,其次是目前研究较多的耐药质粒携带耐药基因。郝宏珊等[28]对鸡肉源沙门氏菌喹诺酮和氟喹诺酮类抗生素耐药状况及相关基因研究表明,四省市中鸡肉源沙门氏菌耐药状况严重,其解旋酶和拓扑异构酶基因突变及耐药质粒携带的耐药基因是导致沙门氏菌对喹诺酮和氟喹诺酮类耐药的重要机制。Laura J等[29]对英国动物源喹诺酮耐药沙门氏菌gyrA和parC基因突变点检查,196株沙门氏菌中,有194株沙门氏菌均检测到gyrASer83或Asp87突变,未检测到parC突变。林居纯等[30]对食品动物源沙门氏菌质粒介导喹诺酮类耐药基因的检测,菌株主要携带qnrB、aac(6′)-Ⅰb-cr及oqxAB基因的耐药质粒。因此,本实验应进一步对DNA解旋酶和拓扑异构酶基因突变及耐药质粒携带的耐药基因进行检测。
4 结论
沙门氏菌对常见抗生素具有不同程度的耐药性,且耐药基因普遍存在于耐药菌株中,药敏实验结果与耐药基因检测结果有很高的一致性。
[1]廖成水,程相朝,张春杰,等. 鸡源致病性沙门氏菌新近分离株的耐药性与耐药基因[J]. 中国兽医科学,2011,41(7):751-755.
[2]The Community Summary Report on trends and sources of zoonoses,zoonotic agents and food-borne outbreaks in the European Union in 2008[R]. The EFSA Journal,2011,1496(a):1-410.
[5]马孟根,王红宁,余勇,等. 猪源致病性沙门氏菌耐药基因的分析[J]. 畜牧兽医学报,2006,37(1):65-70.
[6]张玮,李郁,姚健,等. 健康猪直肠粪便中沙门菌1类整合子与耐药基因的检测[J]. 中国微生态学杂志,2010,22(7):594-598.
[7]李郁,焦新安,魏建忠,等. 屠宰生猪多重耐药沙门菌1类整合子与耐药基因的检测[J]. 中国人兽共患病学报,2008,24(4):327-330.
[8]朱恒文. 肉鸡屠宰加工生产链中沙门氏菌的污染与溯源及耐药性分析[D]. 合肥:安徽农业大学,2012.
[9]Bugarel M,Granier S A,Weill F X,et al. A multiplex real-time PCR assay targeting virulence and resistance genes in Salmonella enterica serotype Typhimurium[J]. BMC microbiology,2011,11(1):151-161.
[10]Song Y,Roumagnac P,Weill F X,et al. A multiplex single nucleotide polymorphism typing assay for detecting mutations that result in decreased fluoroquinolone susceptibility in Salmonella enterica serovars Typhi and Paratyphi A[J]. Journal of antimicrobial chemotherapy,2010,65(8):1631-1641.
[11]CLSI. M100-S19 Performance standards for antimicrobial susceptibility testing[S]. wayne,PA:Clinical and Laboratory Standards Institute,2010.
[12]黄金林,焦新安,文其乙,等. 应用聚合酶链反应快速检测沙门氏菌[J]. 扬州大学学报,2002,23(3):5-7.
[13]邵碧英,陈彬,汤敏英,等. 沙门氏菌DNA提取及PCR反应条件的优化[J]. 食品科学,2007,28(7):331-334.
[14]Chen S,Zhao S,White D G,et al. Characterization of multiple-antimicrobial-resistant Salmonella serovars isolated from retail meats[J]. Applied and environmental microbiology,2004,70(1):1-7.
[15]Shaw K J,Rather P N,Hare R S,et al. Molecular genetics of aminoglycoside resistance genes and familial relationships of the aminoglycoside-modifying enzymes[J]. Microbiology and Molecular Biology Reviews,1993,57(1):138-163.
[16]Jensen V F,Jakobsen L,Emborg H D,et al. Correlation between apramycin and gentamicin use in pigs and an increasing reservoir of gentamicin-resistant Escherichia coli[J]. Journal of Antimicrobial Chemotherapy,2006,58(1):101-107.
[17]Fan W,Hamilton T,Webster S,et al. Multiplex real-time SYBR GreenⅠPCR assay for detection of tetracycline efflux genes of Gram-negative bactetia[J]. Molecular and Cellular Probes,2007,21(4):245-256.
[18]Lee M F,Chen Y H,Peng C F. Molecular characterisation of class 1 integrons in Salmonella enterica serovar Choleraesuis isolates from southern Taiwan[J]. International journal of antimicrobial agents,2009,33(3):216-222.
[20]杨保伟,申进玲,席美丽,等. 2007-2008 年西安地区鸡肉源沙门氏菌相关特性分析[J]. 食品科学,2011,32(19):130-136.
[21]朱恒文. 肉鸡屠宰加工生产链中沙门氏菌的污染与溯源及耐药性分析[D]. 合肥:安徽农业大学,2012.
[22]王建舫,何诚,查振林,等. 禽源沙门氏菌的血清型分布与耐药性分析[J]. 养禽与禽病防治,2009(8):9-11.
[23]Miller A J,Twomey D F,Davies R H,et al. Salmonella serovars and antimicrobial resistance patterns on a sample of high sero-prevalence pig farms in England and Wales(2003-2008)[J]. Zoonoses and public health,2011,58(8):549-559.
[24]侯小刚. 四川主要肉品生产链中沙门氏菌的分离鉴定、耐药性分析及PFGE分型[D]. 雅安:四川农业大学,2012.
[25]赵玉林,刘芳萍,李昌文,等. 鸡源性多重耐药沙门氏菌1类整合子与耐药基因研究[J].中国家禽,2012,34(4):29-32.
[26]廖成水,程相朝,张春杰,等. 鸡源致病性沙门氏菌新近分离株的耐药性与耐药基因[J].中国兽医科学,2011,41(7):751-755.
[27]Ahmed A M,Shimamoto T. Genetic analysis of multiple antimicrobial resistance in Salmonella isolated from diseased broilers in Egypt[J]. Microbiology and immunology,2012,56(4):254-261.
[28]郝宏珊,杨保伟,师俊玲,等. 鸡肉源沙门氏菌对喹诺酮和氟喹诺酮类抗生素耐药状况及相关基因[J]. 微生物学报,2011,51(10):1413-1420.
[29]Piddock L J,Ricci V,McLaren I,et al. Role of mutation in the gyrA and parC genes of nalidixic-acid-resistant Salmonella serotypes isolated from animals in the United Kingdom[J]. Journal of Antimicrobial Chemotherapy,1998,41(6):635-641.
[30]林居纯,覃春红,赖婧,等. 食品动物源沙门氏菌质粒介导喹诺酮类耐药基因的检测与分析[J]. 畜牧兽医学报,2012,43(5):803-809.
Drug resistance gene detection and the resistance correlation analysis inSalmonellaisolated from broiler slaughterhouse production chain
LAI Hai-mei1,ZOU Li-kou3,LIU Shu-liang1,2,*,HAN Xin-feng1,2,ZHOU Kang1,2,LUO Pei-wen1,XIA Xiao-long1,LI Jian-long1
(1.College of Food Science,Sichuan Agricultural University,Ya’an 625014,China;2.Key Laboratory of Agricultural Products Processing and Preservation Engineering of Sichuan Province,Ya’an 625014,China;3.Lab of Microbiology,Dujiangyan Campus of Sichuan Agricultural University,Dujiangyan 611830,China)
Objective:To understand the relationship between drug-resistant gene and drug resistance ofSalmonellaisolates from broiler slaughterhouse production chain. Method:The susceptibility testing of 72Salmonellastrains from broiler slaughterhouse production chain to 10 varieties of antibiotics were performed by means of K-B disc method and PCR technique was used to detect the presence of resistance gene in the corresponding drug-resistantSalmonellaisolated. Result:The nalidixic acid(100%)resistant rates ofSalmonellaisolated from broiler slaughterhouse production chain were the highest. The resistant rates of 72Salmonellaisolated to ampicilin,benzyl methyl oxygen/sulfamethoxzole,ciprofloxacin,tetracycline,gentamicin were 69.44%,54.17%,38.89%,34.72% and 13.89%,respectively. At least one antimicrobial resistance gene was detected in eachSalmonellaisolate and the following antimicrobial resistance genes were commonly present;the detection rates of the resistant strains ofblaTEM,blaCMY-2,sul2,sul3,tetBandtetCgenes were 96.08%,100%,94.87%,71.79%,78.38%,100%,respectively. Conclusion:These results implied that the resistantSalmonellaisolated from broiler slaughterhouse production chain to common antibiotics were different from each other,and resistant genes were widely existed in these resistant strains. Antimicrobial phenotypes ofSalmonellaisolates were very consistent with their genotypes(≥75%).
broiler slaughterhouse production chain;Salmonella;susceptibility testing;drug resistant genes
2014-06-30
赖海梅(1988-),女,硕士研究生,研究方向:食品微生物。
*通讯作者:刘书亮(1968-),男,博士,教授,研究方向:食品微生物与发酵工程。
公益性行业(农业)科研专项子课题(200903055)。
TS201.6
A
1002-0306(2015)07-0187-05
10.13386/j.issn1002-0306.2015.07.031
