海藻酸钠固定细胞产D-阿洛酮糖的研究
2015-05-08李秋喜林春芳沐万孟
李秋喜,林春芳,沐万孟,江 波,张 涛
(江南大学食品科学与技术国家重点实验室,江苏无锡 214122)
海藻酸钠固定细胞产D-阿洛酮糖的研究
李秋喜,林春芳,沐万孟,江 波*,张 涛
(江南大学食品科学与技术国家重点实验室,江苏无锡 214122)
D-阿洛酮糖3-差向异构酶(DPEase)是一种能催化D-果糖转化为D-阿洛酮糖的异构酶。本实验采用海藻酸钠作为载体,包埋重组大肠杆菌催化D-果糖生成D-阿洛酮糖。以固定化细胞的酶活活力回收率为指标,优化出最佳固定化条件为:海藻酸钠浓度3%,细胞包埋量60g/L,CaCl2浓度2%,固定化时间4h,0.01%浓度戊二醛溶液中交联4h。该条件下所得固定化细胞的酶活回收率高达76%,且具有较好的操作稳定性,重复操作8次后酶活回收率仍然保持61%。固定化后DPE细胞的最适酶反应温度提高了5℃、最适pH与游离细胞基本一致,耐热性明显提高,pH稳定性与游离细胞一致。
D-阿洛酮糖,海藻酸钠,固定化,D-阿洛酮糖3-差向异构酶
D-阿洛酮糖是近年发现的一种具有特殊保健功能的新型功能性因子,它的甜度相当于果糖的70%,能量只有蔗糖的0.3%,具有低能量、改善肠道菌群、降低血糖、抗龋齿等生理功能[1-4]。它是D-果糖在C-3位的差向异构体,目前能实现D-果糖到D-阿洛酮糖之间生物转化的酶主要有两种:D-阿洛酮糖3-差向异构酶(D-psicose 3-epimerase,缩写为DPE)和D-塔格糖3-差向异构酶(D-tagatose 3-epimerase,缩写为DTE),前者的最适底物为D-阿洛酮糖,后者则为D-塔格糖[5-7]。在稀有糖的生产上,日本香川大学Izumori团队通过离子交换结合方法固定重组DTEase,酶结合效率达到90%[8-9]。韩国世宗大学Oh团队选择 Duolite A568离子交换树脂对DPEase进行固定化,在硼酸盐存在下,D-阿洛酮糖的转化率达到65%[10]。国内江南大学江波团队[11]采用大孔弱碱性苯乙烯系阴离子交换树脂D380为载体,以戊二醛为交联剂,其酶活回收率达到20%以上。天津科技大学的研究团队[12]用壳聚糖固DPE在填充床中反应得到D-阿洛酮糖的最高转化率为24%。
细胞固定化技术是利用物理或化学手段将游离的微生物(细胞)或酶定位于限定的空间区域,并使其保持活性且能反复利用的一项技术[13]。包埋法是近年来发展迅速的一种新兴细胞固定化技术,也是目前细胞固定化研究和应用最广泛的方法[14-15]。本研究通过包埋-交流的方法对携带有DPE基因的大肠杆菌重组菌进行固定化的研究,探索了海藻酸钠浓度、细胞包埋量、CaCl2浓度以及戊二醛交联等对D-果糖转化成D-阿洛酮糖的影响,初步获得了一种固定化细胞生产D-阿洛酮糖的方法,具有工业化应用前景。
1 材料与方法
1.1 材料与仪器
ClostridiumcellulolyticumDPEase(以下简称DPE) 江南大学食品科学与技术国家重点实验室保藏菌种。酵母提取物、胰蛋白胨、氨苄青霉素(Amp)、Isopropyl β-D-1-thiogalactopyr-anoside(异丙基-β-D-硫代半乳糖苷,IPTG) 生工生物工程(上海)有限公司;海藻酸钠、无水CaCl2、D-果糖、25%戊二醛溶液 中国医药集团化学试剂有限公司;D-阿洛酮糖标准品 Sigma公司。
Centrifuge 5804R 冷冻离心机 德国Eppendorf公司;SW-CJ-1FD 超净工作台 苏净集团安泰空气技术有限公司;SHA-2冷冻恒温水浴振荡器 江苏太仓实验设备厂;Agilent 高效液相色谱系统 美国Agilent公司;RI-101 Shodex示差折光检测器 日本Shodex公司。
1.2 实验方法
1.2.1 重组DPE细胞的发酵培养 将ClostridiumcellulolyticumDPEase菌种接种于4mL LB液体培养基(含50μg/mL 氨苄抗生素)中,37℃条件下200r/min培养过夜;将其接种至200mL LB液体培养基中,37℃,200r/min培养至OD600值为0.6~0.8,加入终浓度为0.5mmol/L的IPTG,28℃条件下200r/min诱导培养6h,高速冷冻离心收集菌体,即得重组DPE细胞。
1.2.2 重组DPE细胞的固定化 称取一定量的海藻酸钠加水10mL,加热搅拌充分溶解,待冷却后将5mL的菌悬液加入海藻酸钠溶液中混合搅拌30min。用带有针头的注射器将上述混合液以60滴/min的速度滴入CaCl2溶液中,即形成大小均一的光滑小球,0~4℃条件下静置硬化一定时间。抽滤,用Tris-HCl缓冲溶液(50mmol/L、pH8.0 Tris-HCl,下同)洗涤三次,抽滤干燥,滤纸吸干表面水分,即得固定化细胞小球,0~4℃悬浮于Tris-HCl缓冲液中保存[16]。
1.2.3 固定化条件优化 采用单因素对比实验进行海藻酸钠浓度、细胞浓度、CaCl2浓度、固定化时间等条件的优化实验。海藻酸钠浓度为3%,细胞包埋量60g/L,CaCl2浓度为2%,固定化时间4h,控制3因素不变,变化1个因素,海藻酸钠浓度1%~3%,细胞包埋量20~70g/L,CaCl2浓度2%~10%,固定化时间1~10h,来确定各因素对固定化效果的影响。包埋法同1.2.2,硬化完成后待其温度与戊二醛温度相当时,加入一定浓度的戊二醛溶液,并于4℃静置交联。交联完成后,用Tris-HCl缓冲溶液洗涤三次,抽滤干燥,滤纸吸干表面水分,即得固定化细胞小球,0~4℃悬浮于Tris-HCl缓冲液中保存。并在最优包埋条件下进行戊二醛浓度,交联时间的优化。戊二醛浓度0.01%~0.09%,交联时间0.5~5h。
1.2.4 固定化细胞的酶学性质
1.2.4.1 固定化细胞的最适温度与温度稳定性 在最优条件下固定化细胞,并按1.3分别测定固定化细胞和游离细胞在不同温度条件下(45、55、60、65、70和80℃)反应时的酶活。分别取0.5g固定化细胞小球和0.1g游离细胞加1mL Tris-HCl缓冲液在45、50、55、60、65、70和80℃温度条件下静置1h后,按照1.3分别测定酶活。
1.2.4.2 固定化细胞的最适pH和pH稳定性 在最优条件下固定化细胞,然后取0.5g固定化细胞小球于4mL离心管中,在不同pH缓冲液环境下55℃反应5min后按1.3测固定化细胞酶活。同时测游离细胞在不同pH缓冲液反应酶活。分别取0.5g固定化细胞小球于4mL离心管中,加1mL不同pH缓冲液4℃放置1h后用去离子水润洗三遍按1.3测固定化细胞酶活。同时测游离细胞在不同pH缓冲液中4℃静置1h后酶活。
1.2.5 固定化细胞的操作稳定性 在最优条件下固定化细胞,取0.5g固定化细胞小球于4mL离心管中,固定化细胞的酶活测定方法同1.3,反应完成后用去离子水润洗固定化细胞三次后重复上述操作,连续进行8次实验,分别计算酶活回收率。并探究不同戊二醛浓度下交联的固定化小球的操作稳定性。
1.3 检测方法
游离DPE酶活测定:反应体系为100g/L底物D-果糖(用50mmol/L pH= 8.0 Tris-HCl缓冲液配制)和适量菌体,55℃水浴恒温反应5min,沸水浴停止反应。
固定化DPE酶活测定:称取固定化小球0.5g,加1mL 100g/LD-果糖,55℃反应5min,取500μL上清沸水浴10min。
酶活力定义为:每分钟产生1μmolD-阿洛酮糖为一个酶活力单位。
酶活回收率:固定化细胞的酶活回收率是指固定化细胞的总活力与用于固定化的总酶活力的百分率。
酶活回收率(%)=固定化酶总活力/用于固定化的总酶活力×100
糖组分测定方法:HPLC(高效液相色谱)法,Agilent 1200Series高效液相色谱,Sugarpak-1钙型阳离子交换柱,Shodex RI-101示差折光检测器;流动相:纯水,柱温:85℃,流速:0.4mL/min,进样量:10μL。
2 结果与讨论
2.1 固定化条件的优化
2.1.1 海藻酸钠浓度对固定化的影响 海藻酸钠的浓度会影响固定化细胞的机械强度、质量传递等,进而影响到细胞的酶活。由图1可知,随着海藻酸钠浓度的增加,固定化细胞的酶活回收率不断增加,这是因为当载体浓度太低时形成的凝胶结构孔径较大,结构不稳定,且颗粒的机械强度不好,细胞容易流失;但海藻酸钠浓度太高,又会导致溶液粘度过高,溶解困难,与细胞悬浮液无法均匀混合,推压注射器费力且形成的固定化颗粒拖尾,形状不规则。综合考虑以上各因素,固定化细胞时,海藻酸钠浓度以3%为宜,该条件下形成的固定化小球有相对较高的酶活回收率,且成型均匀,凝胶强度良好。

图1 海藻酸钠浓度对固定化效果的影响Fig.1 Effect of concentration of sodium alginate on immobilization of DPEase activity
2.1.2 细胞包埋量对固定化的影响 固定化载体中细胞与胶体的比例可能影响酶活回收率。如图2,酶活回收率随细胞包埋量的增加呈先增加后减小的趋势,这主要是当细胞浓度大于60g/L时,载体上的细胞分子密度增大,位阻效应加剧,导致部分细胞失活。故较佳的细胞终浓度取60g/L。

图2 细胞包埋量固定化效果的影响Fig.2 Effect of cell concentration on immobilization of DPEase activity
2.1.3 CaCl2浓度对固定化的影响 不同浓度的CaCl2溶液会影响固定化颗粒的硬化效果。如图3,CaCl2溶液浓度增大时,一方面形成的空间网状结构过于紧密,对酶的空间结构造成了影响;另一方面,可能是由于盐的高渗透压作用,引起细胞脱水,致使细胞活性部分丧失,酶活回收率呈下降趋势。所以CaCl2浓度选择2%。

图3 CaCl2溶液浓度对固定化效果的影响Fig.3 Effect of calcium ion concentration on immobilization of DPEase activity
2.1.4 固定化时间对固定化的影响 海藻酸钠包埋细胞是一个平衡的过程。如图4,在4h左右时,酶活回收率最大,随着时间的延长,酶活没有增加反而降低,说明细胞在载体上包埋已经达到平衡,时间再长,酶的结构反而会受到影响,酶活回收率随之下降。因此,选择固定化时间为4h。

图4 固定化时间对固定化效果的影响Fig.4 Effect of solidifying time on immobilization of DPEase activity
2.1.5 戊二醛浓度对固定化的影响 单独用包埋法所得的固定化细胞容易泄漏。戊二醛是一种常用的双功能试剂,其结构中的两个醛基可分别与载体及酶分子中的氨基反应,使载体和载体之间及酶和载体之间交联,增强凝胶结构的强度和稳定性。如图5,戊二醛浓度低于0.05%时,酶活回收率变化不大;浓度增大酶活回收率反而下降。原因可能是戊二醛使酶蛋白变性,细胞酶活性被破坏。所以戊二醛的最佳浓度范围为0%~0.05%。

图5 戊二醛浓度对固定化效果的影响Fig.5 Effect of flutaraldehyde concentration on immobilization of DPEase activity
2.1.6 戊二醛交联时间对固定化的影响 戊二醛交联时间也会影响固定化细胞酶活回收率。如图6,戊二醛交联4h时固定化细胞活最高;低于4h,戊二醛和酶蛋白的交联不完全,水洗后会使一部分细胞脱落;高于4h,由于戊二醛上可发生交联反应的醛基数目有限,所以再增加交联时间固定化细胞酶活回收率基本不变。

图6 戊二醛交联时间对固定化效果的影响Fig.6 Effect of flutaraldehyde crosslinking time on immobilization of DPEase activityv
2.2 固定化细胞的酶学性质及稳定性
2.2.1 固定化细胞的最适反应温度 取适量游离细胞和固定化细胞,分别在45~80℃温度下反应,测定酶活。如图7,游离细胞的最适温度为65℃,固定化细胞的最适温度提高到了70℃。
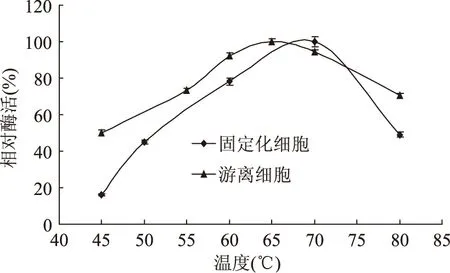
图7 固定化细胞与游离细胞的最适反应温度Fig.7 Relative activity of free and immobilized cells under different temperature conditions
2.2.2 固定化细胞的温度稳定性 各取适量固定化细胞和游离细胞,分别在45~80℃保温1h,测其残余酶活力,如图8,细胞被固定化后耐热性有所提高,原因可能是凝胶结构对细胞起到了保护的作用[17]。
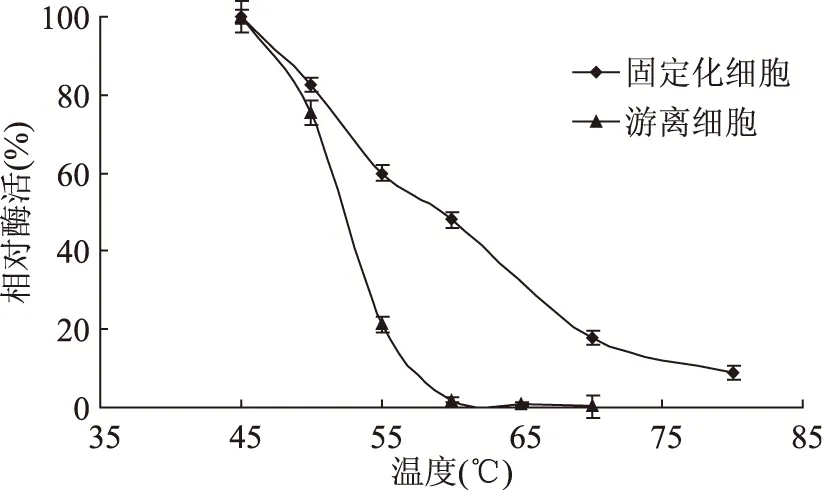
图8 固定化细胞和游离细胞的热稳定性Fig.8 Effect of temperature on the activity of immobilized cells and free cells
2.2.3 固定化细胞的最适反应pH 在pH分别为6.0~7.5磷酸缓冲液和8.0,9.0的巴比妥钠-盐酸缓冲液存在下测定固定化细胞和游离细胞的酶活。如图9所示,细胞被固定化后最适反应pH范围没有变化。
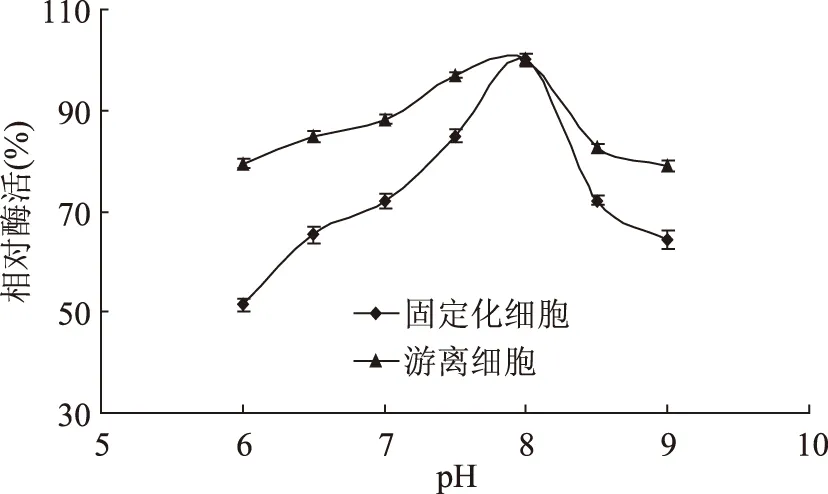
图9 固定化细胞与游离细胞最适反应pHFig.9 Relative activity of free and immobilized cells under different pH value conditions
2.2.4 固定化细胞的pH稳定性 在不同pH的缓冲液下处理1h的游离细胞和固定化细胞残余活力如图10,固定化细胞的pH稳定性有所增强,细胞经过包埋和交联后被固定在凝胶结构中,使外界因素对细胞的酶作用影响减弱。
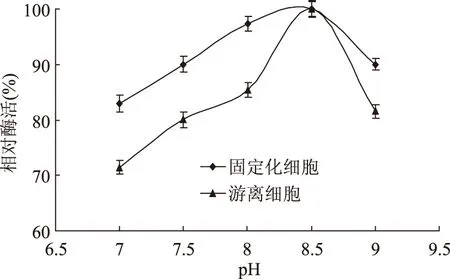
图10 固定化细胞与游离细胞的pH稳定性Fig.10 Effect of pH value on the activity of immobilized cells and free cells
2.2.5 固定化细胞的操作稳定性 固定化细胞较游离细胞有较好的操作稳定性。如图11所示,未经过戊二醛交联和经过戊二醛交联的固定化细胞酶活回收率呈现先增加后下降的趋势,第5次的酶活回收率较第1次提高了一倍,实验操作过程中凝胶小球的体积明显增大。原因可能是,润洗和酶反应是个冷热交替处理凝胶颗粒的过程,凝胶颗粒出现明显溶胀,小球表面积增大使细胞内的DPE酶与底物接触性变好,有利于酶反应。但是溶胀后孔径变大,反复操作,细胞容易流失,所以酶活回收率从第5次开始下降。另外,低浓度戊二醛(低于0.05%)对操作稳定性影响不大,浓度过高反而使同批次操作稳定性变差。所以综合考虑酶活回收率以及操作稳定性,戊二醛浓度选择0.01%。

图11 固定化细胞的操作稳定性Fig.11 Operation stability of immobilized cells
3 结论
以海藻酸钠为载体,戊二醛为交联剂,对DPE重组细胞进行固定化,研究得出固定化细胞的最优条件为:海藻酸钠浓度3%,细胞包埋量60g/L,CaCl2浓度2%,固定化时间4h,0.01%戊二醛,交联时间4h。该条件下所得酶活回收率高达76%,且具有较好的操作稳定性,重复操作8次后酶活回收率仍然保持61%。固定化后DPE细胞的最适温度提高了5℃、最适pH与游离细胞基本一致,耐热性明显提高,pH稳定性与游离细胞一致。海藻酸钠包埋法成本低,操作简单,条件较为温和,操作稳定性好,适合用于工业化生产D-阿洛酮糖。但还需要进一步的研究,比如固定化细胞反应器,提高转化率等方面的内容。
[1]Matsuo T,Suzuki H,Hashiguchi M,et al.D-psicose is a rare sugar that provides no energy to growing rats[J]. J Nutr Sci Vitaminol,2002,48(1):77-80.
[2]Matsuo T,Baba Y,Hashiguchi M,et al. DietaryD-psicose,a C-3 epimer of D-fructose,suppresses the activity of hepatic lipogenic enzymes in rats[J]. Asia Pac J Clin Nutr,2001,10(3):233-237.
[3]Matsuo T,Izumori K. Effects of dietaryD-psicose on diurnal variation in plasma glucose and insulin concentrations of rats[J]. Biosci Biotechnol Biochem,2006,70(9):2081-2085.
[4]Matsuo T,Tanaka T,Hashiguchi M,et al.Metabolic effects ofD-psicose in rats:studies on faecal and urinary excretion and caecal fermentation[J].Asia Pac J Clin Nutr,2003,12:225-231.
[5]沐万孟,张涛,江波.稀有糖的生物转化生产策略:Izumoring方法[J].中国生物工程杂志,2007,27:129-136.
[6]张龙涛,沐万孟,江波,等.生物转化生成D-阿洛酮糖的类球红细菌的筛选[J].食品与发酵工业,2008,34(9):40-43.
[7]储菲菲,邢庆超,沐万孟,等. Clostridium cellulolyticum D-塔格糖 3-差向异构酶基因的克隆、表达及酶活性[J].食品与生物技术学报,2011,30(2):283-286.
[8]Itoh H,Sato T,Izumori K. Preparation ofD-psicose fromD-fructose by immobilizedD-tagatose 3-epimerase[J]. J Ferment Bioeng,1995,80(1):101-103.
[9]Takeshita K,Suga A,Takada G,et al. Mass production ofD-psicose fromD-fructose by a continuous bioreactor system using immobilizedD-tagatose 3-epimerase[J]. J Biosci Bioeng,2000,90(4):453-455.
[10]Lim B C,Kim H J,Oh D K. Mass production of d-psicose from d-fructose by a continuous bioreactor system using immobilized d-tagatose 3-epimerase[J]. Process Biochemistry,2009,44:822-828.
[11]储菲菲,沐万孟,江波.Clostridium cellulolyticumD-阿洛酮糖 3-差向异构酶的固定化研究[OL].中国科技论文在线,2012-01-11.
[12]李晓波,朱玥明,柏玮,等.壳聚糖固定D-阿洛酮糖3-差向异构酶转化D-阿洛酮糖[J].食品工业科技,2013,17:158-162.
[13]王新,李培军,陈志梅,等.固定化细胞技术的研究与进展[J].农业环境保护,2001,20(2):120-122.
[14]李超敏,韩梅,张良,等.细胞固定化技术海藻酸钠包埋法的研究进展[J].安徽农业科学,2006,34(7):1281-1282,1284.
[15]石小霞,褚可成,陈志梅,等.固定化细胞技术及其应用[J].食品工业科技,2010,12:380-383.
[16]付凤根,徐铮,李贵祥,等.利用固定化重组大肠杆菌细胞生产D-塔格糖[J].中国生物工程杂志,2011,31(7):85-90.
[17]李晓卉,程丽芳,沐万孟,等.交联海藻酸钠-明胶固定化L-阿拉伯糖异构酶的研究[J].食品工业科技,2011,32(8):198-201.
Research of the immobilization of microbial cells in sodium alginate forD-Psicose conversion
LI Qiu-xi,LIN Chun-fang,MU Wan-meng,JIANG Bo*,ZHANG Tao
(State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
D-Psicose 3-epimerase(DPEase)is an enzyme that catalyzes the reversible isomerization betweenD-fructose andD-psicose. In this study,the calcium alginate gels was used as carrier to immobilize the microbial cells with DPEase. The enzymatic properties of the immobilized and free DPEase were studied to get the optimal parameters. The results showed that the optimum operation conditions were:3.0% sodium alginate,60g/L of embedded cell,2% CaCl2,solidifying time 4h,0.01% flutaraldehyde,crosslinking time 4h.Under the optimum condition,the recovery rate reached 76% .After eight times repeated operations,the recovery rate reached more than 61%,showing good operational stability. Compared with the free microbial cells with DPEase,the optimum temperature of immobilized DPEase raises 5 degrees,the pH value wasn’t changed. Besides,the pH and thermal stabilities of immobilized DPEase were better than the free microbial cells.
D-Psicose;sodium alginate;immobilization;D-Psicose 3-epimerase
2014-06-16
李秋喜(1989-),女,硕士研究生,研究方向:食品酶技术。
*通讯作者:江波(1962-),男,博士,教授,研究方向:食品酶技术。
科技部十二五863计划(2013AA102102);绍兴市科技计划项目(2013A23002)。
TS201.1
A
1002-0306(2015)07-0172-05
10.13386/j.issn1002-0306.2015.07.028
