小球藻保健饮料的研制
2015-05-08庞庭才胡上英邓冬玲李丽燕
庞庭才,胡上英,熊 拯,邓冬玲,李丽燕
(1.广西北部湾海洋生物多样性养护重点实验室,广西钦州 535099;2.北部湾海洋生物资源开发与保护重点实验室,广西钦州 535099;3.钦州学院,广西钦州 535099)
小球藻保健饮料的研制
庞庭才1,2,3,胡上英3,熊 拯3,邓冬玲1,2,3,李丽燕3
(1.广西北部湾海洋生物多样性养护重点实验室,广西钦州 535099;2.北部湾海洋生物资源开发与保护重点实验室,广西钦州 535099;3.钦州学院,广西钦州 535099)
以小球藻粉为原料,采用超声波辅助提取藻多糖,再利用木瓜蛋白酶与中性蛋白酶进行水解藻蛋白,合并滤液后,按一定比例添加适量蜂蜜、白糖、柠檬酸直接配制澄清型小球藻保健饮料。通过正交实验确定提取藻多糖的最佳工艺为:料液比1∶15(g∶mL),pH7,温度60℃,时间30min,小球藻多糖提取得率为18.94mg/g。水解藻蛋白的最佳工艺为:底物浓度100g/L,混合酶量12000U/g,pH6.5,温度55℃,小球藻蛋白水解度达27.83%。研制成的产品营养丰富、风味独特,是一款老少皆宜的营养保健饮品。
小球藻,多糖,蛋白质,饮料
小球藻(Chlorellasp.)属于单细胞绿藻[1],分布广泛,生物量大,富含蛋白质、维生素、矿物质等人体不可缺少的营养素,特别是糖蛋白、多糖以及核酸等物质,具有激活淋巴细胞、增强免疫力、抵抗外来疾病的入侵、促进人体受伤组织修复等功效[2-5]。小球藻是全世界微藻产业中产量最多的品种,全世界年产量2000吨,主要生产地为东南亚地区[6]。目前,在食品领域对小球藻的加工,主要是将其经过热处理和破壁处理直接制成小球藻片、颗粒剂或胶囊[7]。而小球藻粉本身存在着特殊的藻腥味,因此制成其他食品如:面包、面条、饼干等时,虽然营养丰富,往往由于品相和浓郁的腥味不被大众消费者所接受[8]。本文采用超声波辅助提取小球藻多糖,再选用双酶法水解小球藻蛋白,合并滤液后进行调配,从而研制出气味清新、口感独特、营养丰富且具有一定保健功效的小球藻饮料。
1 材料与方法
1.1 材料与设备
小球藻粉 青岛恒达精益贸易有限公司;木瓜蛋白酶 白色,粉状,6万U/g,南宁东恒华道生物科技有限责任公司;中性蛋白酶 白色,粉状,5万U/g,南宁东恒华道生物科技有限责任公司;白糖 湛江市金丰糖业有限公司;食品级柠檬酸 潍坊英轩实业有限公司。葡萄糖、苯酚、浓硫酸、无水乙醇均为分析纯 广东光华化学厂有限公司。
EL204分析天平 梅特勒-托利多仪器(上海)有限公司;EL20酸度计 梅特勒-托利多仪器(上海)有限公司;VGT-1990QTD超声波清洗机 昆山市超声仪器有限公司;V-1800PC型可见分光光度计 上海美谱达仪器有限公司;HH-4数显恒温水浴锅 金坛科析仪器有限公司;H-1850台式离心机 湖南湘仪实验室仪器开发有限公司。
1.2 工艺流程
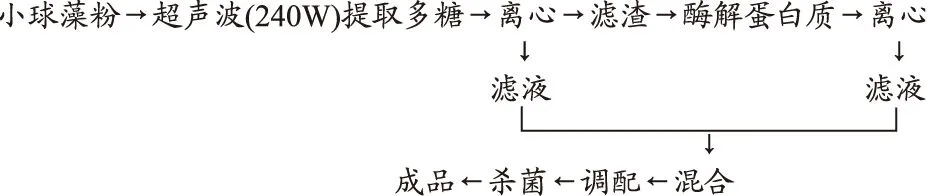
1.3 小球藻多糖的提取
1.3.1 小球藻多糖提取的单因素实验 按设定的料液比加入小球藻粉和水,在设定的pH和温度下超声波辅助提取,经设定时间后,5000r/min离心15min,过滤,滤液加入3倍体积85%乙醇进行沉淀,然后再过滤,将沉淀用无水乙醇洗涤2次,沉淀为藻多糖。将藻多糖溶于蒸馏水中并定容至100mL,测定多糖含量。每次处理重复测定3次,结果取平均值。单因素实验考察料液比、提取温度、提取时间和pH4个因素对多糖提取效果的影响:
料液比的选择:温度50℃、时间30min、pH7,料液比分别为1∶15、1∶20、1∶25、1∶30、1∶35(g∶mL)。
温度的选择:时间30min、pH7、料液比1∶20(g∶mL),温度分别为40、50、60、70、80℃。
时间的选择:温度60℃、pH7、料液比为1∶20(g∶mL),时间分别为20、25、30、35、40min。
pH的选择:温度60℃、时间30min、料液比1∶20(g∶mL),pH3、5、7、9、11。
1.3.2 小球藻多糖提取正交实验 在单因素实验基础上设计L9(34)正交实验(见表1),以考察料液比、提取温度、提取时间和pH 4个因素对藻多糖提取效果的影响,以确定最佳提取工艺。

表1 藻多糖提取正交水平表
1.3.3 多糖提取得率测定 以葡萄糖为标准系列采用苯酚-硫酸法[9-10]测定多糖含量,再按式(1)计算样品中多糖含量:
多糖提取得率计算公式如下:
式(1)
式中:C-从标准曲线上查出的多糖质量浓度,mg/g;N--样品体积稀释倍数;V-原样品液体积,mL;m-样品的质量,mg。
1.4 小球藻多肽的制备
取提多糖后的滤渣,加入100mL水,在设定的pH调节下,按设定的酶活力之比加入木瓜蛋白酶与中性蛋白酶,在设定温度下恒温搅拌水解3h,90℃灭酶10min,冷却至50℃左右,于离心机中5000r/min离心15min,取上清液,即得到小球藻酶解液。
1.4.1 复合酶活力比的选取 小球藻滤渣加入纯水使底物浓度为60g/L,按木瓜蛋白酶与中性蛋白酶酶活力比为1∶2、1∶1、2∶1分别加入12000 U/g的混合酶,滴加0.1mol/L NaOH溶液调节pH至7.5,置于50℃恒温水浴中水解3h,反应过程中不断加NaOH溶液使pH恒定。以水解度(DH)为指标,确定最佳复合酶活力比。
1.4.2 小球藻多肽制备的单因素实验 小球藻多肽制备的单因素实验,以水解度(DH)为指标,考察底物浓度、加酶量、pH和温度4个因素对多肽制备效果的影响:
底物浓度的确定:酶活力比为2∶1,加酶量12600U/g,温度50℃,pH7.5,底物浓度分别为60、80、100、120、140g/L。
加酶量的确定:酶活力比为2∶1,底物浓度为80g/L,温度50℃,pH7.5,加酶量分别为12000、12600、13200、13800、14400U/g。
pH的确定:酶活力比为2∶1,加酶量12600U/g,底物浓度为80g/L,温度50℃,pH分别为6.5,7.0,7.5,8.0,8.5。
温度的确定:酶活力比为2∶1,加酶量12600U/g,底物浓度为80g/L,pH7.5,温度分别40、45、50、55、60℃。
1.4.3 双酶法水解正交实验 在单因素实验基础上设计L16(45)正交实验(见表2),考察以温度、底物浓度、酶用量、pH 4个因素对小球藻蛋白水解效果的影响,以确定最佳的酶解工艺。

表2 酶解正交水平表
1.4.4 水解度(DH)测定 以NaOH溶液的消耗量为指标,采用pH-stat法检测小球藻蛋白的水解度[11],用下列公式(2)计算出蛋白质的水解度。
DH(%)=VNaOH×CNaOH/(α×Mp×htot)×100
式(2)
式中:VNaOH-NaOH消耗量,mL;CNaOH-NaOH摩尔浓度,mol/L;α-大豆分离蛋白氨基的平均解离度,α=10pH-pK/(1+10pH-pk),pK可取7;Mp-蛋白质总量,g;htot-每克蛋白质中肽键的克当量数,取8. 38。
1.5 混合
取上述处理得到的多糖提取液和酶解液混合,搅拌均匀,冷藏备用。
1.6 灌装与杀菌
利用灌装设备将调配好的小球藻混合液装瓶(100mL/瓶),置于90℃灭菌15min,冷却即可。
2 结果与分析
2.1 多糖提取实验结果与分析
以空白为参比,在波长490nm处测定标准液的吸光度A,以吸光度A为纵坐标,以葡萄糖标准液浓度C为横坐标,绘制标准曲线。该标准曲线方程:Y=5.6757X+0.0067,R2=0.9999。表明葡萄糖的质量浓度在0.02~0.14mg/mL内与吸光度呈良好的线性关系。
2.1.1 藻多糖提取单因素实验结果 料液比的选择:由图1可知,在料液比1∶20(g∶mL)时藻多糖的提取得率最高,说明水溶性藻多糖基本全部溶出。料液比高于1∶20(g∶mL)时,藻多糖提取得率都有所降低,这可能是因为小球藻多糖几乎被全部溶出后,过多加水增大了其他杂质的大量溶出,还会使浓缩过程中多糖损失增大,从而导致小球藻多糖提取得率有所降低。因此最佳料液比选择1∶20(g∶mL)。

图1 料液比对藻多糖提取得率的影响Fig.1 The influence of solid-liquid ratio on the algae polysaccharide extraction rate
提取温度的选择:由图2可知,提取温度为60℃时,藻多糖提取得率达到最大。温度低于60℃时,温度的逐渐升高加速了藻多糖的溶出,而当超过60℃时,由于温度过高容易导致小球藻内多糖分子结构被破坏而分解,提取得率也随之下降,因此最佳提取温度选择60℃。
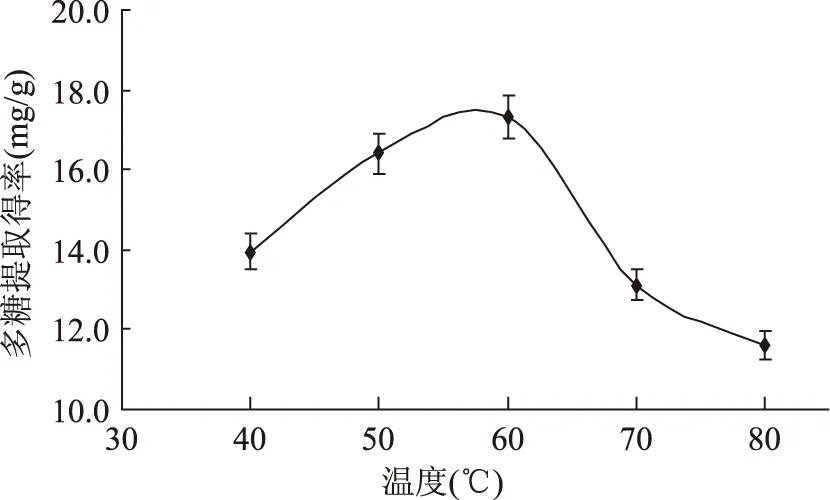
图2 温度对藻多糖提取得率的影响Fig.2 The influence of temperature on the algae polysaccharide extraction rate
提取时间的选择:由图3可知,当超声处理30min 时,藻多糖提取得率达到最大值,而后随超声时间延长,提取量有所下降。这是由于超声波处理能够促使细胞组织破裂,加速溶剂与胞内物质的相互溶解渗透,但当超声时间超过30min后,由于超声时间过长导致多糖结构被破坏,导致提取得率有所下降。因此最佳的提取时间选择30min。

图3 时间对藻多糖提取得率的影响Fig.3 The influence of time on the algae polysaccharide extraction rate
pH的选择:由图4可知,pH7时藻多糖提取得率达到最大。pH<7时,提取量随pH的增加而增加,提取量增加幅度较大。pH>7时,藻多糖提取得率反而有降低的趋势。这主要是由于多糖上具有不同官能团而造成的,质子的官能团可影响多糖在不同 pH提取溶液中的亲水性,导致多糖所含官能团可能会有一定的差异,使得不同pH提取溶液中多糖的提取得率有所不同[12]。因此最佳的pH选择7。

图4 pH对藻多糖提取得率的影响Fig.4 The influence of pH on the algae polysaccharide extraction rate
2.1.2 藻多糖提取正交实验 由表3可知,影响小球藻多糖提取的因素大小分别是温度(B)、pH(D)、时间(C)、料液比(A),最优提取条件为A1B2C2D2,即:料液比1∶15(g:mL),pH7,温度60℃,时间30min,小球藻多糖提取得率为18.94mg/g,经验证实验证明结果与正交实验结果相符。
表4为以对小球藻多糖提取得率影响最小的因素(料液比)为空列,对各因素对多糖提取得率的影响进行方差分析,由表4可以看出,提取温度(B)对小球藻多糖提取得率的影响达到了非常显著的水平(p<0.01),是影响小球藻多糖提取得率的最主要影响因素;提取时间(C)、pH(D)对小球藻对小球藻多糖提取得率的影响不显著(p>0.05)。此项结论也印证了表3的结果。
2.2 小球藻多肽制备实验结果与分析
2.2.1 木瓜蛋白酶与中性蛋白酶的酶活力比 由图5可知,木瓜蛋白酶与中性蛋白酶酶活力比为2∶1时水解度最大,因此选择酶活力比为2∶1。

表3 藻多糖提取正交实验结果

表4 方差分析表
注:“*” 表示显著,“**”表示非常显著。

图5 酶活力比对水解度的影响Fig.5 The influence of enzymatic activity on the degree of hydrolysis
2.2.2 小球藻蛋白酶解单因素实验结果 底物浓度的确定:由图6可知,随着反应底物浓度的增加,水解度呈先上升后下降的趋势,底物浓度小于100g/L时,适当增加底物浓度有利于反应向生成物方向进行。当底物浓度大于100g/L时,水解度反而下降,这是因为底物浓度较大时,在不断受热情况下,蛋白分子易产生交链聚合现象,使蛋白酶分子与底物蛋白分子之间的接触机会减少,从而导致水解度下降,影响反应速度[13]。因此,底物浓度选择100g/L。

图6 底物浓度对水解度的影响Fig.6 The influence of substrate concentration on the degree of hydrolysis
酶用量的确定:由图7可知,随着复合酶用量的增加,小球藻蛋白的水解度也有所增加,但当复合酶量大于12600U/g后,小球藻蛋白的水解度增加变缓,在12600U/g以后增大幅度趋向平缓,这可能是由于酶与底物接触达到饱和,过多的酶之间相互抑制的原因。所以,再继续添加水解酶,水解度将不再增加而出现下降的趋势[14]。因此,选择加酶量12600U/g较合适。
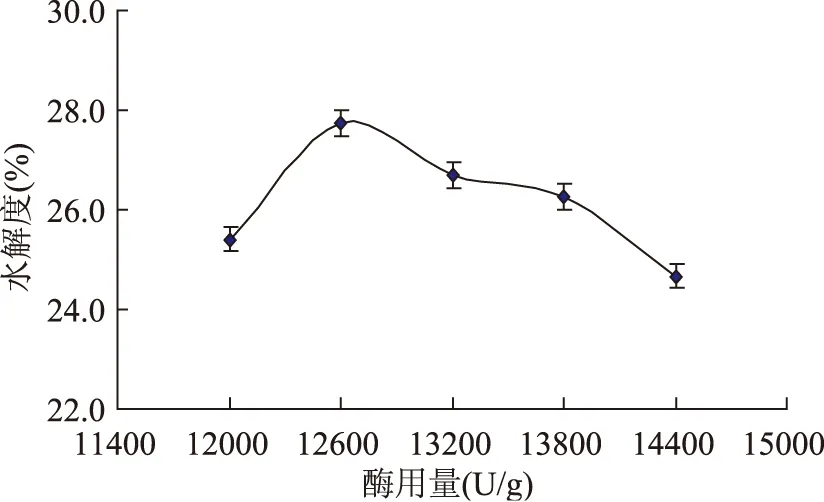
图7 酶用量对水解度的影响Fig.7 The influence of enzyme dosage on the degree of hydrolysis
pH的确定:由图8可知,pH6.5时,小球藻蛋白水解度最高。这是由于酶催化反应的能力与环境pH密切相关,环境pH会影响酶分子的构象和酶分子及底物分子的解离状态,从而影响酶的活性和酶促反应速度,pH过高、过低均对酶促反应不利。因此,选择最佳pH为6.5。

图8 pH对水解度的影响Fig.8 The influence of pH on the degree of hydrolysis
温度的确定:由图9可知,当温度低于50℃时,随着温度的升高,酶促反应增强,藻蛋白水解度逐渐增大;当温度高于50℃时,水解度有所下降。这是因为温度对酶促反应的影响是双效性,适宜的温度能使酶催化反应加速,温度过高则使得酶变性而失活,导致水解度下降。因此,选择最适温度为50℃。

图9 温度对水解度的影响Fig.9 The influence of temperature on the degree of hydrolysis
2.2.3 正交实验结果与验证 由表5可知,各因素对小球藻蛋白的水解度影响程度顺序为D>A>C>B,即:pH、温度、酶用量、底物浓度。pH对小球藻蛋白水解效果有显著影响,温度和酶用量对水解度的影响相差不大,底物浓度影响最不明显。小球藻蛋白最佳水解方案为 A3B2C1D4,即底物浓度100g/L,混合酶用量12000U/g,pH6.5,温度55℃。
按最优水解条件下进行验证实验,计算得小球藻蛋白水解度为27.83%,与正交实验结果相符。
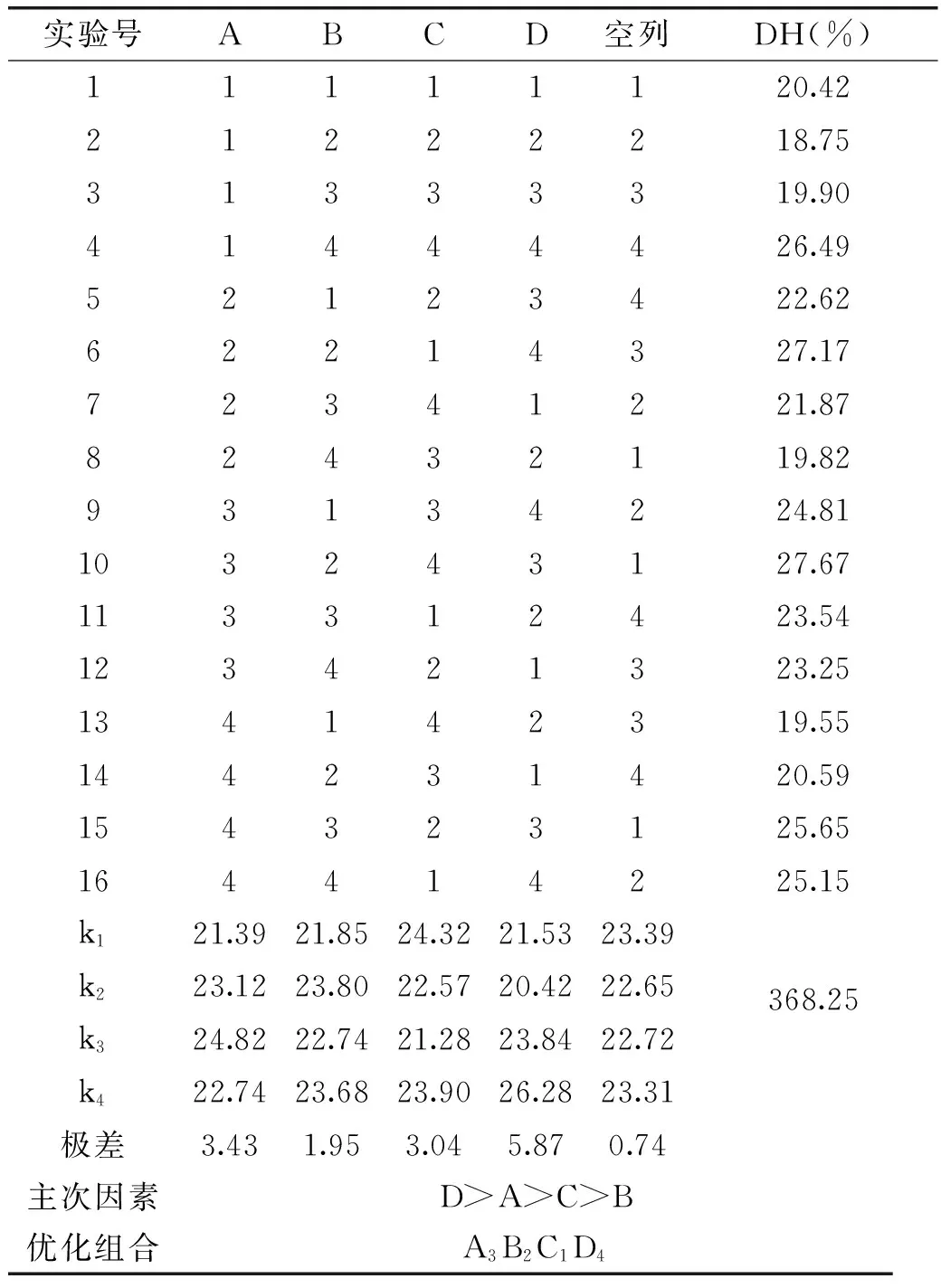
表5 酶解正交实验结果
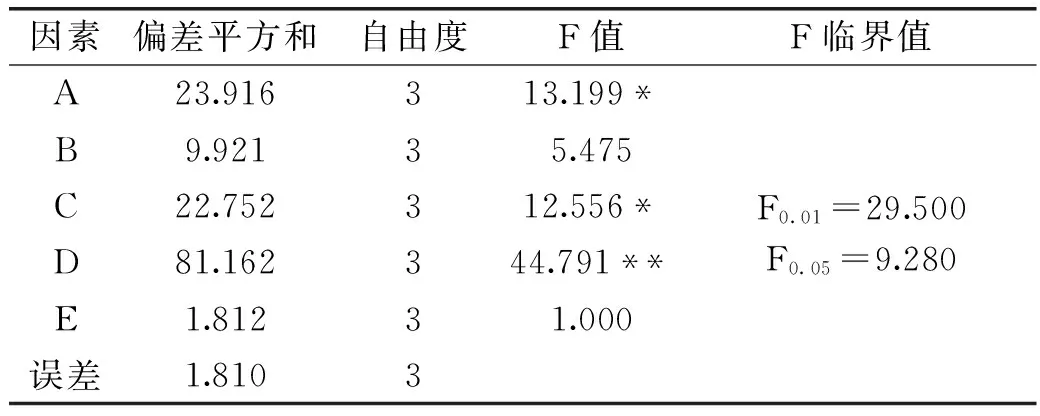
表6 方差分析表
注:“*” 表示显著,“**”表示非常显著。
表6为对各因素水解的影响进行方差分析,由上表可以看出,pH(D)对双酶法水解小球藻蛋白的影响达到了非常显著的水平(p<0.01),pH(D)成为本实验的最主要影响因素;温度(A)、酶用量(C)对双酶法水解小球藻蛋白的影响达到显著水平(p<0.05);底物浓度(B)对双酶法水解小球藻蛋白的影响不显著(p>0.05)。此项结论也印证了表5的结果。
3 结论
3.1 采用超声波法提取小球藻多糖最优条件为:料液比1∶15g/mL,pH7,温度60℃,时间30min,小球藻多糖提取得率为18.94mg/g。
3.2 采用双酶法水解小球藻蛋白的最优条件为:底物浓度100g/L,混合酶量12000U/g,pH6.5,温度55℃。在最优水解条件下做验证实验,小球藻蛋白水解度达27.83%。
3.3 在以上最优组合工艺条件下研制出的小球藻保健饮料成品呈现清亮的黄绿色,无明显藻腥味,风味独特,具有良好口感。
[1]陈晓清,郑怡,苏育才.海水小球藻抗菌多糖的分离纯化[J].食品科技,2012,37(4):168-170.
[2]孔维宝,李龙囡,张继,等.小球藻的营养保健功能及其在食品工业中的应用[J].食品科学,2010,31(9):323-328.
[3]陈晓清,苏育才.小球藻的应用研究进展[J].生物学教学,2012,37(1):8-9.
[4]胡开辉,汪世华.小球藻的研究开发进展[J].武汉工业学报,2005,24(3):27-32.
[5]黄燕娟,王小芬,陈向凡.小球藻的营养及药用价值[J].现代生物医学进展,2013,32(9):25-28.
[6]杨鹭生,李国平,陈林水. 蛋白核小球藻粉的蛋白质、氨基酸含量及营养价值评价[J]. 亚热带植物科学,2003,32(1):36-38.
[7]刘海琴,韩士群.小球藻提取物的生物活性研究[J]. 海洋科学,2005,29(9):23-26.
[8]钟瑞敏.酶解小球藻保健饮品工艺研究[J].食品科学,2002,23(9):68-71.
[9]施瑛.蛋白核小球藻多糖制备及其增强免疫力功能的研究[D].江苏:南京大学,2005.
[10]惠秋沙.苯酚-硫酸法测定玉米须保健饮料中多糖的含量[J].农产品加工,2011(7):89-91.
[11]钟振声,陈钰,文锡莲.木瓜蛋白酶与中性蛋白酶水解大豆分离蛋白的研究[J].现代食品科技,2009,25(9):1039-1042.
[12]刘四光,李文权,邓永智.海洋微藻多糖微波提取法研究[J].海洋通报,2007,26(4):105-110.
[13]张红梅,陶敏慧,刘旭,等.双酶法酶解大豆蛋白制备大豆低分子肽的研究[J].中国油脂,2008,33(3):23-25.
[14]孙宜君,常蓉,张娇,等.双酶法制备螺旋藻多肽的工艺研究[J].天然产物研究与开发,2012,24:1468-1473,1342.
Study on the health drink ofChlorella
PANG Ting-cai1,2,3,HU Shang-ying3,XIONG Zheng3,DENG Dong-ling1,2,3,LI Li-yan3
(1.Guangxi Key Laboratory of Beibu Gulf Marine Biodiversity Conserration,Qinzhou 535099,China;2.Guangxi Colleges and Universities Key Laboratory of Exploitation and Protection of Beibu Gulf Marine Biological Resources,Qinzhou 535099,China;3.Qinzhou University,Qinzhou 535099,China)
WithChlorellapowder as raw material,the algae polysaccharide was extracted by the method of ultrasonic assisted,then papain and neutral protease were used to hydrolyze alga protein. A kind of health drink was manufactured by adding right amount honey,sugar and citric acid into the filtrate. The optimal extraction condition by orthogonal test was as follows:solid-liquid ratio of 1∶15(g∶mL),pH7.0,extraction temperature of 60℃,extraction time 30min,under which condition,extraction yield ofChlorellapolysaccharide was 18.94mg/g.The optimal condition of hydrolyzing alga protein was as follows:substrate concentration of 100g/L,the amount of composite enzyme of 12000U/g,pH6.5,temperature of 55℃. Under which the degree of hydrolysis ofChlorellaprotein was up to 27.83%. The nutritional health drink was obtained with rich nutrition,unique flavor .
Chlorella;polysaccharide;protein;drinks
2014-06-11
庞庭才(1985-),男,硕士,研究方向:海藻食品开发与研究。
广西高校科学技术研究项目(2013YB260); 广西高校科学技术研究项目(2013LX161);广西北部海洋生物多样性养护重点实验室、北部湾海洋生物资源开发与保护重点实验联合资助(2015ZC01)。
TS201.2
B
1002-0306(2015)07-0252-06
10.13386/j.issn1002-0306.2015.07.045
