羟丙基-β-环糊精对吴茱萸次碱的增溶作用研究
2015-05-08唐慧慧蔡清宇
唐慧慧,杜 珍,蔡清宇
吴茱萸次碱是Asahina于1915年首次从吴茱萸中分离出来的一种生物碱[1],属喹唑啉酮咔啉生物碱,相对分子质量282.37,难溶于水和甲醇、乙醇,微溶于氯仿、二甲基亚砜,是属于难溶于水的药物。研究发现它们具有许多潜在的药用价值,包括心脏保护作用[2]、胃黏膜保护作用[3]、抗炎[4]、抑菌、抗过敏[5]、抗动脉粥样硬化[6]、抑制血管平滑肌细胞增殖[7]、免疫抑制[8]、抗癌[9]等生物活性。其抗高血压作用可能与激动辣椒素受体(VRl),促进降钙素基因相关CGRP的合成和释放有关[10-11],且对心脏具有保护作用。因此,吴茱萸次碱可能是一种潜在的新型抗高血压药物。
羟丙基-β-环糊精(HP-β-CD)近年来开发的一种药用辅料,具有水溶解度高,热稳定好,对肾脏无毒,对肌肉和黏膜几乎无刺激性、溶血作用小,可用于改善药物的生物利用度,改变药物状态便于制剂,掩盖药物的不良气味和降低刺激性,促进药物的吸收,是美国食品药品监督管理局批准的第1个可供静脉注射的β-CD衍生物。因此,HP-β-CD在药物制剂领域得到广泛应用[12-14]。
本研究采用包合技术,制备吴茱萸次碱-HP-β-环糊精包合物,以提高吴茱萸次碱水溶性,通过粉末X射线衍射法,红外光谱法以及差示扫描量热法对包合物进行了鉴定和表征,采用高效液相色谱法测定了包合物的溶解度,为吴茱萸次碱新药开发和临床应用研究提供实验数据。
1 材料与试剂
1.1 材料
Bruker D8 ADVANCE X-Ray粉末衍射仪(德国),NETZSCH DSC 204 F1差示扫描量热仪(德国),Nicolet 5700型傅里叶变换红外光谱仪(美国热电公司Thermo),Agilent 1200高效液相色谱仪(美国)。
1.2 试剂
吴茱萸次碱(C11H14N2O1,陕西慧科植物开发有限公司,纯度 >98.5%),HP-β-环糊精(北京西美杰科技有限公司),吴茱萸次碱对照品(批号110802-201006,中国食品药品检定研究院),其他试剂均为分析纯。
2 方法与结果
2.1 包合物的制备
采用超声法制备吴茱萸次碱-HP-β-CD包合物。称取与HP-β-CD等摩尔比的吴茱萸次碱样品,用10 mL无水乙醇溶解,HP-β-CD用适量蒸馏水溶解,将吴茱萸次碱乙醇溶液缓慢加入HP-β-CD的水溶液中,于40℃下置于超声清洗仪上,在300W的功率下超声4 h,超声完成后,经0.45 μm 微孔滤膜过滤,滤液冷冻干燥即得吴茱萸次碱-HP-β-CD包合物。
吴茱萸次碱-HP-β-CD物理混合物的制备:按照摩尔比1∶1精密称取HP-β-CD与吴茱萸次碱样品,放入研钵中轻轻研磨30 s,即得吴茱萸次碱-HP-β-CD物理混合物。
2.2 包合物的鉴定与表征分析
2.2.1 粉末X射线衍射(PXRD)实验 X射线衍射图谱的摄取采用D8 ADVANCE vertical goniometer,Ni-filter单色器,Theta/Theta连续扫描,电压 40 kV,电流40 mA,扫描速度8°/min,LynxEye检测器,扫描范围3°~80°。结果见图1。
由图谱可见吴茱萸次碱为晶态化合物,表现为尖锐的特征衍射峰,HP-β-CD为非晶态化合物,表现为宽的弥散衍射峰;吴茱萸次碱-HP-β-CD物理混合物的主要衍射峰为两种成分的叠加,吴茱萸次碱-HP-β-CD包合物为非晶态化合物,表现为弥散衍射峰,从包合物的图谱中未见吴茱萸次碱的衍射峰,这说明通过包合制备过程吴茱萸次碱与HP-β-CD形成新的物相。

图1 粉末X射线衍射图谱
2.2.2 差示扫描量热分析(DSC)测定 样品的DSC采用NETZSCH DSC 204 F1型差热分析仪测定,N2气流保护,空铝坩埚作参比物,扫描范围30~330℃,升温速率10℃/min。测定结果见图2。
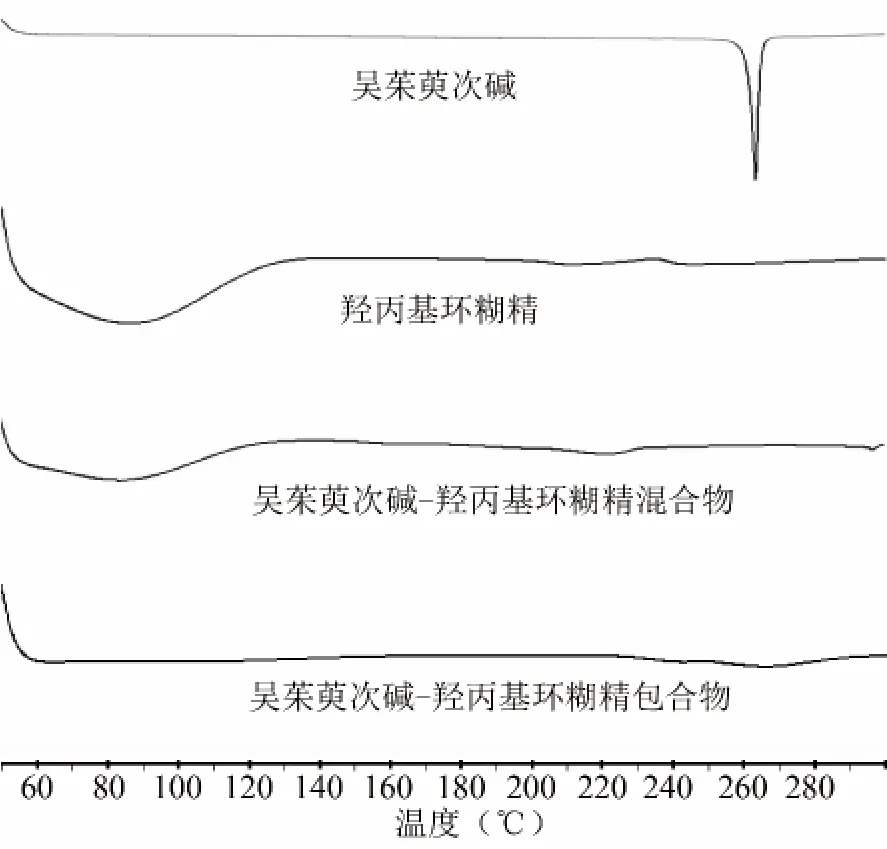
图2 差方扫描星测定图谱
DSC测定结果表明,吴茱萸次碱在262.29℃有尖锐的吸热峰,表明吴茱萸次碱为晶态化合物,HP-β-CD在60.81℃有1个宽化的吸热峰,表明 HP-β-CD为非晶态,吴茱萸次碱-HP-β-CD物理混合物在84.29℃仍可见 HP-β-CD的吸热峰,但在262℃左右,未见吴茱萸次碱的吸热峰,表明,在加热过程中。吴茱萸次碱与HP-β-CD发生共融。而吴茱萸次碱-HP-β-CD包合物中在测定范围中未见明显的HP-β-CD和吴茱萸次碱的熔点吸热峰,表明了新的物质的生成。结果见图2。
2.2.3 红外光谱分析(IR) 红外光谱测定采用傅里叶变换红外光谱仪:Nicolet 5700型,美国热电公司(Thermo),光谱范围 4 000 ~650 cm-1,分辨率4.000 cm-1,扫描16 次。

图3 红外光谱测定图谱
红外光谱分析表明,吴茱萸次碱的红外光谱中可见明显的C O、苯环、NH红外吸收峰,通过超声法获得吴茱萸次碱-HP-β-CD包合物,包合物中主要体现环糊精的C—O伸缩振动,吴茱萸次碱的骨架C C、C O的伸缩振动特征峰发生变化,氢键区向长波数方向移动,表明吴茱萸次碱与HP-β-CD产生了包合作用。
2.3 包合物的溶解度测定
2.3.1 测定波长的选择 分别将HP-β-CD、吴茱萸次碱-HP-β-CD包合物的水溶液和吴茱萸次碱的甲醇溶液在190~400 nm波长范围进行紫外扫描,吴茱萸次碱溶液在213 nm,343 nm与360 nm波长处有强烈而稳定的吸收峰,吴茱萸次碱-HP-β-CD包合物水溶液与吴茱萸次碱的最大吸收波长一致,而HP-β-CD的最大吸收在205 nm。故最终选择343 nm为检测波长。
2.3.2 标准曲线的制备 精密称取吴茱萸次碱对照品12.50 mg,移至50 ml容量瓶中,用甲醇定容,配制成浓度为250 mg/L储备液。分别精密吸取0.2、0.4、0.6、1.0、2.0、4.0、6.0 ml,至 10 ml容量瓶中,用甲醇稀释至刻度,获得7种梯度浓度样品。分别精密吸取7种浓度溶液各10 μl注入液相色谱仪,检测条件:色谱柱Agilent Eclipse XDB C18(250×4.6 mm,5 μm);乙腈为流动相;0.5%冰醋酸水溶液(75∶25);流速1.0 ml/min;柱温 30 ℃;进样量 10 μl;重复进样 3次,记录色谱图及峰面积,得标准曲线方程Y=44.752X+72.952(r=0.999 3,n=7),在5 ~150 μg/L浓度范围内线性关系良好。
2.3.3 方法学考察 按照药典要求,分别精密称取一定量的吴茱萸次碱,加甲醇溶解,制成相应的溶液,进行精密度考察,重复性考察,稳定性考察以及回收率考察,结果表明,精密度考察的6份样品平均峰面积RSD值为0.33%,重复性考察的6份样品平均峰面积RSD值为0.68%,稳定考察在12 h内测定RSD值为0.75%,回收率考察的6次测量平均回收率及RSD,分别为101.1%和0.82%。由此说明建立的高效液相色谱法测定吴茱萸次碱含量的检测分析方法良好。
2.3.4 溶解度测定 利用建立的标准曲线,采用高效液相色谱法,分别测定吴茱萸次碱、吴茱萸次碱-HP-β-CD包合物在水中的溶解度,结果发现,吴茱萸次碱在水中不溶,吴茱萸次碱-HP-β-CD物理混合物的溶解度为 2.23 μg/ml,吴茱萸次碱-HP-β-CD 的溶解度为90.40 μg/ml,包合物在水中的溶解度增加明显。表明通过包合作用,吴茱萸次碱的水溶性得到显著性的提高。
3 结论
吴茱萸次碱是属于难溶于水的天然活性成分,具有开发成为新型抗高血压的潜在趋势。本实验利用HP-β-CD具有环形中空的筒状结构,可以作为主体与其它化合物分子形成超分子结构,从而改变客体的理化性质,明显增加了吴茱萸次碱在水中的溶解度,为吴茱萸次碱的进一步开发提供了研究基础。常用的包合物制备方法有饱和水溶液法、研磨法、超声法、冷冻干燥法、喷雾干燥法,液-液法和气-液法。本文通过超声法制备获得吴茱萸次碱-HP-β-CD包合物,该方法操作简单,条件易控,具有时间短,速度快,节省能源,效率高的优点,值得推广使用。
本文采用高效液相色谱法考察了吴茱萸次碱-HP-β-CD包合物的增溶效果,发现制备的吴茱萸次碱-HP-β-CD 包合物的溶解度为90.40 mg/L,与吴茱萸次碱不溶于水的性质比较,表明通过包合作用可明显提高吴茱萸次碱在水中的溶解度,由此提高了吴茱萸次碱药物的生物利用度和适用范围,为吴茱萸次碱制剂的开发奠定了研究基础。
[1] 王翠玲,刘建利,令亚萍.吴茱萸次碱的合成进展[J].有机化学,2006,26(10):1437-1443.
[2] Li JZ,Peng J,Xiao L,et al.Reversal of isoprenaline-induced cardiac remodeling by rutaecarpine via stimulation of calcitonin gene-related peptide production[J].Can J Physiol Pharmacol,2010,88(10):949-959.
[3] Wang L,Hu CP,Deng PY,et al.The protective effects of rutaecarpine on gastric mucosa injury in rats[J].Planta Med,2005,71(5):416-419.
[4] Ko HC,Wang YH,Liou KT,et al.Anti-inflammatory effects and mechanisms of the ethanol extract of Evodia rutaecarpa and its bioactive components on neutrophils and microglial cells[J].Eur J Pharmacol,2007,555(2-3):211-217.
[5] Shin YW,Bae EA,Cai XF,et al.In vitro and in vivo antiallergic effect of fructus of evodia rutaecarpa and its constituents[J].Biol Pharm Bull,2007,30(1):197-199.
[6] Xu Y,Liu Q,Xu Y,et al.Rutaecarpine suppresses atherosclerosis in ApoE-/-mice through upregulating ABCA1 and SR-BI within RCT[J].J Lipid Res,2014,55(8):1634-1647.
[7] Li YJ,Zhang F,Gong QH,et al.Rutaecarpine inhibits angiotensin II-induced proliferation in rat vascular smooth muscle cells[J].Chin J Integr Med.,2014,20(9):682-687.
[8] Eon TW,Jin CH,Lee SK,et al.Immunosuppressive effects of rutaecarpine in female BALB/c mice[J].Toxicol Lett,2006,164(2):155-166.
[9] Zhao N,Li ZL,Li DH,et al.Quinolone and indole alkaloids from the fruits of Euodia rutaecarpa and their cytotoxicity against two human cancer cell lines[J].Phytochemistry,2015,109:133-139.
[10] Yi HH,Rang WQ,Deng PY,et al.Protective effects of rutaecarpine in cardiac anaphylactic injury is mediated by CGRP[J].Planta Med,2004,70(12):1135-1139.
[11] Yu J,Tan GS,Deng PY,et al.Involvement of CGRP in the inhibitory effect of rutaecarpine on vasoconstriction induced by anaphylaxis in guinea pig[J].Regul Pept,2005,125(1-3):93-97.
[12]缪菊连,黄照昌.羟丙基-β-环糊精对人参皂苷Rg1溶解度的影响[J].中国实验方剂学杂志,2011,17(21):17-19.
[13]杨彩琴,王静,纪桂霞.羟丙基-β-环糊精对双苯氟嗪包合作用的热力学研究[J].化学研究与应用,2010,22(4):495-498.
[14]张学农,唐丽华,阎雪莹,等.羟丙基-β-环糊精对紫杉醇的增溶作用及其分子包合机制研究[J].中草药,2007,38(9):1317-1320.
