肺癌CT影像学特征与组织类型的相关性研究
2015-05-08方思月
方思月,杨 涟
(南京医科大学附属江宁医院,江苏南京211100)
肺癌CT影像学特征与组织类型的相关性研究
方思月,杨 涟
(南京医科大学附属江宁医院,江苏南京211100)
根据肿瘤统计结果,肺癌是我国男性患者中最常见的癌症类型和最主要的肿瘤致死原因。2000-2005年,我国肺癌的发病人数增加了11.6万,死亡人数增加了10.1万。肺癌5年生存率仅约15.6%,主要原因是约75%的患者在诊断时已属晚期肺癌[1,2]。肺癌可因早期诊断不足而致预后差,从组织学来看,腺癌在肺癌中占38.5%,是最常见的一种类型,由于腺癌呈贴壁式生长(是指肿瘤细胞沿着肺泡生长,没有基质,血管以及胸膜侵袭),在CT中多表现为磨玻璃密度影(GGO),近年来多排螺旋CT技术的应用使得很多小GGO结节发现率大为提高。肺癌病理组织学对于肺癌的预后判断和治疗非常关键,但在一般情况下要通过手术,支气管镜或者穿刺才能了解患者的病理结果[3,4],而很多患者可能不具备获得病理标本的条件,因此通过无创技术(如CT)对患者进行组织学分类意义重大,对手术和治疗方法的选择有重要的指导意义[5],但是,就我们所知,目前国内还没有系统性研究观察CT结果与肺癌组织类型之间的关系,因此本次研究的目的是检测CT结果能否为肿瘤组织学预测提供特征性指标,以及这些特征是否与肿瘤大小和分型有关。
1 对象和方法
1.1 研究对象
研究对象为2010年7月到2014年5月间经病理学确诊为肺癌的患者。入选病例符合如下标准(1)患者术前在我院有进行胸部CT扫描的结果。(2)有相关病理学检验结果报告(我院及三级以上医院)。(3)定期在我院进行随访,临床资料完整。(4)无其它严重肺部疾病或者其它部位的恶性肿瘤。
1.2 CT技术和图像分析
所有病人经我院Philips Brilliance 16层螺旋CT扫描。技术参数为:管电压,120kV;X-射线管电流,240-340mA;FOV 330mm×330mm,采集矩阵512×512,采集厚度5mm。扫描后如发现病灶,即做图像后处理,重建采用1mm层厚,WC:35,WW:350;Lung Enhanced过滤模式,在我院HIS系统下中联PACS影像工作站,调节到最适合窗宽窗位,由2名副主任医师评估CT结果,肿瘤的影像学特征主要包括,有无分叶、毛刺征、支气管气相、空洞、胸部凹陷(图1B、C、D、E、F)。其中分叶定义为:结节边缘不规则;毛刺征:从结节向肺实质延展出2 mm或更厚的索条,但没有到达胸膜表面;支气管气相:在结节病灶中见到含气的支气管影;空洞:肺结节内的透亮区;胸膜凹陷:源于结节表面的索带牵涉到胸膜表面。对每个结节最大横向、最短横向以及纵向直径进行测量,计算分叶和毛刺征的密度,横向最大直径和纵向直径与横向最短直径之间的比值[69]。分叶(毛刺)密度是指分叶(毛刺)数量与结节横向最大直径的比值。分析检测结果的平均值。
1.3 统计学分析
使用kappa值或Bland-Altman分析评估观察者之间的一致性。使用卡方检验或Kruskal-Wallis检验比较3组数据之间的差异。使用SPSS17.0统计学分析软件,P值<0.05有显著性差异。
2 结果
2.1 在2010年7月到2014年5月间,有完整资料的原发性肺癌病例,治疗前在我院均做了CT检查,根据不同途径(经皮穿刺、气管镜下穿刺、外科手术)的病理结果的调查,96例,其中男66例,女30例;平均年龄,67±9.5岁;56例腺癌,33例鳞状细胞癌和7例小细胞癌进入试验研究。
2.2 观察者一致性
两名放射学医生诊断结果的kappa值为:分叶,0.61;毛刺征,0.72;支气管气相,0.78;空洞,0.76;胸膜凹陷,0.90,提示二者一致性较好。Bland-Altman分析横向最大,纵向以及横向最短直径的95% CI分别为[-2.3,6.3],[-3.4,3.9]和[-2.8,5.3],提示两人测量之间的一致性较好。
2.3 重建CT结果
通过比较不同组织学类型肿瘤的CT检测特点(表1),发现支气管气相(P<0.01)是唯一具有显著性差异的因素。腺癌中支气管气相的发生率显著高于鳞状细胞癌(P<0.01)和小细胞癌(P<0.01)。判别分析显示支气管气相是肺部腺癌的判断因素(分类功能系数:2.374;P=0.001)。CT结果和肿瘤大小的关系(表2),结果显示随着肿瘤体积的增大,分叶(P<0.01),毛刺征(P<0.01),胸膜凹陷(P<0.01)的发生率以及分叶(P<0.01)和毛刺征(P<0.01)密度均值呈显著正向线性相关,而纵向直径与横向最短直径之间的比值则表现出显著负向线性相关(P=0.02)。而腺癌,鳞状细胞癌和小细胞癌的发生率与肿瘤大小无关(P=0.224)。

图1 A,57岁,男性,腺癌,显示支气管气相;B,64岁,男性,高分化腺癌,显示支气管气相;C、D、E、F分别显示胸膜凹陷征、分叶征、毛刺征、小坏死空洞。
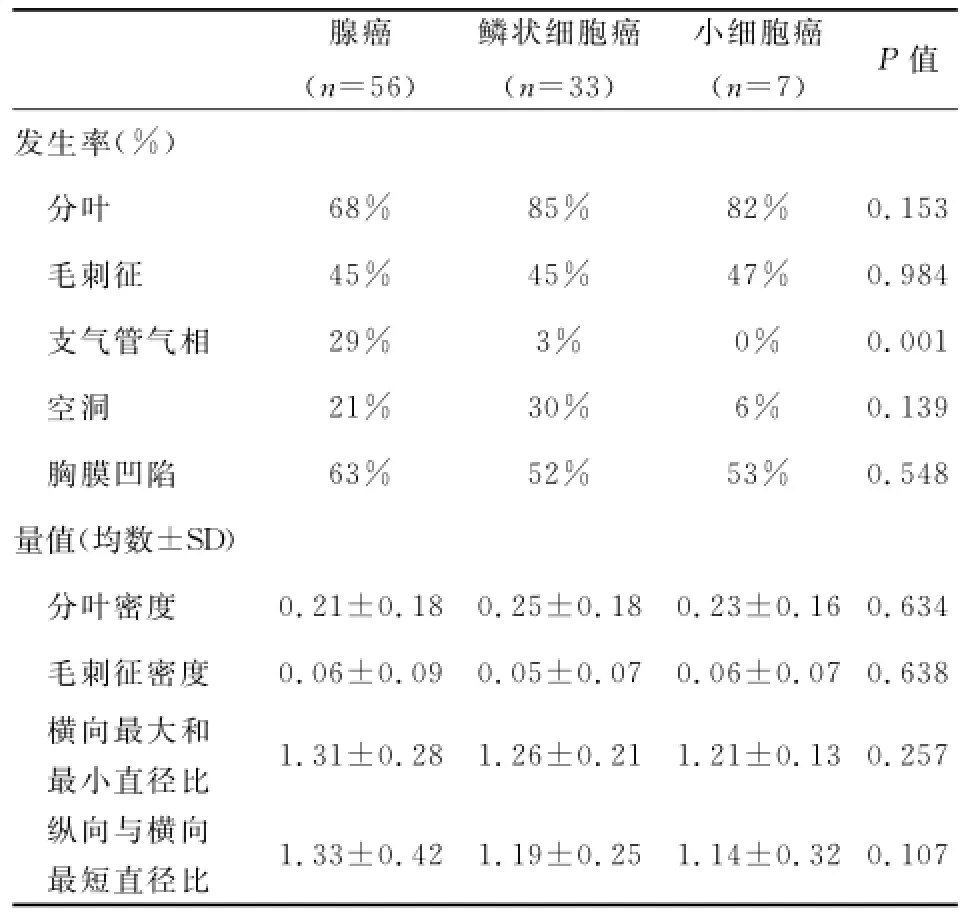
表1 CT结果与肿瘤组织学特征之间的关系
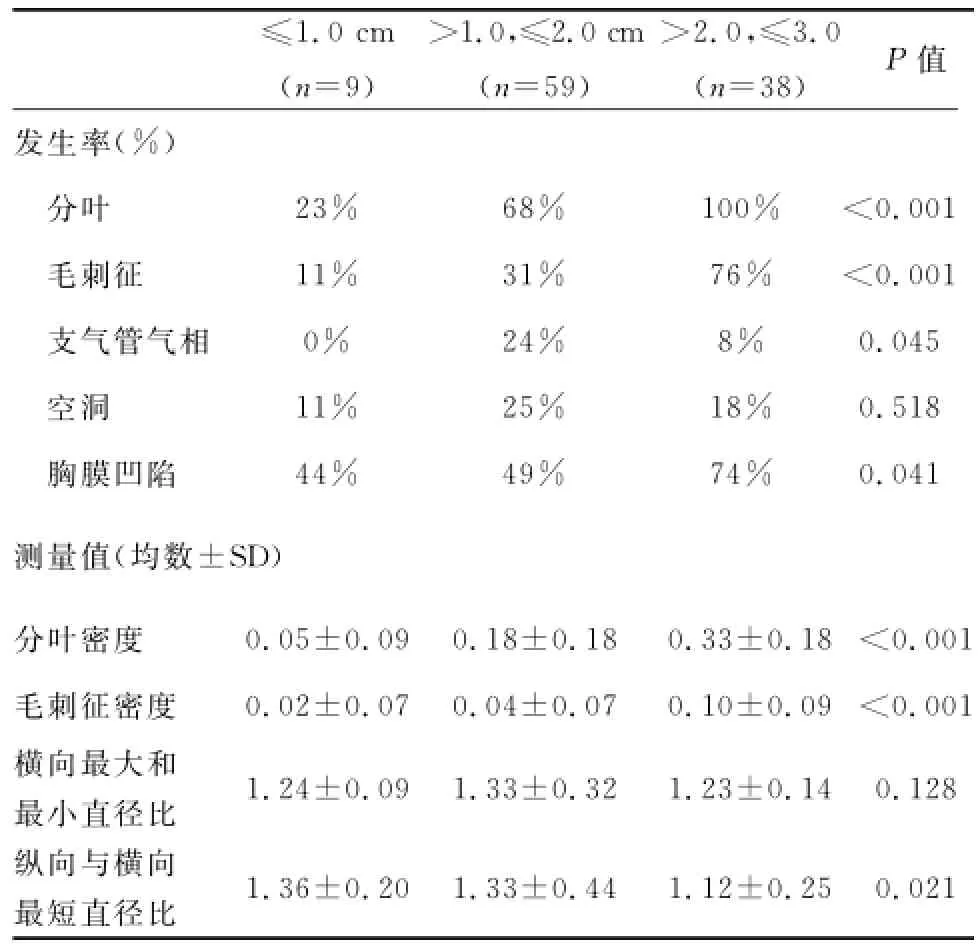
表2 CT结果与肿瘤大小的关系
3 讨论
肺癌是因支气管树或其末梢位置的上皮出现恶变导致的,临床上肺癌有多种组织类型但其起源均是上皮基底层细胞,对其病理组织类型和影像学征象的相关性进行深入研究有重要意义。我们认为肺癌不同病理组织类型有不同的生物细胞学的特点,而这种特点必然在生长规律方面有差异表现,包括肿瘤自身的体积、形态及和周围组织的关系等。这些都能够通过影像学有所了解进而对病理组织做出判断[10]。
在本次分析中,肺癌CT结果显示支气管气相是确定腺癌的显著性因素。这种征象在良性和恶性肿瘤中均可见到,但更常见于恶性肿瘤,特别是腺癌中,我们推测这是因为病理学上,起源于支气管上皮细胞的肺癌有二种主要的生长模式:一是肺泡细胞的替代式生长,二是压榨或破坏性的生长模式。在压榨或破坏性生长模式中,肿瘤细胞大量增殖,支气管内肿瘤体积不断增大,引起支气管阻塞。而在替代性生长模式中,肿瘤细胞向外爬,沿着肺泡壁和肺泡隔叶爬出肺泡孔,最终可形成支气管气相[11,12]。因此在替代性或壁式生长为主的腺癌中支气管气相更为常见(图1A、B)。国外一些试验对支气管气相与临床和病理的关系进行了研究,也发现这种现象是腺癌的特征性表现。例如,Akata S[13]等研究了40例直径<2cm肿瘤(20例腺癌和20例良性肿瘤),发现支气管气相的发生率在腺癌中为65%,良性肿瘤中只有5%。因此他们认为肺癌中的支气管气相可以用于区分良性肿瘤和腺癌,这和我们的结论是基本符合的。研究中我们发现分叶,毛刺征,胸膜凹陷以及分叶和毛刺征密度这些影像学特点与肿瘤体积之间存在显著正相关,纵向与横向最短直径之间的比值与肿瘤体积之间则呈负相关,目前所知还没有文献报道这一结果[14],我们推测这是因为肿瘤细胞具有异源性分化,特别是在肿瘤生长的边缘,随着肿瘤细胞的生长,肿瘤内部和周围的微环境异质性越来越显著,导致分叶现象的出现[15]。这种现象还可能与肿瘤分化因子的导向以及肿瘤向淋巴扩散的有关,因此随着肿瘤的增大会出现了更多的特征性表型,毛刺征和胸膜凹陷的发生率提高。而纵向与横向最短直径之间的比值逐渐变化提示肿瘤越长越圆。有试验指出毛刺征与恶性肿瘤发生风险有关,但本研究没有发现其与肺癌亚型之间有任何相关性(表2)。
我们的试验提示由于支气管气相是肺部实体腺癌的特征性指标,CT可以利用这一特征对腺癌和其他周围实体肺癌进行组织学判别。一般来说非小细胞肺癌(NSCLC)患者的预后比小细胞肺癌(SCLC)患者预后要好,有GGO表现的腺癌患者预后好于组织学表现不同的NSCLC患者。从病理学观点来看[16],有支气管气相的肿瘤处于从GGO发育到完全实体瘤的中间态,因此支气管气相出现在说明患者预后较好,这一结果是有重要的临床意义[17,18]。此外研究的结果为CT对肺癌的组织学预测提供重要证据,同时能判断周围型实体肺癌患者的预后并优化治疗方案。CT还可以用于不适于接受手术切除以及不愿意接受手术的患者进行合理的组织学诊断。
总之,CT中支气管气相是肺部实体腺癌的特征性指标。其他的CT结果(分叶,毛刺征,空洞,胸膜凹陷,分叶和毛刺征密度,以及纵向与横向最短直径的比例)与肿瘤组织学特征没有关系,只与肿瘤大小有关。
[1]白春学.肺癌筛查现状与争议[A].王辰.呼吸与危重医学[C].北京:人民卫生出版社,2012:455-459.
[2]白春学.肺结节“三加二式诊断法”[J].国际呼吸杂志,2013,33:401.
[3]Goo JM,Park CM,Lee HJ.Ground-glass nodules on chest CT as imaging biomarkers in the management of lung adenocarcinoma[J].Am J Roentgenol,2011,196(31):533.
[4]Ren J,Zhou J,Ding W,et al.Clinicopathological characteristics and imaging features of pulmonary adenocarcinoma with micropapillary pattern[J].Zhonghua Zhong Liu Za Zhi,2014,36(4):282.
[5]Hansell DM,Bankier AA,MacMahon H,et al.Fleischner Society:glossary of terms for thoracic imaging[J].Radiology,2008,246(22):697.
[6]Ge X,Gao F,Li M,et al.Diagnostic value of solid component for lung adenocarcinoma shown as ground-glass nodule on computed tomography[J].Zhonghua Yi Xue Za Zhi,2014,94(13):1010.
[7]Godoy MC,Naidich DP.Subsolid pulmonary nodules and the spectrum of peripheral adenocarcinomas of the lung:recommended interim guidelines for assessment and management[J].Radiology,2009,253(131):606.
[8]Lu P,Sun Y,Sun Y,et al.The role of(18)F-FDG PET/CT for evaluation of metastatic mediastinal lymph nodes in patients with lung squamous-cell carcinoma or adenocarcinoma[J].Lung Cancer,2014,85(1):53.
[9]Isaka T,Yokose T,Ito H,et al.Comparison between CT tumor size and pathological tumor size in frozen section examinations of lung adenocarcinoma[J].Lung Cancer,2014,85(1):40.
[10]Lee HY,Lee KS.Ground-glass opacity nodules:histopathology,imaging evaluation,and clinical implications[J].J Thorac Ima-ging,2011,2698):106.
[11]Zhang Y,Qiang JW,Ye JD,et al.High resolution CT in differentiating minimally invasive component in early lung adenocarcinoma[J].Lung Cancer,2014,84(3):236.
[12]Yamazaki M,Ishikawa H,Kunii R,et al.Relationship between CT features and high preoperative serum carcinoembryonic antigen levels in early-stage lung adenocarcinoma[J].Clin Radiol,2014,69(6):559.
[13]Akata S,Yoshimura M,Nishio R,et al.High-resolution computed tomographic findings of small peripherally located squamous l cell carcinoma[J].Clin Imaging,2008,32(10):259.
[14]Zhang Y,Cheng D,Shi H,et al.Micro-SPET/CT and histology results of zoledronate treatment in a nude mouse lung adenocarcinoma skeletal metastases model:apilot study[J].Hell J Nucl Med,2013,16(3):240.
[15]Hashimoto M,Miyauchi T,Heianna J,et al.Accurate diagnosis of peripheral small cell lung cancer with computed tomography[J].Tohoku J Exp Med,2009,217(107):217.
[16]Hansell DM,Bankier AA,MacMahon H,et al.Fleischner Society:glossary of terms for thoracic imaging[J].Radiology,2008,246(12):697.
[17]Shimada Y,Yoshida J,Hishida T,et al.Predictive factors of pathologically proven noninvasive tumor characteristicsin T1aN0M0peripheral non-small cell lung cancer[J].Chest,2012,141(35):1003.
[18]Rocco G,Internullo E,Cassivi SD,et al.The variabilityof practice in minimally invasive thoracic surgeryfor pulmonary resections[J].Thorac Surg Clin,2008,18(4):235.
2014-12-27)
1007-4287(2015)09-1523-04
