GBE抑制UⅡ介导的大鼠心肌成纤维细胞ECM合成和分泌作用
2015-05-08赵外欧李相军孙文悦
赵外欧,李相军,孙文悦
(1.吉林大学白求恩第一医院心血管中心,吉林长春130021;2.吉林大学药学院;3.吉林大学中日联谊医院)
GBE抑制UⅡ介导的大鼠心肌成纤维细胞ECM合成和分泌作用
赵外欧1,李相军2,孙文悦3*
(1.吉林大学白求恩第一医院心血管中心,吉林长春130021;2.吉林大学药学院;3.吉林大学中日联谊医院)
目的 探讨银杏叶提取物(GBE)对尾加压素Ⅱ(UⅡ)介导的成纤维细胞(CFs)过度合成和分泌ECM的抑制作用。方法 以UⅡ刺激原代培养的新生大鼠心肌CFs,同时加入GBE进行干预,以比色法测定培养上清中的羟脯氨酸含量,以ELISA法测定培养细胞中Ⅰ型胶原(ColⅠ)含量,以Real-time PCR法测定各组细胞中TGF-β和CTGF mRNA表达。结果 与正常对照组比较,UⅡ处理组细胞培养上清中羟脯氨酸及Col I含量显著增加(P<0.05);与UⅡ处理组比较,GBE高、中剂量组培养上清中羟脯氨酸及Col I含量均显著降低(P<0.05),GBE低剂量组羟脯氨酸含量亦较UⅡ处理组明显降低(P<0.05);Real-time PCR结果显示,与正常对照组比较,UⅡ处理组细胞TGF-β及CTGF mRNA表达显著增加(P<0.05);与UⅡ处理组比较,GBE高、中、低3个剂量组TGF-β表达量均下降(P<0.05),而对CTGF,仅高剂量组有明显统计学意义(P<0.05)。结论 GBE抑制CFs胶原过度合成和分泌作用可能是通过其抑制TGF-β、CTGF途径实现的。
银杏叶提取物;尾加压素Ⅱ;心肌成纤维细胞;胶原
(Chin J Lab Diagn,2015,19:1444)
心肌成纤维细胞(CFs)是心肌间质的主要细胞成分,可合成和分泌细胞外基质(ECM)参与心肌重构过程,因此,CFs是心肌纤维化的主要效应细胞。尾加压素Ⅱ(UⅡ)是一种是进化上高度保守的血管活性肽,可刺激包括CFs在内的多种细胞增殖,直接或间接参与多种组织器官纤维化进程[1]。TGF-β和CTGF是目前公认的、参与包括心肌纤维化在内的多种组织或器官纤维化进程的重要细胞因子[2]。Rosin等[3]研究发现,TGF-β和CTGF在血管紧张素Ⅱ(AngⅡ)介导的大鼠心肌纤维化过程中起重要调节作用。银杏叶提取物(GBE)是从银杏叶中提取出来的具有重要药用价值的物质,具抗氧化、抗器官纤维化等多种生物学活性[4],但其对CFs ECM分泌作用的影响目前尚未见报道。本研究旨在探讨银杏叶提取物(GBE)对UⅡ介导的CFs过度合成和分泌ECM的抑制作用,并对其可能机制进行初步探讨,以期为阐明心肌纤维化机制及GBE临床应用提供依据。
1 材料和方法
1.1 实验动物和主要试剂 新生Wistar大鼠(生后1-3d),由吉林大学实验动物中心提供。GBE(金纳多注射液)由德国威玛舒培博士药厂生产;UⅡ为Sigma产品;小鼠抗大鼠vimentin单克隆抗体、兔抗大鼠Ⅰ胶原抗体、HRP标记山羊抗兔多克隆抗体、SP免疫组化试剂盒、DAB显色系统均为北京中杉金桥生物公司产品;羟脯氨酸含量检测试剂盒由南京建成生物工程研究所生产;TransScript Green Two-Step qRT-PCR SuperMix试剂盒由北京全式金生物技术有限公司生产;TRizol、DMEM培养基、胎牛血清及胰蛋白酶均为美国Invitrogen公司产品;其他试剂均为国产或进口分析纯。
1.2 CFbs培养及鉴定[5]新生大鼠(出生后1-3 d)经消毒后断头处死。剪下心脏移入超净台中,将心脏剪成1mm3大小的组织块,置入锥形瓶中,加入0.25%胰蛋白酶。37℃水浴中磁力搅拌,消化所得的上清液中加入含20%小牛血清培养液6-8ml终止消化,以100目筛网过滤,将细胞悬液移入25ml培养瓶中,加小牛血清至5ml,于37℃、5%CO2孵箱中预培养2h后,弃去心肌细胞,获得心肌成纤维细胞。2-3d细胞生长至融合及亚融合状态时进行传代。贴壁的CFs呈梭形,境界清楚,胞体较大,胞质清明,细胞核较大,呈椭圆形。免疫组织化学染色证实培养细胞vimentin阳性。经上述方法鉴定后证实所培养细胞为CFs后,用于以下实验。
1.3 实验分组 经鉴定证实为CFs的细胞继续培养2-5代后,接种至6孔板继续培养24h待细胞完全贴壁后,分为正常对照组、UⅡ处理组及GBE高、中、低3个剂量组,其中正常对照组仅加入无血清DMEM培养液,UⅡ处理组加入含UⅡ10-8mol/L的无血清DMEM培养液,GBE高、中、低3个剂量组中GBE含量分别100nmol/L、50nmol/L和25nmol/L,同时含10-8mol/L的UⅡ,各组细胞分别加入条件培养基后,常规培养24h后分别无菌收集培养上清及细胞。每组设6个复孔,实验重复3次。
1.4 羟脯氨酸含量测定 按羟脯氨酸含量测定试剂盒说明书进行操作。主要步骤为:准确称取细胞培养上清0.5ml,加入水解液1ml,混匀后沸水浴20min,冷却后调pH至6.0-6.8,加活性炭吸附后取上清,按说明书进行显色反应,待反应结束后于550nm处,以双蒸水调零,测各样本吸光度值(A),按下式计算各样本羟脯氨酸含量:
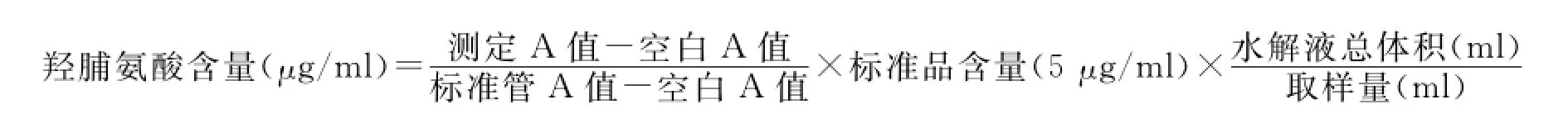
1.5 ColⅠ含量测定 采用酶联免疫吸附试验(ELISA)对各组培养细胞中ColⅠ进行测定。主要操作如下:将细胞培养上清液与碳酸盐包被缓冲液(pH 9.6)按1∶1加入96孔酶标中,100μl/孔,4℃过夜。次日吸弃上清后,于每孔加入5%小牛血清200μl于37℃孵育2h,以封闭非特异性抗原。洗板后加入兔抗大鼠Ⅰ胶原抗体(按1∶1 000稀释)100μl于37℃继续孵育2h,充分洗板后加入HRP标记山羊抗兔多克隆抗体(按1∶2 000稀释)继续于37℃继续孵育1h,充分洗板加入DAB显色液避光显色10min,终止反应后用酶标仪于490nm处测定每孔A值。
1.6 Real-time PCR 各组细胞经PBS充分洗涤后,加入1ml TRizol反复吹打以裂解细胞,加氯仿抽提、异丙醇沉淀制备细胞总RNA,所得RNA沉淀用70%乙醇洗涤后用无RNA酶水溶解用于逆转录。按二步法qRT-PCR说明书进行逆转录PCR。逆转录体系(总体积20μl)中含总RNA 1μg,5x SuperMix 4μl,gDNA Remover 1μl,42℃孵育15 min后85℃加热5s以灭活逆转录酶和gDNA Remover。Real-time PCR体系(总体积20μl)含上述逆转录模板1μl,上、下游引物(10μmol/L)各0.4 μl,2xqPCR Supermix 1μl,经94℃30s预变性后,进入PCR循环,条件为94℃5s,60℃30s,共45个循环。PCR所用序列为课题组自行设计,由上海捷瑞生物技术公司合成。所用引物序列为:TGF-β上游5′-CCAAGGAGACGGAATACAGG-3′,下游5′-GTGTGGTTGTAGAGGGCAAG-3′,扩增产物411bp。CTGF上游5′-CTAAGACCTGTGGAATGGGC-3′,下游5′-GGCAATGACTTTGACGTGTTTG-3′,扩增产物381bp。内参选用GAPDH,上游5′-ACCACAGTCCATGCCATCAC-3′,下游5′-TCCACCACCCTGTTGCTGTA-3′,扩增产物为450bp。以2-ΔΔCT作为目标产物的相对表达量[6]。
2 结果
2.1 各组培养细胞上清羟脯氨酸含量比较 与正常对照组比较,UⅡ处理组细胞培养上清中羟脯氨酸含量显著增加(P<0.05);与UⅡ处理组比较,GBE高、中、低3个剂量组培养上清中羟脯氨酸含量均显著下降(P<0.05),并显示出明显的剂量-效应关系,见表1。
2.2 各组细胞培养液中ColⅠ含量比较 ELISA法对各组细胞培养上清中ColⅠ含量检测结果显示,与正常对照组比较,UⅡ处理组细胞培养上清中Col I含量显著增加(P<0.05);与UⅡ处理组比较,GBE高、中、低3个剂量组培养上清中羟脯氨酸含量均下降,但仅高、中剂量组有统计学意义(P<0.05),见表1。
表1 各组培养细胞上清羟脯氨酸及ColⅠ含量比较(±s,n=6)

表1 各组培养细胞上清羟脯氨酸及ColⅠ含量比较(±s,n=6)
与正常对照组比较,*P<0.05;与UⅡ处理组比较,#P<0.05
组别羟脯氨酸含量(μg/ml)ColⅠ(A值)正常对照组UⅡ处理组GBE高剂量组GBE中剂量组GBE低剂量组0.35±0.04 0.78±0.09*0.57±0.05#0.62±0.09#0.69±0.06 43.32±5.24 68.24±5.83*46.07±5.19#54.28±5.12#62.78±4.31#
2.3 各组培养细胞TGF-β及CTGF mRNA表达比较
Real-time PCR结果显示,与正常对照组比较,UⅡ处理组细胞TGF-β及CTGF mRNA表达显著增加(P<0.05);与UⅡ处理组比较,GBE高、中、低3个剂量组TGF-β表达量均下降(P<0.05),而对CTGF,仅高剂量组有明显统计学意义(P<0.05),其他2组与UⅡ处理组比较,尽管也呈现出下降趋式,但差异不显著,见表2。
表2 各组培养细胞TGF-β及CTGF mRNA表达比较(±s,n=6)

表2 各组培养细胞TGF-β及CTGF mRNA表达比较(±s,n=6)
与正常对照组比较,*P<0.05;与UⅡ处理组比较,#P<0.05
组别TGF-βCTGF正常对照组UⅡ处理组GBE高剂量组GBE中剂量组GBE低剂量组1.00±0.14 1.68±0.18*1.37±0.11#1.58±0.17 1.65±0.15 1.01±0.11 1.75±0.18*0.96±0.06#1.29±0.07#1.54±0.12#
3 讨论
CFs是合成心肌胶原的主要细胞,除合成和分泌胶原外,还可产生胶原酶以降解胶原,因此CFs在调节心肌组织胶原代谢过程中起重要作用,是心肌纤维化及心肌重构的主要效应细胞。Zhang等[7]研究发现,UⅡ可加速异丙肾上腺素所介导的大鼠心肌纤维化进程,Chen等[8]发现UⅡ可刺激体外培养的新生大鼠CFs增殖,这些结果提示UⅡ可能是心肌纤维化的一个重要促进因素。本研究结果发现,UⅡ处理组羟脯氨酸含量及ColⅠ含量均较对照组明显升高,表明可刺激体外培养的CFs胶原合成与分泌。TGF-β是一个多功能的细胞因子,CTGF作为TGF-β的下游因子,具有较特异的促器官纤维化效应,参与许多生理病理过程。有研究表明,在UⅡ介导的CFs胶原合成过程中有TGF-β参与,因此,TGF-β、CTGF有可能是心肌纤维化的潜在治疗靶标[2]。本研究也发现,UⅡ可刺激体外培养的CFs TGF-β、CTGF mRNA表达,表明UⅡ促进二者分泌作用可能是在转录水平就开始了,抑制UⅡ活性即可通过抑制TGF-β、CTGF合成及分泌而致胶原成分的合成和分泌减少,从而抑制或延缓心肌纤维化进程。
GBE主要成分为黄酮类和萜类内酯化合物,具有清除氧自由基、拮抗血小板聚集和血栓形成、改善血流变状态等作用,主要用于心脏血管疾病的防治作用。随着研究的深入,也有学者认为GBE对肝纤维化有较好的防治效果。而且,GBE还可抑制肾间质成纤维细胞中糖基化终末产物诱导的TGF-β、CTGF mRNA的过表达。本研究结果显示,GBE可明显抑制UⅡ介导的CFs胶原成分过表达和分泌,并可抑制由UⅡ介导的TGF-β、CTGF mRNA的过表达,表明GBE抑制CFs胶原过度合成和分泌作用可能是通过其抑制TGF-β、CTGF途径实现的。
[1]Ross B,McKendy K,Giaid A.Role of urotensinⅡin health and disease[J].Am J Physiol Regul Integr Comp Physiol,2010,298(5):R1156.
[2]Leask A.Potential therapeutic targets for cardiac fibrosis:TGF-beta,angiotensin,endothelin,CCN2,and PDGF,partners in fibroblast activation[J].Circ Res,2010,106(11):1675.
[3]Rosin NL,Falkenham A,Sopel MJ,et al.Regulation and role of connective tissue growth factor in AngⅡ-induced myocardial fi-brosis[J].Am J Pathol,2013,182(3):714.
[4]Xiong XJ,Liu W,Yang XC,et al.Ginkgo biloba extract for essential hypertension:a systemic review[J].Phytomedicine,2014,21(10):1131.
[5]苗春生,张 丹,李相军.硒和维生素E对心肌成纤维细胞Ⅰ型胶原合成代谢的影响[J].吉林大学学报(医学版),2006,32(3):419.
[6]Oguri G,Nakajima T,Yamamoto Y,et al.Effects of methylglyoxal on human cardiac fibroblast:roles of transient receptor potential ankyrin 1(TRPA1)channels[J].Am J Physiol Heart Circ Physiol,2014,307(9):H1339.
[7]Zhang YG,Li YG,Liu BG,et al.UrotensinⅡaccelerates cardiac fibrosis and hypertrophy of rats induced by isoproterenol[J].Acta Pharmacol Sin,2007,28(1):36.
[8]Chen YL,Liu JC,Loh SH,et al.Involvement of reactive oxygen species in urotensinⅡ-induced proliferation of cardiac fibroblasts[J].Eur J Pharmacol,2008,593(1-3):24.
Prevention Effects of Ginkgobioba Extract on UrotensinⅡInduced Over-expression of Extracellular Matrix
ZHAO Waiou,LI Xiang-jun,SUN Wen-yue.(Center of Cardiovascular,The First Bethune Hospital of Jilin University,Changchun130021,China)
Objective To determine the prevention effects of ginkgobioba extract(GBE)on urotensinⅡ(UⅡ)induced over-expression of extracellular matrix(ECM).Methods The UⅡwas used to stimulus the cardiac fibroblast of the new born rats,and the GBE were added.The colorimetry was applied to determine the content of hydroxyproline and collgen I were detected by ELISA in various group.The expression of TGF-βand CTGF were evaluated by realtime PCR.Results Both hydroxyproline and collgen I in the UⅡ-treated group were higher significantly than the control group(P<0.05,that in the high-and middle-dose of GBE group were decreased significantly vs the UⅡ-treated group(P<0.05),the hydroxyproline in the low-dose of GBE group were also decreased markedly(P<0.05).The results of real-time PCR showed that compared with the control group,the TGF-βand CTGF mRNA is obviously increased(P<0.05),and the TGF-βmRNA level in all the three group and the CTGF mRNA level in the high-dose group were decreased significantly(P<0.05).Conclusion The GBE can depress the over expression of ECM in cardiac fibroblasts which induced by UⅡ,and the mechanism maybe have relationship of with TGF-βand CTGF.
ginkgobioba extract;urotensinⅡ;cardiac fibroblasts;collagen
R541.6
A
赵外欧(1971-),男,博士,主要从事心血管疾病诊治及机制研究。
2014-10-09)
1007-4287(2015)09-1444-04
*通讯作者
