椰纤果生产中椰子水自然发酵过程成分及微生物群落变化
2015-05-07杨一冲李从发邓健刘龙祥胡淇淞毕继才陈华美章翠刘四新
杨一冲,李从发,邓健,刘龙祥,胡淇淞,毕继才,陈华美,章翠,刘四新
(海南大学,海南海口570228)
椰纤果(nata de coco),又名椰果,是在食品工业中应用的细菌纤维素。椰纤果食品因富含膳食纤维、热值低、不含胆固醇,且口感脆嫩爽滑一直在中国及其他东南亚地区热销不衰。其实,椰纤果由于就是细菌纤维素、具有许多优良特性,如化学纯度高、生物相容性好、可生物降解等而在医药、化工等领域具有更广阔、附加价值更高的应用,是世界上公认的性能优异的新型生物材料[1-4]。
椰子水因富含营养、一直是海南和其他东南亚地区生产椰纤果的主要原料。本实验室及海南生产企业长期的实践表明,椰子水经过一段时间的自然发酵,其椰纤果产量远较使用新鲜椰子水高。但据了解,各地区生产nata的椰子水处理方式不完全相同,如泰国是用新鲜椰子水生产、越南是用发酵椰子水生产,印尼既用发酵椰子水也用新鲜椰子水、菲律宾则多用椰浆。椰子水原料在不同地区处理方式的不同,可能与所用菌种、菌株的不同有关,也与发酵条件和工艺不尽相同有关。在海南,椰纤果生产由于都使用自然发酵的椰子水,椰子加工厂常将椰子水随意放置,甚至发酸、变味。由于不同厂家环境、或不同季节、甚至原料椰子的产地不同,都会使椰子水的前期发酵呈现复杂和多变的状况,因此给椰纤果生产的直接影响就是椰纤果产量和品质很不稳定。并且由于是自然发酵,不排除有害微生物生长的可能,这也给椰纤果生产带来不安全隐患。
因此,研究椰子水在自然发酵过程中的成分及微生物群落变化是非常必要的,可以为进而研究其菌相变化、为阐明对椰纤果生产有促进作用以及负向作用的主要微生物和成分等奠定基础,特别是为探明椰子水自然发酵状态下是否有、哪些是不安全因素、以及如何防范等做好前期工作。相关文献鲜见报道。
1 材料与方法
1.1 材料
1.1.1 椰子水样品
海口市售海南本地新鲜椰子,破壳取水,纱布过滤、分装于洁净矿泉瓶,无菌透气封口膜封口,室温下静置存放,自然发酵0 d~8 d,每天取样。将每瓶样品分为两份:一份用于微生物的测数和分离,另一份做成分分析。
1.1.2 培养基
麦芽汁培养基、M17培养基、结晶紫中性红胆盐(VRBG)培养基均购自青岛日水生物技术有限公司,PCA培养基、酸化MRS培养基、改良Chalmers培养基、醋酸菌(AAB)培养基[5-7]。
上述培养基于121℃灭菌20 min,待冷却至50℃加入0.1%那他霉素(麦芽汁培养基除外),摇匀;固体培养基添加2%琼脂后灭菌,冷却后加入0.1%那他霉素混匀、倒平板。
1.1.3 主要仪器设备
1260液相色谱仪:安捷伦科技有限公司;SKY-2112B立式双层大容量恒温培养箱:金坛市盛蓝仪器有限制造公司;Delta320-SpH计:梅特勒-托利多仪器有限公司;WYT手持折光糖度仪:成都市青年联合光学仪器成套部。
1.2 方法
1.2.1 成分分析
用注射器取椰子水液面下5 cm处0.2 mL样品滴于pHS-25数显酸度计中测定pH;总酸测定采用氢氧化钠溶液滴定法[8];可溶性固形物测定采用手持糖度仪进行检测,结果以°Bx表示;还原糖测定采用3,5-二硝基水杨酸(DNS)比色法[9]。
乳酸和醋酸测定样液的制备:将待测样品与硫酸锌(72 g/L),三水合铁氰化钾(36 g/L),以 1∶1∶1的比例混合,10 000 r/min离心 10 min,0.22 μm 的微孔滤膜过滤过滤,进样量为10 μL,重复进样3次,用各有机酸的回归方程计算各种成分的含量。
液相色谱条件:分析仪器为Agilent1260型高效液相色谱仪,色谱柱为AgilentZORBAX-SB-Aq(250 mm×4.6 mm),流动相为用高氯酸调pH2.5的水溶液作为流动相;流速:0.6 mL/min;柱温 55℃,检测器为VWDVL+,检测波长为210 nm进样量:10 μL。采用外标法进行定量分析。
1.2.2 椰子水自然发酵过程中微生物的分离计数
在不同平板培养基上分别分离纯化真菌和细菌。30℃恒温培养48 h~72 h,选择合适的稀释浓度观察并记录菌落个数。
2 结果与分析
2.1 椰子水自然发酵过程中可溶性固形物及还原糖变化
椰子水自然发酵过程中可溶性固形物及还原糖变化见图1。

图1 椰子水发酵过程中可溶性固形物及还原糖变化Fig.1 Changes in soluble solidsand reducing sugar during the natural fermentation of coconut water
还原糖的下降趋势与可溶性固形物基本一致,发酵前3 d还原糖下降速度较快,因其作为速效碳源能迅速被各种微生物利用,用于细胞繁殖。3 d后还原糖消耗减缓。可溶性固形物因其构成较复杂,被利用和消耗的变化幅度较缓和,推测这也与其中的微生物会同时产生各种代谢产物有关。
2.2 椰子水自然发酵过程中pH及总酸变化
新鲜椰子水的原始pH一般在4.5~5.3左右[10],此次测定值为5.14,椰子水自然发酵过程中pH变化见图2。
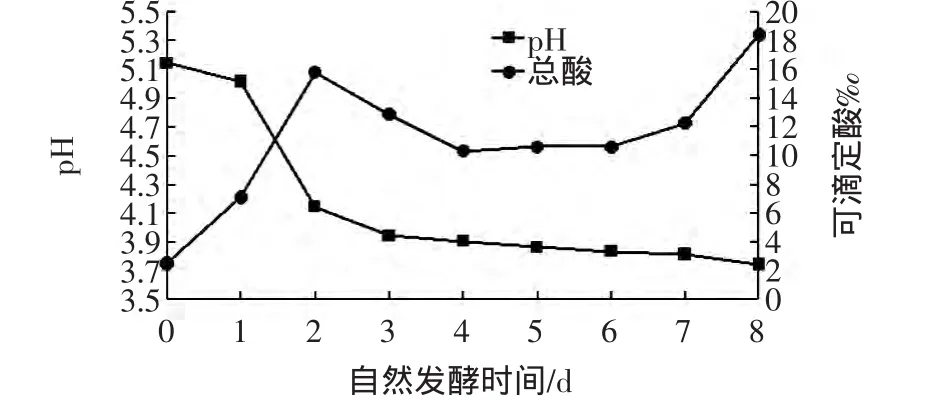
图2 椰子水自然发酵过程中pH及总酸变化Fig.2 Changes of pH and titratable acid value during the natural fermentation of coconut water
在发酵前3 d,pH迅速下降,到发酵第4天~第5天后趋于平稳、最后保持在3.8左右。这较前人研究的椰子水经自然发酵5 d的pH3.64为高[11],这可能是环境不同,所生长的微生物区系不同所致。
新鲜椰子水的总酸含量在前2 d迅速升高,随后降低,到第4天后又缓慢上升。这可能是一些耐酸微生物在初期繁殖起来后代谢了一部分有机酸类、导致总酸下降,然后后期可能是一些兼性厌氧微生物持续生长、产酸又使总酸上升。但后期pH变化较之总酸缓和可能与体系里复杂多样的产物使其具有一定缓冲能力有关。
2.3 椰子水自然发酵过程中乙酸和乳酸变化
在椰纤果的生产中,刘四新等曾直接用新鲜椰子水,但须用乙酸调节pH值,若用其他常用无机酸或有机酸调节则可能产量降低或不产。故推测自然发酵椰子水中乙酸等对椰纤果合成具有重要意义[12]。本研究以液相色谱法着重测定了乙酸和乳酸变化情况,在椰子水自然发酵过程中其变化见图3。
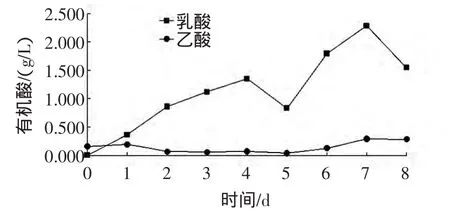
图3 乳酸和乙酸浓度变化Fig.3 Changes lactic acid and acetic acid concentration
显示椰子水自然发酵过程中,乙酸产量并不大、且变化不显著,而乳酸产量极显著高于乙酸,推测自然发酵椰子水体系中有大量各种乳酸菌的繁殖和消长,且产生的乳酸可能对椰纤果的合成起到一定的促进作用。
2.4 椰子水自然发酵过程中微生物数量变化
椰子水自然发酵过程中细菌和真菌菌落数量变化见图4。
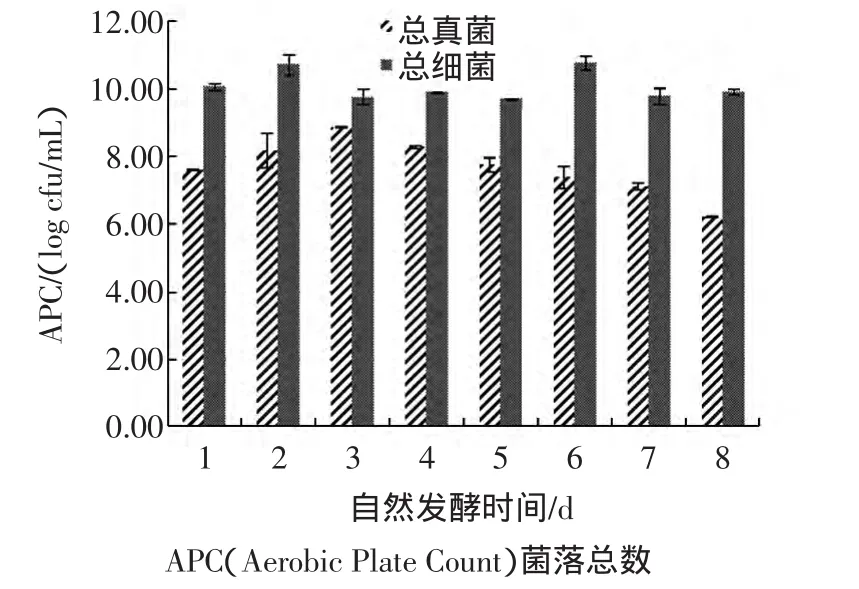
图4 细菌和真菌菌落数量变化Fig.4 Changes of aerobic plate count of bacteria and fungi
在椰子水自然发酵过程中同时存在细菌和真菌两类微生物,且细菌类数量更多,真菌中又以酵母菌占绝对优势,霉菌数量很少。图4显示,细菌的增殖十分旺盛,第1天数量就达到1×1010,且第2天达到高峰,随后稍降并维持在1×109以上,第6天又一次超过1×1010。而真菌数量高峰稍滞后于细菌、于第3天达到约1×109,随后一直呈缓慢下降趋势。可见,微生物总数变化规律与还原糖、可溶性固形物和总酸、pH的变化是基本吻合的,即在前3天是微生物总数呈对数增长的阶段,而后真菌数量减少,但细菌类数量始终维持较高水平。
2.5 椰子水自然发酵过程中细菌群落变化
发酵体系中细菌群落变化如图5所示。

图5 椰子水自然发酵过程中细菌群落变化Fig.5 Changes in APC values of bacteria during the natural fermentation of coconut water
乳酸菌和醋酸菌在体系中数量最多、占主要优势,且都在第2天达到峰值,随后3 d~6 d稍降,又都在第7天小幅回升。结合乙酸和乳酸成分变化,说明这两类菌的增殖变化趋势基本一致,且两类菌对成分变化有较大影响。另外,大肠菌群和芽孢菌的变化趋势也比较接近,最高数量都发生在第1天,之后呈持续下降的趋势。这两类菌是发酵椰子水中可能的不安全因素,虽然其数量会随着发酵时间而下降,而且在椰纤果工业生产中会将自然发酵椰子水煮沸灭菌再使用,但因芽孢杆菌耐高温的特点,也容易发生灭菌不彻底而导致椰纤果发酵的产量和品质不稳定等问题。
3 讨论与结论
本试验以自然发酵椰子水为研究对象,对其发酵过程进行了系统的研究,在测定了发酵体系中常规成分变化的同时,解析了发酵过程中的微生物数量和群落的变化,获得如下结论:
在实验室条件下,自然发酵的椰子水可溶性固形物及还原糖变化主要出现在发酵前3 d,在此期间,pH也急剧下降,然后稳定在pH3.8左右;总酸含量在第2天达到第一个高峰,随后先下降后上升;在观察结束时体系中的乳酸和乙酸含量分别为1.54g/L和0.28g/L;发酵初期,各种微生物迅速増殖,也在前3 d达到最大值,而后真菌数量逐渐减少,细菌数量始终维持在较高水平。在细菌体系中检测到了乳酸菌、醋酸菌、肠菌群、芽孢杆菌,其中乳酸菌和醋酸菌数量最多,且对成分变化有较大影响,而肠菌群和芽孢杆菌的存在也使得自然发酵椰子水存在一定安全隐患。虽然在椰纤果工业生产中会将自然发酵椰子水煮沸灭菌,但因芽孢杆菌耐高温的特点容易发生灭菌不彻底而导致的产量不稳定及存在安全隐患。
根据本试验结果,可进一步研究自然发酵椰子水中的菌相变化,并在此基础上,结合后期的深入研究,有可能分析出对产量稳定和产品安全不利的有害菌,为有效避免不稳定的自然发酵,避免其可能产生的安全隐患问题而奠定良好的基础。这将为海南椰纤果行业摆脱椰子水的放任式自然发酵,走向高产、高效、安全的生产新模式寻找出路,也对提升海南椰纤果行业现行生产水平和品质安全产生深远的意义。
[1] Hu,Catchmark.Formation and characterization of spherelike bacterial cellulose particles produced by Acetobacter xylinum JCM 9730 strain[J].Biomacromolecules,2010,11(7):1727-1734
[2]Ul-Islam M,Shah N,Ha J H,et al.Effect of chitosan penetration on physico-chemical and mechanical properties of bacterial cellulose[J].KoreanJournalofChemicalEngineering,2011,28(8):1736-1743
[3] 汪全伟,刘四新,高世龙,等.细菌纤维素生产与应用研究进展[J].生物技术通讯,2007,18(1):152-154
[4] Charpentier C,Aussenac J,Charpentier M,et al.Release of nucleotides and nucleosides during yeast autolysis:kinetics and potential impact on flavor[J].Journal of agricultural and food chemistry,2005,53(8):3000-3007
[5] Cleenwerck I,Gonzalez A,Camu N,et al.Acetobacter fabarum sp.nov.,an acetic acid bacterium from a Ghanaian cocoa bean heap fermentation[J].Int J Syst Evol Microbiol,2008,58(Part 9):2180-2185
[6] 王一淇,李宗军.湖南芥菜腌制发酵过程中的菌相变化规律[J].食品科学,2014,35(11):200-203
[7] 李程程.产黏植物乳杆菌70810发酵豆乳生产拉丝酸豆乳饮品的研制[D].南京:南京农业大学,2010
[8] 曹建康,赵玉梅.果蔬采后生理生化实验指导著者[M].北京:中国轻工业出版社,2007:27-28
[9] 赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536
[10]Costa H B,Souza L M,Soprani L C,et al.Monitoring the physicochemical degradation of coconut water using ESI-FT-ICR MS[J].Food Chemistry,2014,174:139-146
[11]王锡彬,吴周新,冯玉红,等.以椰子水为主要培养基质制备木醋杆菌斜面种的技术研究[J].中国食品学报,2003(z1):73-78
[12]刘四新,李从发,李枚秋,等.纳塔产生菌的分离鉴定和发酵特性研究[J].食品与发酵工业,1999(6):39-43
