薏苡茎、叶提取液对肿瘤细胞增殖的抑制作用
2015-05-07朱晓莹林瑶黄锁义余珊
朱晓莹,林瑶,黄锁义,余珊
(右江民族医学院,广西百色533000)
薏苡(Coix lacroyma-jobi L.var.ma-yuen Stapf)为禾本科薏苡属,一年生或多年生草本植物。壮药薏苡入药历史悠久,《后汉书·马援传》载:“出征交趾,土多瘴气”,因常服薏苡仁而能防治瘴疾,后带回中原。《神农本草经》记载:“薏苡仁味甘,微寒。主筋急,拘挛不可屈伸,风湿痹,下气,久服轻身益气”[1]。2010年版中国药典记载薏苡仁可健脾渗湿,除痹止泻,清热排脓[2]。薏苡作为食用兼药用的栽培作物,薏苡具备了较全面的营养保健功能,薏苡仁油具有抗肿瘤、免疫调节、抗病毒等方面的活性,薏苡茎可防治麻疹、湿疹等;薏苡叶中所含的生物碱,有清热利湿、健脾杀虫、暖胃益气、舒盘活血等作用[3]。
在前期试验研究中,发现薏苡茎、叶水提取液及乙醇提取液对宫颈癌细胞增殖抑制作用显著。本文以运用薏苡茎、叶的水提取液及乙醇提取液作用于人宫颈癌(hela)、胃癌(SGC-7901)和肝癌(HepG2)细胞,观察薏苡4种提取液对3种肿瘤细胞增殖活性的影响,探讨薏苡茎、叶提取液抗肿瘤的活性。
1 材料与方法
1.1 细胞株
宫颈癌细胞Hela购于中国科学院典型培养物保藏中心昆明细胞库,2 d~3 d换液一次,4 d~5 d传代;胃癌(SGC-7901)、肝癌(HepG2)由广西医科大学黎丹绒教授惠赠,2 d~3 d换液一次,4 d~5 d传代。
1.2 仪器
RE-3000A旋转蒸发仪:上海亚荣生化仪器厂;ALPHA1-2/LD-Puls冷冻干燥机:德国 CHRIST;ME104电子天平:美国梅特勒-托利多;CO2培养箱:上海力康HF90;多功能酶标仪:德国伯托TriStar LB941。
1.3 试剂与药材
RPMI-1640培养基:赛默飞世尔科技公司;胎牛血清:Hyclone公司;四甲基偶氮唑盐(MTT)、二甲基亚枫(DMSO):Sigma公司;0.25%EDTA-胰酶:北京索来宝公司;薏苡:购自广西百色市西林县足别瑶族苗族乡(经右江民族医学院民族医药教研室覃道光副教授鉴定为禾本科薏苡属薏苡药材)。
1.4 薏苡茎、叶活性部位的提取
将新鲜的薏苡茎、叶分别用清水洗净,阴干,茎、叶分别粉碎保存。称取薏苡茎、叶干粉各100 g,按料液比1∶10分别加入蒸馏水、无水乙醇,按下法进行提取。65℃恒温水浴加热回流两次,每次2 h,抽滤,合并滤液,用旋转蒸发仪减压浓缩,最后将浓缩液制成冻干粉。将上述提取液冻干粉各取0.5 g,用1%DMSO溶液溶解,0.22 μm过滤,分装存储。临用前加入含10%胎牛血清的1640培养基中,调整到相应的浓度。
1.5 薏苡茎叶不同提取液对Hela、SGC-7901、HepG2细胞增殖的影响
取对数生长期的细胞,分别调整细胞浓度为1×105个/mL,接种于 96 孔培养板,每孔 100 μL,试验设定调零组(仅加培养液)、空白组(含细胞液及培养液)和给药组(含细胞液、培养液及药物)孔。给药组设有:薏苡茎叶水提取液、薏苡茎叶乙醇提取液。每种药物设5个浓度,每个浓度设5个复孔,加药培养48 h。48 h后倾去上清液,加新鲜配制的MTT溶液(5 mg/mL)20 μL,补充 1640 培养基至 200 μL,混匀再培养 4 h。倾去上清液,每孔加DMSO 150 μL,摇匀溶解甲臜,490 nm下测定各孔的吸光度(OD值)。
1.6 细胞增殖抑制率及IC50的计算
抑制率/%=[1-(给药组OD值-调零组OD值)/(空白组OD值-调零组OD值)]×100。将试验数据输入SPSS17.0求出各种提取液的IC50。
2 结果
薏苡茎叶提取液对Hela、SGC-7901、HepG2细胞增殖抑制的结果(OD值)见表1,抑制率计算结果见图1,IC50计算结果见表 2。
表1 薏苡茎叶提取液对Hela、SGC-7901、HepG2细胞增殖的影响(±s,n=5)Table 1 Extracts from stalks and leaves of adlay of Hela,SGC-7901,HepG2 cells after treatmen(tx±s,n=5)mg/mL
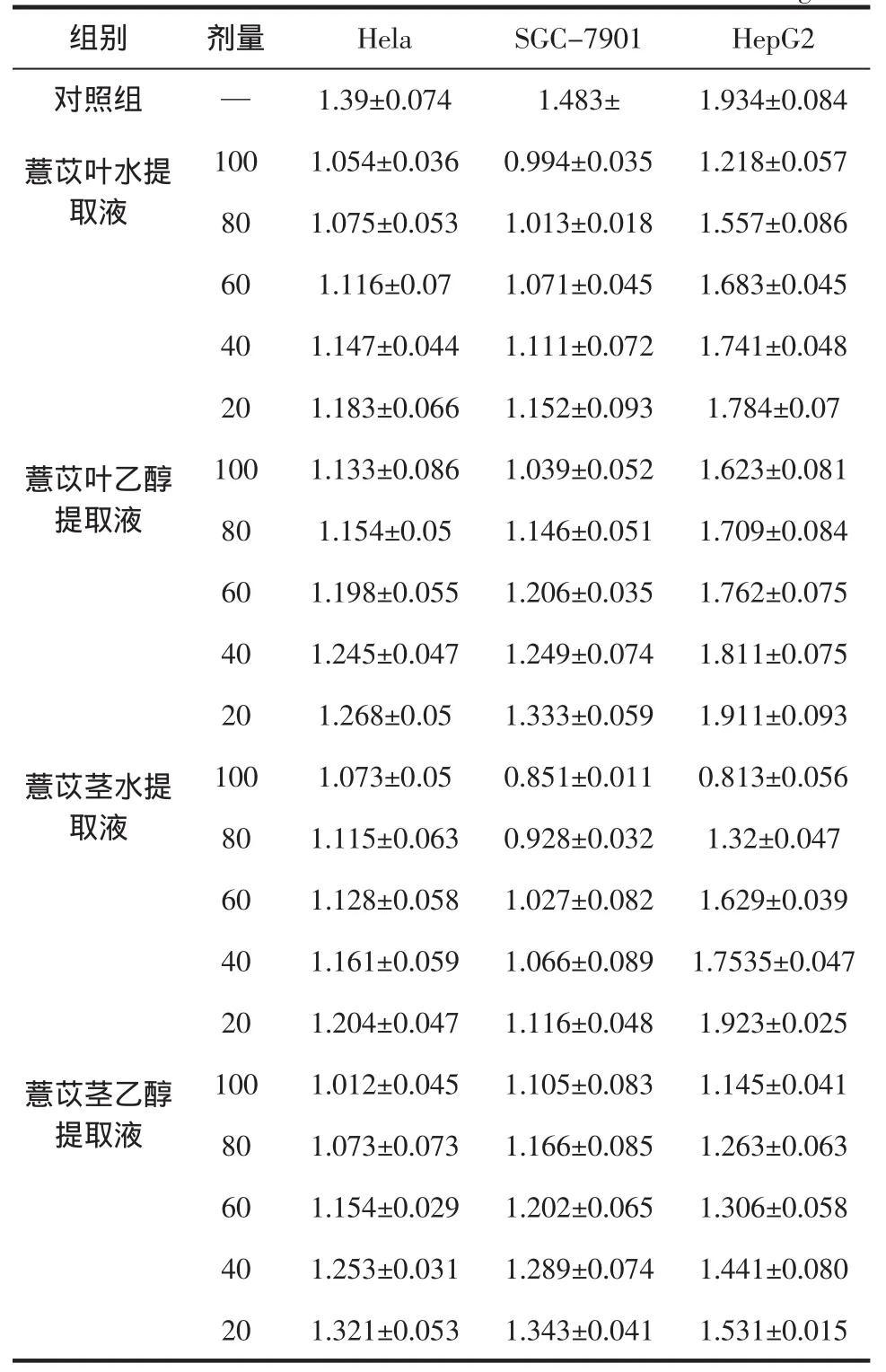
表1 薏苡茎叶提取液对Hela、SGC-7901、HepG2细胞增殖的影响(±s,n=5)Table 1 Extracts from stalks and leaves of adlay of Hela,SGC-7901,HepG2 cells after treatmen(tx±s,n=5)mg/mL
注:表中“-”为不加干预因素。
?

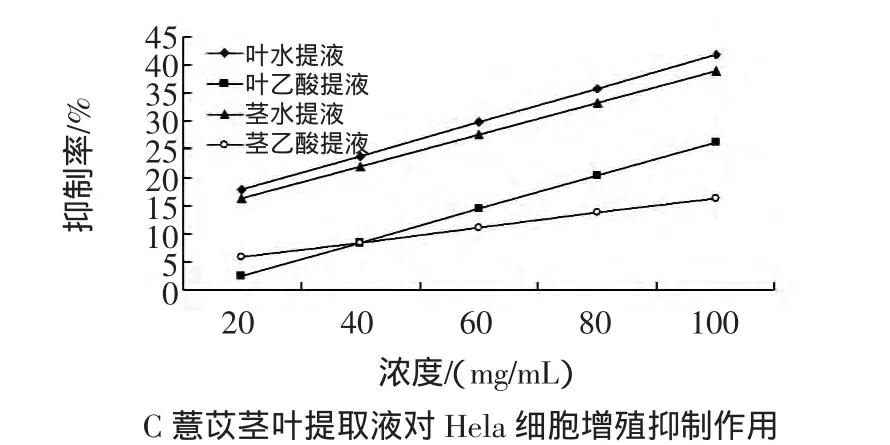
图1 薏苡茎叶提取液对 HepG2(A)、SGC-7901(B)、Hela(C)细胞增殖抑制率Fig.1 Antiprolifeactive of adlay extracts towards HepG2(A),SGC-7901(B),Hela(C)cells注:A图以薏苡叶乙醇提取液对HepG2细胞增殖抑制作用最显著;B图以薏苡茎乙醇提取液对SC-7901细胞增殖抑制作用最显著;C图以薏苡茎乙醇提取液对Hela细胞增殖抑制作用最显著。
从上述图表中可见,薏苡茎叶水、乙醇提取液对人肝癌细胞HepG2、人胃癌细胞SGC-7901和人宫颈癌Hela细胞均有抑制作用,其抑制率随提取液浓度的增加而增加。但各个细胞对各提取液的敏感程度不同。HepG2细胞对薏苡叶乙醇提取液较敏感,而SC-7901、Hela对薏苡茎乙醇提取液较敏感,运用spss软件计算它们的IC50,其中以薏苡叶乙醇提取液对HepG2、SGC-7901、Hela 的 IC50值 48.52、54.72、139.35较低。
3 讨论
薏苡的化学成分研究始于20世纪60年代,从薏苡中分到的化合物类型包括:脂类、甾醇类、benzoxazinones、benzoxazolinone、indene、木脂素类、酚类、腺苷等近30个化合物以及蛋白质、氨基酸和维生素等营养成分[4]。研究[5-7]表明薏苡具有一定的抗肿瘤活性,目前国内外对于薏苡抗肿瘤的研究主要集中于薏苡仁,对薏苡治疗肿瘤等疾病的有效部位及作用机理等方面均未见有详细深入的研究。本课题组前期以水、乙醇、甲醇、丙酮及氯仿为溶剂分别提取薏苡茎、叶,观察他们对Hela增殖的抑制作用。结果显示,薏苡茎、叶各提取液均显示出一定的抑制Hela增殖作用,其中以薏苡水提及乙醇提取液作用较强。本文以前期研究为基础,进一步研究薏苡的抗肿瘤活性及其作用谱,选择人肝癌细胞HepG2、人胃癌细胞SGC-7901和人宫颈癌Hela细胞3种细胞为试验对象,观察薏苡茎、叶的水、乙醇提取液对它们增殖的抑制作用。试验结果显示薏苡茎叶水、乙醇提取液对人肝癌细胞HepG2、人胃癌细胞SGC-7901和人宫颈癌Hela细胞均有抑制作用,其抑制作用随药物浓度的增加而增加,呈现剂量依赖效应。运用spss计算它们的IC50,其中以薏苡叶乙醇提取液对HepG2、SGC-7901、Hela的IC50值 48.52、54.72、139.35 较低。因此,认为薏苡叶提取液具有较好的抑制肿瘤细胞生长的作用。此外,对比薏苡茎叶IC50抑制率时,发现薏苡叶提取液优于茎提取液,提示薏苡抗癌活性物质在叶中的分布大于茎,这为下一步薏苡提取液在体内抗肿瘤作用研提供参考。
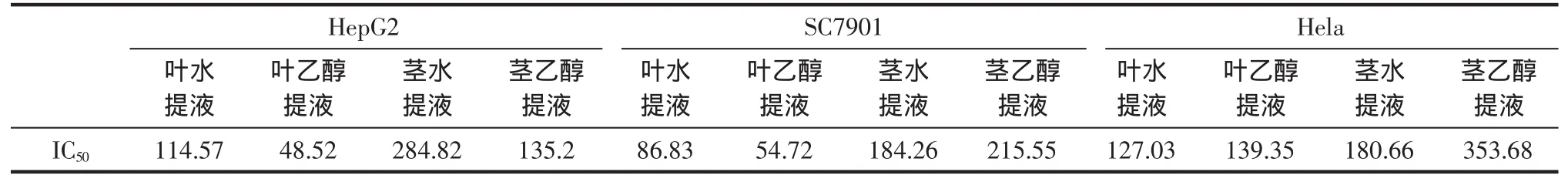
表2 薏苡茎叶提取液对Hela、SGC-7901、HepG2的IC50值Table 2 IC50values extracts from stalks and leaves of adlay of Hela,SGC-7901,HepG2 cellsmg/mL
[1] 国家中医药管理局《中华本草》编委会.中华本草[M].8版.上海:上海科学技术出版社,1999:329
[2] 中华人民共和国卫生部药典委员会.中国药典,I部[M].北京:化学工业出版社,2010:353
[3] 黄锁义,李容,潘勇,等.薏苡研究的新进展[J].食品研究与开发,2012,33(11):223
[4] 杨爽,王李梅,王姝麒,等.薏苡化学成分及其活性综述[J].中药材,2011,34(8):1306
[5] Ming-Yi Lee,Huan-You Lin,Faiwen Cheng,et al.Isolation and characterization of new lactam compounds that inhibit lung and colon cancer cells from adlay(Adlay lachryma-jobi L.var.ma-yuen Stapf)bran[J].Food and Chemical Toxicology,2008,46(6):1933
[6]Cheng-Pei Chung,Chih-Ying Hsu,Jing-Hui Lin,et al.Antiproliferative Lactams and Spiroenone from Adlay Bran in Human Breast Cancer Cell Lines[J].J Agric Food Chem,2011,59(4):1185
[7]Cheng-Pei Chung,Hsin-Yi Hsu,Din-Wen Huang,et al.Ethyl Acetate Fraction of Adlay Bran Ethanolic Extract Inhibits Oncogene Expression and Suppresses DMH-Induced Preneoplastic Lesions of the Colon in F344 Rats through an Anti-inflammatory Pathway[J].J Agric Food Chem,2010,58(13):7616
