靶向阻断转化生长因子-β 信号通路对肿瘤特异性细胞毒性T 淋巴细胞的影响
2015-05-07车晓玲周文泉张征宇秦卫军王龙信
田 丰,周 凯,车晓玲,傅 点,程 文,周文泉,张征宇,秦卫军,王龙信
0 引 言
转化生长因子β(transforming growth factor-β,TGF-β)是一种具有多种功能的细胞因子,其对免疫细胞有强大的免疫抑制作用,能够被多数肿瘤大量分泌而逃避宿主的免疫监视[1]。CD8+细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)是机体针对肿瘤免疫的重要的效应细胞,但由于TGF-β 的免疫抑制功能,其作用被明显抑制[2]。我们构建了对TGF-β 不敏感的肿瘤特异性的CTL 细胞,通过检测对比CTL 对肿瘤细胞的细胞毒性作用及小鼠体内细胞因子的变化了解TGF-β 信号通路被阻断后免疫细胞的治疗作用的变化。现报道如下。
1 材料与方法
1.1 材料
1.1.1 动物 健康雄性Balb/c 小鼠,体重:16 ~20g,鼠龄:6 ~8 周,共60 只,购于第四军医大学实验动物中心,实验动物合格证号:SCXK(军)2008-016。饲养于超净动物实验室层流架内,保持恒温(25±2)℃、恒湿(45%~50%),应用实验动物标准饮食进行饲养,无菌工作台内进行实验操作。
1.1.2 细胞 小鼠肾癌细胞系Renca、前列腺癌细胞系TRAMP-C2 购自于ATCC 公司,以10%FCS PRMI1640 于pH 7.2 ~7.4、37 ℃、5%CO2、100%湿度条件的细胞培养箱中培养,以细胞平铺生长至培养瓶底面积80%为标准。
1.1.3 主要药品及试剂 修饰的TβRⅡ质粒由美国西北大学张强博士惠赠。粒-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)、肿瘤坏死因子(tumor necrosis factorα,TNF-α)及白细胞介素4(interleukin-4,IL-4)、IL-2均购于英国Peprotech 公司。DMEM、1640 培养基购于Gibco 公司。胎牛血清(FBS)购于Hyclone公司。抗Smad-2 和磷酸化Smad-2 的单克隆抗体购自BD Pharmingen 公司。CD8+T Cell Isolation Kit 购自R&D 公司。
1.2 方法
1.2.1 动物模型的建立 于小鼠右腋部皮下注射0.1 mL(5×106个/L)Renca 细胞悬液,1 周后肿瘤大小接近10 ~20 mm,建立肾癌皮下荷瘤Balb/c 小鼠模型。
1.2.2 DC 细胞分离、培养及抗原负载 颈椎脱位处死小鼠,无菌取脾,用梯度密度离心法获取单个核细胞,调整细胞密度至5×109个/L,置于37 ℃、5%CO2孵箱中培养3 h,移去悬浮细胞,加入含10%FCS 的1640 培养液、rm-IL-4(1000 U/mL)、rm-GM-CSF(1000 U/mL),隔日半量换液,第5 天后按10∶1 比例加入反复冻融获得Renca 细胞裂解物,第6 天加入TNF-α,第7 天收集悬浮细胞,即为负载肾癌抗原的DC 细胞(TP-DC)。
1.2.3 CTL 细胞分离、培养及致敏 颈椎脱位处死Balb/c 小鼠,无菌取脾,制备脾细胞悬液,去除细胞团或碎片并裂解红细胞。清洗细胞并计数,将脾细胞置于冷的1×MagCellectBuffer 中,将细胞数调整至20×107个/mL;将细胞转移至5mL 离心管中,加入200 μL/mL MagCellectCD8+Cocktail,2 ~8 ℃冰箱孵育15 min;向细胞悬液中加入250 μL MagCellect Ferrofluid,2 ~8 ℃冰箱孵育15 min;孵育后期向试管中加入1.55 mL 1×MagCellectBuffer 使反应容积达到3 mL,将反应试管水平放置于磁力架上,室温(18 ~25 ℃)孵育6 min;保存离心管于磁场中,将上清移至5 mL 离心管中,重复最后步骤获得CD8+CTL 细胞。应用流式细胞仪进行鉴定。将TP-DC与CTL 以1∶10 比例加入含IL-2(500 U/mL)的10%FCS 1640 培养基中共同孵育,获得肿瘤敏感的CTL细胞(tumor pulsed cytotoxic T lymphocyte,TP-CTL)。
1.2.4 TβRⅡ质粒构建逆转录病毒载体 在FuGENE 6 作用下用修饰的TβRⅡ质粒转染293 包装细胞,32 ℃下孵化24 h 后收集漂浮在表面的病毒,0.45 μm过滤器过滤,在聚凝胺作用下转染293 细胞,32 ℃下孵化48 h,10%DMEM 培养基37 ℃下孵化过夜,同样条件再次转染293 细胞24 h,收集漂浮在表面的病毒,0.45 μm 过滤器过滤,获得重组逆转录病毒。
1.2.5 阻断TGF-β 信号通路的肿瘤特异性CTL 细胞的获得 已经致敏的TP-CTL 细胞(1×106个/mL)置于预涂纤维蛋白碎片的培养基内,加入同样体积的重组逆转录病毒,5%CO2、37 ℃下孵化48 h,获得表达显性负相TGF-βⅡ型受体的肿瘤特异性的CTL细胞(TGF-β type Ⅱreceptor domain negative-CTL,TβRⅡDN-CTL)。
1.2.6 TβRⅡDN-CTL 细胞体外实验 用TGF-β1(10 ng/mL)对TP-CTL 及TβRⅡDN-CTL 细胞进行增殖抑制实验,进行细胞计数。用10 ng/mL 的TGF-β 与转染前后的TβRⅡDN-CTL 细胞孵育16 h后裂解细胞,用抗Smad-2 和磷酸化Smad-2 的单克隆抗体做Western blot 检测。通过Cr51释放实验测定TP-CTL 及TβRⅡDN-CTL 对肾癌细胞的细胞毒作用,靶效比(T 细胞/肿瘤细胞)从1∶1 至100∶1,以无关肿瘤细胞株小鼠前列腺癌TRAMP-C2 细胞作为非特异性对照。
1.2.7 TβRⅡDN-CTL 细胞对小鼠体内IL-2 和INF-γ水平的影响 将已成瘤的动物模型按随机数字表法分为2 组,每组10 只。分别于第1、3、7 天于尾静脉过继性注射TP-CTL 及TβRⅡDN-CTL 2×106个/只。3 周后应用ELISA 法检测小鼠体内IL-2 和INF-γ 水平。
1.3 统计学分析 采用SPSS 12.0 软件进行统计分析,计量资料用均数±标准差)表示,组间均数比较采用单因素的方差分析,组间均数比较采用t检验。以P≤0.05 为差异有统计学意义。
2 结 果
2.1 分离获得的DC、CTL 细胞及TβRⅡDN 转染效率检测 倒置显微镜下可见分离获得的CTL 大小均匀小球形,而新鲜分离培养的DC 可见悬浮球形细胞表面有树突状或毛刺状突起,见图1。经流式细胞仪检测CTL 的TβRⅡDN 转染效率为92.3%。见图2。
2.2 TGF-β 对TβRⅡDN-CTL 细胞增殖影响 将正在培养的阻断TGF-β 信号通路的TβRⅡDN-CTL 及TP-CTL 培养基中加入TGF-β1(10 ng/mL),观察2 种细胞的增殖情况,结果表明TGF-β1对TβRⅡDN-CTL细胞增殖差异无统计学意义(P >0.05)。见图3。
2.3 阻断TGF-β 信号通路后Smad-2 磷酸化情况
TP-CTL 细胞与TGF-β1以10 ng/mL 共同孵育16 h 后可以检测到Smad-2 和磷酸化Smad-2。而转染后表达TβRⅡDN 的CTL 细胞与同样剂量TGF-β1孵育后只能检测到Smad-2,而未检测到磷酸化的Smad-2,说明TGF-β 的信号通路被阻断。见图4。
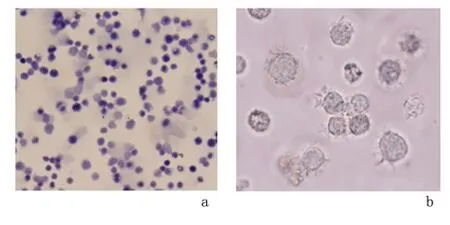
图1 倒置显微镜下观察分离获得的CTL 及DC 细胞Figure 1 Cytotoxic T lymphocytes and dendritic cells under the inverted microscope
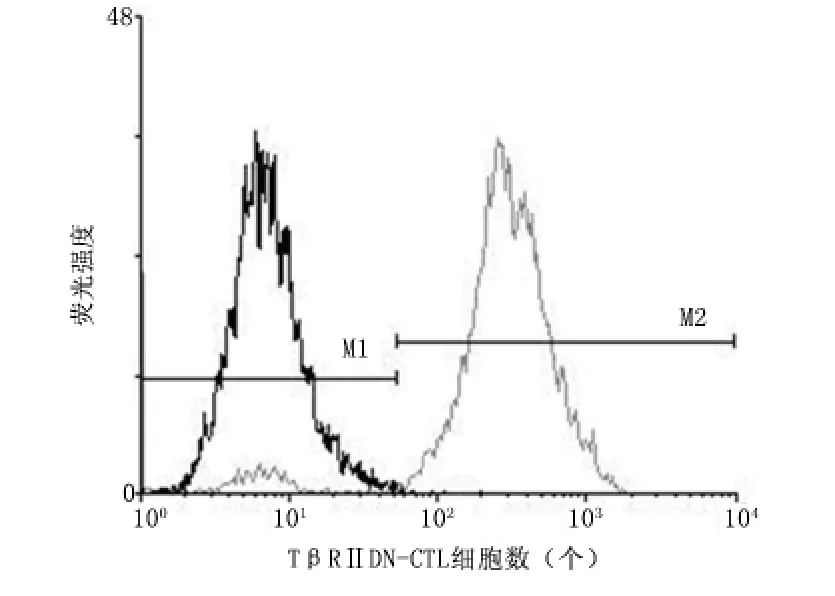
图2 流式细胞仪检测TβRⅡDN 转染效率Figure 2 Transfection efficiency of TβRⅡDN by flow cytometry
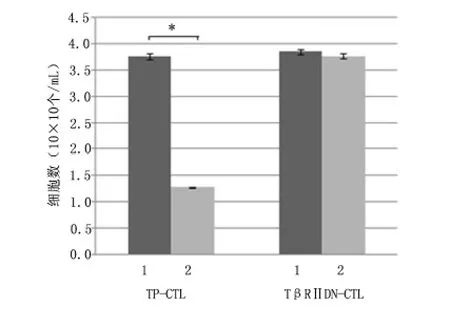
图3 TGF-β1对TP-CTL 和TβRⅡDN-CTL 细胞增殖数量的影响Figure 3 Effects of TGF-β1 on the proliferation of tumor lysate-pulsed cytotoxic T lymphocytes (TPCTLs)and TβRⅡDN-CTLs
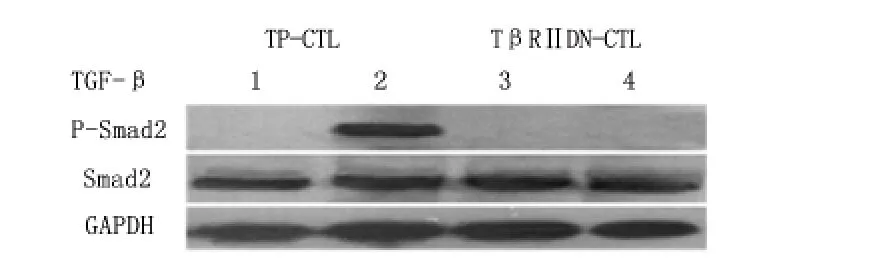
图4 Western blot 检测不同CTL 细胞Smad-2 及其磷酸化情况Figure 4 hosphorylation of Smad-2 in tumor lysate-pulsed cytotoxic T lymphocytes(TP-CTLs)and TβRⅡDN-CTLs
2.4 TGF-β 信号通路对CTL 杀伤能力的影响TP-CTL 和TβRⅡDN-CTL 对肾癌Renca 细胞均有特异性的细胞毒作用,且杀伤率随着E/T 比率的增加而升高,TβRⅡDN-CTL 对靶细胞的细胞毒作用与TP-CTL 比较差异有统计学意义(P <0.01)。TβRⅡDN-CTL 及TP-CTL 对无关的小鼠前列腺癌TRAMPC2 细胞无明显杀伤作用。见表1、表2。
表1 TβRⅡDN-CTL 与TP-CTL 对相关肿瘤细胞Renca 特异性杀伤效率,%)Table 1 Renal cancer-specific killing effects of tumor lysate-pulsed cytotoxic T lymphocytes(TP-CTLs)and TβRⅡDNCTLs,%)

表1 TβRⅡDN-CTL 与TP-CTL 对相关肿瘤细胞Renca 特异性杀伤效率,%)Table 1 Renal cancer-specific killing effects of tumor lysate-pulsed cytotoxic T lymphocytes(TP-CTLs)and TβRⅡDNCTLs,%)
与TβRⅡDN-CTL 组比较,*P <0.01
组别1∶1 20∶1不同效5靶0∶比1杀伤率75∶1 100∶1 TTβP-RCⅡTLD 组N- CT L 组 8 4..55 00±±00..55 84 *11 6..57 00±±00..84 22 *31 20..62 00±±30..0943 *41 14..49 00±±41..01 6 2*51 07..47 00±±41..44 8 2*
表2 TβRⅡDN-CTL 与TP-CTL 对无关肿瘤细胞TRAMP-C2 杀伤效率,%)Table 2 Killing effects of tumor lysate-pulsed cytotoxic T lymphocytes(TP-CTLs)and TβRⅡDN-CTLs on non-tumor cells TRAMP-C2,%)
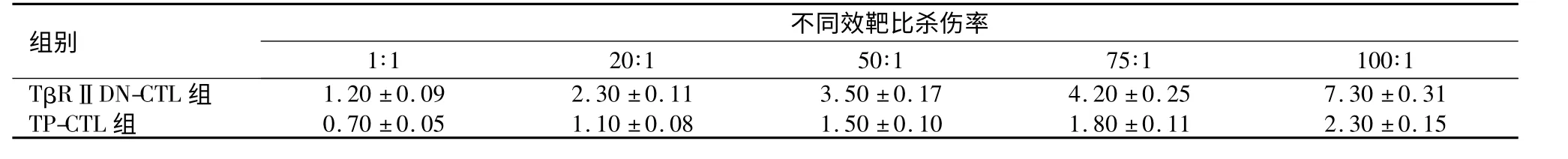
表2 TβRⅡDN-CTL 与TP-CTL 对无关肿瘤细胞TRAMP-C2 杀伤效率,%)Table 2 Killing effects of tumor lysate-pulsed cytotoxic T lymphocytes(TP-CTLs)and TβRⅡDN-CTLs on non-tumor cells TRAMP-C2,%)
组别1∶1 20∶1不同效5靶0∶比1杀伤率75∶1 100∶1 TβRⅡDN-CTL 组 1.20±0.09 2.30±0.11 3.50±0.17 4.20±0.25 7.30±0.31 TP-CTL 组 0.70±0.05 1.10±0.08 1.50±0.10 1.80±0.11 2.30±0.15
2.5 CTL 过继性免疫后小鼠体内细胞因子变化情况 过继性输注TP-CTL 和TβRⅡDN-CTL 荷瘤小鼠体内检测IL-2 和INF-γ 水平相比,TβRⅡDN-CTL较TP-CTL 升高更为明显(P <0.01)。见图5。
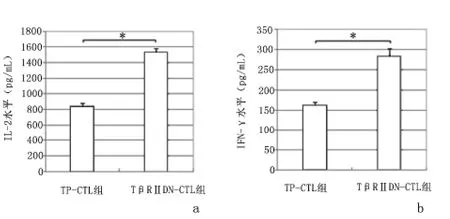
图5 过继性免疫后荷瘤小鼠体内INF-γ 和IL-2 水平Figure 5 Levels of serum IL-2 and INF-γ in the tumorbearing mice after adoptive transfusion of tumor lysate-pulsed cytotoxic T lymphocytes (TPCTLs)and TβRⅡDN-CTLs
3 讨 论
过继性免疫治疗是肿瘤免疫治疗中一种有前景的治疗方法,在动物实验和临床实验中都已经被广泛证实有效[3]。机体中最终消灭肿瘤细胞的免疫细胞是CTL 细胞。在过继性免疫治疗中很多类型的免疫细胞都被应用过,包括淋巴因子激活的CTL细胞、肿瘤浸润性淋巴细胞等,并且取得了一定的疗效[4-7]。尽管免疫细胞对肿瘤能够产生杀伤作用,但肿瘤很多的免疫逃逸机制仍然能够超过这些免疫反应最终促进肿瘤进展[8-9]。肿瘤来源的免疫抑制因子是其中最重要的因素之一[10-11]。
TGF-β 是一种多效的细胞因子,具有重要的生理功能。同时TGF-β 也是肿瘤产生的一种强大的免疫抑制因子[1],能够明显抑制免疫细胞的活性达到逃避杀伤的目的[2,10]。它能通过TGF-β/Smad 信号通路来影响细胞核内的靶基因,从而显著抑制CTL 杀伤活性[12]。首先TGF-β 与CTL 细胞表面的Ⅱ型受体(TβRⅡ)结合,通过磷酸化使下游细胞质中的Smad 蛋白被激活。Smad 蛋白是TGF-β 受体复合物的下游信号调节蛋白,它可以把胞膜上的信号直接传导至细胞核,活化了的Smads 复合物进入细胞核后,联合细胞核内其他的转录因子一起调节下游靶基因的转录来影响细胞周期[13-14],从而影响CTL 的杀伤效率。本实验将TβR Ⅱ基因在cDNA 597nt 处切去顶端,然后转染给CTL 细胞,使TβRⅡ显性负向表达来阻断该信号通路的信号转导,以达到消除TGF-β 对CTL 影响的作用。实验证实由于阻断了信号通路,在TβRⅡDN-CTL 中Western blot没有检测出磷酸化的Smad-2。在增殖抑制实验中,我们发现TGF-β 对TβRⅡDN-CTL 细胞增殖没有明显影响,从另外一个角度证实信号转导通路被阻断。当免疫抑制因子的影响被消除后,免疫细胞对肿瘤的杀伤作用将明显提高。在本实验中,阻断TGF-β信号通路的CTL 细胞特异性的肿瘤杀伤效率明显提高,而且将其过继性回输给荷瘤小鼠后,小鼠体内的IL-2 和INF-γ 水平也明显上升。IL-2 和INF-γ 均可由CTL 分泌,同时也对CTL 起到激活的作用,这对CTL 的杀伤效率提高起到作用[15]。本研究结果证实,阻断CTL 的TGF-β 的信号通路,明显提高肿瘤反应性CTL 的杀伤效率,并同时提高体内免疫因子的水平。
通过将肿瘤反应性CTL 应用包含显性负相TβRⅡ基因的逆转录病毒感染而使其TGF-β 信号被阻断,实现了CTL 对肿瘤分泌的强效免疫抑制因子TGF-β 不敏感,从而显著提高CTL 的杀伤效率。这种新方法对过继性肿瘤免疫治疗提供了新思路,具有重大的临床意义与应用价值。
[1] Pickup M,Novitskiy S,Moses HL.The roles of TGF-β in the tumour microenvironment[J].Nat Rev Cancer,2013,13(11):788-799.
[2] Oh SA,Li MO.TGF-β:guardian of T cell function[J].J Immunol,2013,191(8):3973-3979.
[3] Kalos M,June CH.Adoptive T cell transfer for cancer immunotherapy in the era of synthetic biology[J].Immunity,2013,39(1):49-60.
[4] Rosenberg SA,Dudley ME.Adoptive cell therapy for the treatment of patients with metastatic melanoma[J].Curr Opin Immunol,2009,21(2):233-240.
[5] Junker N,Andersen MH,Wenandy L,et al.Bimodal ex vivo expansion of T cells from patients with head and neck squamous cell carcinoma:a prerequisite for adoptive cell transfer[J].Cytotherapy,2011,13(7):822-834.
[6] Polak ME,Borthwick NJ,Jager MJ,et al.Melanoma vaccines:The problems of local immunosuppression[J].Hum Immunol,2009,70(5):331-339.
[7] 董 杰,王龙信,唐朝朋,等.转化生长因子β 不敏感的树突状细胞疫苗对肾细胞癌荷瘤小鼠细胞毒性T 淋巴细胞的影响[J].医学研究生学报,2013,26(5):455-459.
[8] Payne KK,Toor AA,Wang XY,et al.Immunotherapy of cancer:reprogramming tumor-immune crosstalk[J].Clin Dev Immunol,2012,2012:760965.
[9] Kaufman HL.Vaccines for melanoma and renal cell carcinoma[J].Semin Oncol,2012,39(3):263-275.
[10] Kudo-Saito C,Shirako H,Ohike M,et al.CCL2 is critical for immunosuppression to promote cancer metastasis[J].Clin Exp Metastasis,2013,30(4):393-405.
[11] Tian F,Wang L,Qin W,et al.Vaccination with transforming growth factor-beta insensitive dendritic cells suppresses pulmonary metastases of renal carcinoma in mice[J].Cancer Lett,2008,271(2):333-341.
[12] Wang L,Wen W,Yuan J,et al.Immunotherapy for human renal cell carcinoma by adoptive transfer of autologous transforming growth factor beta insensitive CD8+T cells in humanized SCID mice[J].Clin Cancer Res,2010,16(1):164-173.
[13] Matsuzaki K.Smad phospho-isoforms direct context-dependent TGF-β signaling[J].Cytokine Growth Factor Rev,2013,24(4):385-399.
[14] 董 杰,王龙信,唐朝朋,等.CT 在肺癌肾上腺转移诊断中的应用[J].医学研究生学报,2013,26(1):109-110.
[15] Takata H,Naruto T,Takiguchi M.Functional heterogeneity of human effector CD8+T cells[J].Blood,2012,119(6):1390-1398.
