迷走神经刺激对腹部创伤大鼠肠黏膜屏障的影响研究
2015-05-07虞文魁谌达程李秋荣
丁 凯,虞文魁,冯 涛,徐 琳,吴 波,谌达程,李秋荣,李 宁
0 引 言
腹部创伤能够导致肠屏障通透性增加,全身炎症反应,肠道菌群移位等,药物治疗有积极的影响[1-2]。据报道,在脓毒症休克、结肠炎和烧伤导致的肠屏障功能障碍中,可以通过电刺激或营养活化迷走神经的方法预防肠屏障功能的损害[3-6]。Neunlist等[7]报道,对人黏膜下层和单层肠上皮细胞的体外共培养模型电刺激可减少细胞间通透性。本实验采用腹部创伤大鼠模型研究颈部迷走神经电刺激对失血和肠管创伤后肠黏膜屏障的影响,以探索其在临床创伤救治中的应用价值。
1 材料与方法
1.1 动物模型的建立及分组 健康清洁型雄性SD 大鼠,24 只,体重260 ~300 g,由我院比较医学科提供,实验动物许可证号SCXK-(军)2012-0014,合格证号0032104,健康状况符合国家普通实验动物健康标准。所有大鼠在20 ~25 ℃温度和60%相对湿度条件下,适应1 周,于实验前禁食12 h,可自由饮水。
将大鼠按随机数字表法分为对照组和实验组,每组12 只,实验开始前,腹腔内注射1.5%戊巴比妥钠(30 mg/kg)麻醉。麻醉完成后备皮,打开上腹部腹腔,行颈部正中切口,暴露气管,游离右侧颈动脉,行动脉插管。实验组游离左侧颈部迷走神经,连接生物机能实验系统(购自四川成都东盟软件公司,BL-420F),电刺激10 min(连续单刺激、强度为5 V、频率为1 Hz、波宽为2 ms),对照组不予刺激。然后在动脉压力监测下进行放血,平均动脉压降至30 ~35 mmHg(1 mmHg=0.133 kPa),维持90 min,拔除颈动脉置管。再于上腹部暴露近端空肠,以肠钳沿长轴方向钳夹5 cm 肠管并持续10 min。随后以相同参数电刺激实验组迷走神经10 min,对照组不予刺激。以医用缝合丝线缝合切口。分别于术后1、6、24 h 取材,每个时间点分配4 只大鼠,大鼠以颈椎脱臼法处死。
1.2 主要试剂和仪器 异硫氰酸荧光素标记的葡聚糖(FITC-Dextra,FD4)购于美国Sigma 公司,其平均相对分子质量4000;检测仪器为Thermo 公司VARIOSKAN FLASH 全波长多功能酶标仪;白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、肠脂肪酸结合蛋白(intestinal fatty acid-binding protein,iFABP)、D-乳酸(DLactate acid,D-LA)、ELISA 试剂盒购自R&D 公司;检测用酶标仪为美国BIOTEK 公司产品,型号为ELX800;兔 抗 大 鼠 Occludin、Claudin1/2、ZO-1、GFAP(glial fibrillary acid protein)抗体均购自美国SANTA CRUZ 公司;二抗羊抗兔IgG-HRP 购自美国SANTA CRUZ 公司;电泳仪和转膜仪均为美国BIORAD 公司产品;冷冻高速离心机使用Beckman 公司产品;光学显微镜和激光共聚焦显微镜为德国卡尔·蔡司(Carl Zeiss)公司产品。
1.3 观察指标
1.3.1 血浆ELISA 检测 心脏采血,EDTA 抗凝,4 ℃下500×g 离心5 min,取血浆进行ELISA 检测,按照IL-6、TNF-α、iFABP、D-LA 的ELISA 试剂盒的说明进行操作。每个指标分别以6 个标准品进行标准曲线绘制,计算出血浆中各指标浓度。
1.3.2 肠屏障通透性检测 以0.1 mol/L 磷酸盐缓冲液(PBS)配制FD4 溶液,浓度为25 mg/mL,避光冷藏。动物模型完成后,取材前30 min 打开腹腔,结扎10 cm 中段小肠,形成封闭肠袢,在肠袢腔内注射FD4 溶液共0.5 mL,将肠袢还纳腹腔。30 min 后于门静脉抽血0.5 mL,肝素抗凝,避光冷藏送实验室,4 ℃下500×g 离心5 min 后,取血浆检测FITC 浓度。再根据标准曲线计算出对应血浆中FD4 浓度。
1.3.3 肠黏膜紧密连接蛋白检测 采用Western blot 法和免疫荧光激光共聚焦显微镜检测肠黏膜中紧密连接蛋白Occludin、Claudin1/2、Zo-1 的含量和分布。找到盲肠,逆行游离末端回肠,结扎部分回肠系膜,截取2 cm 肠管沿长轴切开,肠黏膜向圆心方向贴壁于冻存管中,置于液氮保存,另取5 cm 肠管刮取肠黏膜于-70 ℃冰箱冻存。
于冰箱中取出肠黏膜标本,称重切成小块,放入管中,加入含有蛋白酶抑制剂的蛋白抽提试剂。用匀浆器以低速匀浆30 s、冰浴1 min,反复多次,直至组织完全裂解。裂解液于预冷至4 ℃的离心机中14 000×g 离心15 min。上清液立刻转入新离心管中保存待用。配制15%浓度SDS-PAGE 分离胶,70 V 电压电泳完成后,转膜,进行5%脱脂乳封闭,室温2 h,PBST 洗涤3 遍,5 min/次;大鼠Occludin、Claudin1/2、Zo-1 抗体孵育,4 ℃反应过夜,PBST 洗涤3 次,5 min/次;HRP 标记的兔抗大鼠二抗孵育,室温2 h,PBST 洗涤3 遍,5 min/次;化学发光反应液避光孵育,在化学发光曝光仪中进行曝光、拍照。
自液氮中取出肠管样本,OCT 包埋后按5 μm 厚度冰冻切片,4%多聚甲醛固定15 min,等渗盐水冲洗3 次,2 min/次。1%小牛血清白蛋白溶液(BSA)封闭抗原(4 ℃,30 min),弃去BSA。用BSA 按照1∶150比例稀释一抗,覆盖切片,4 ℃反应过夜。等渗盐水冲洗切片3 次,3 min/次,再用等渗盐水按照1∶100稀释二抗,覆盖切片,4 ℃反应30 min。等渗盐水冲洗切片3 次,2 min/次,再用等渗盐水按1∶500稀释4',6-二脒基-2-苯基吲哚(DAPI),室温避光下对切片染色1 min,等渗盐水冲洗切片3 次,随后用激光共聚焦显微镜观察。
1.3.4 肠壁胶质纤维酸性蛋白(glial fibrillary acid protein,GFAP)阳性细胞数观察 肠管冰冻切片进行GFAP 标记免疫荧光染色。逆行游离末端回肠,结扎部分回肠系膜,截取5 cm 肠管以中性甲醛固定,进行常规石蜡包埋切片,HE 染色和GFAP 标记免疫组化染色。病理科医师计算每个视野下肠黏膜及黏膜下的GFAP 阳性标记细胞数量并取平均值。
1.4 统计学分析 采用GraphPad Prism 6.01 软件进行统计分析,计量资料以均数±标准差()表示。多组间均数比较采用单因素方差分析(one-way ANOVA)。以P≤0.05 为差异有统计学意义。
2 结 果
2.1 血浆FD4 水平 迷走神经刺激1 h 和6 h,血浆FD4 浓度显著低于同一时间的对照组(P <0.01,P <0.05)。见图1。
2.2 血浆IL-6、TNF-α、iFABP、D-LA 水平 迷走神经刺激6 h 和24 h,iFABP 浓度显著高于同一时间点的对照组(P <0.05);IL-6、TNF-α、D-LA 浓度虽然高于同一时间点对照组,但差异无统计学意义(P >0.05)。见表1。
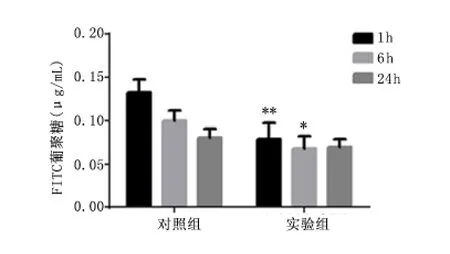
图1 血浆中FITC-葡聚糖浓度比较Figure 1 The concentration of plasma FD4
2.3 肠黏膜中紧密连接蛋白水平 Western blot 结果显示实验组迷走神经刺激1、6、24 h,肠黏膜屏障中紧密连接蛋白Claudin、Occludin、Zo-1 表达水平均显著高于同时期对照组(P <0.01),见图2。免疫荧光激光共聚焦实验结果显示迷走神经刺激6 h Claudin1/2、Zo-1 蛋白在肠黏膜屏障的表达和分布多于对照组,见图3、图4。迷走神经刺激1、6、24 h,Occludin 蛋白在肠黏膜屏障的表达和分布多于对照组,见图5。免疫荧光激光共聚焦显微镜的观察结果与Western blot 的结果基本一致。
表1 大鼠血浆中IL-6、TNF-α、iFABP、D-乳酸D-LA 浓度比较(x±s,n=4)Table 1 Comparison of concentrations of plasma IL-6,TNF-α,iFABP,D-LA checked by ELISA,n=4)
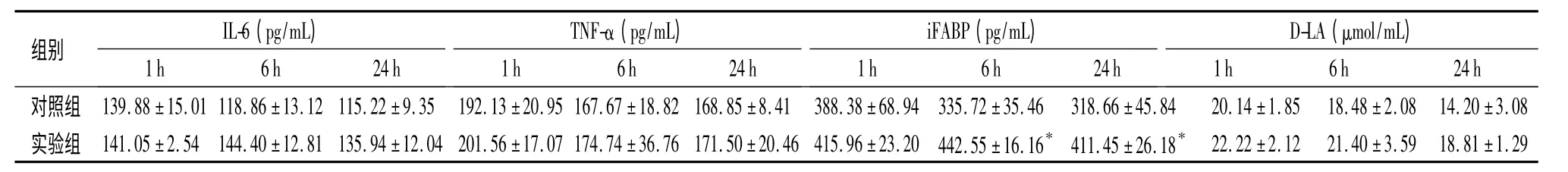
表1 大鼠血浆中IL-6、TNF-α、iFABP、D-乳酸D-LA 浓度比较(x±s,n=4)Table 1 Comparison of concentrations of plasma IL-6,TNF-α,iFABP,D-LA checked by ELISA,n=4)
与对照组同一时间比较,*P <0.05
IL-6(pg/mL)TNF-α(pg/mL)iFABP(pg/mL)D-LA(μmol/mL)组别1 h 6 h 24 h 1 h 6 h 24 h 1 h 6 h 24 h1 h 6 h 24 h对照组 139.88±15.01 118.86±13.12 115.22±9.35 192.13±20.95 167.67±18.82 168.85±8.41 388.38±68.94 335.72±35.46 318.66±45.84 20.14±1.85 18.48±2.08 14.20±3.08实验组 141.05±2.54 144.40±12.81 135.94±12.04 201.56±17.07 174.74±36.76 171.50±20.46 415.96±23.20 442.55±16.16* 411.45±26.18*22.22±2.12 21.40±3.59 18.81±1.29
2.4 肠壁中GFAP 阳性细胞数 对照组及实验组冰冻切片免疫荧光均可见GFAP 阳性细胞,见图6。免疫组化结果表明,迷走神经刺激1 h,实验组GFAP 阳性细胞数显著高于对照组(P <0.01)。迷走神经刺激24 h,GFAP 阳性细胞数显著低于对照组(P <0.01);迷走神经刺激6 h,GFAP 阳性细胞数高于对照组,但差异无统计学意义(P >0.05),见图7、图8。
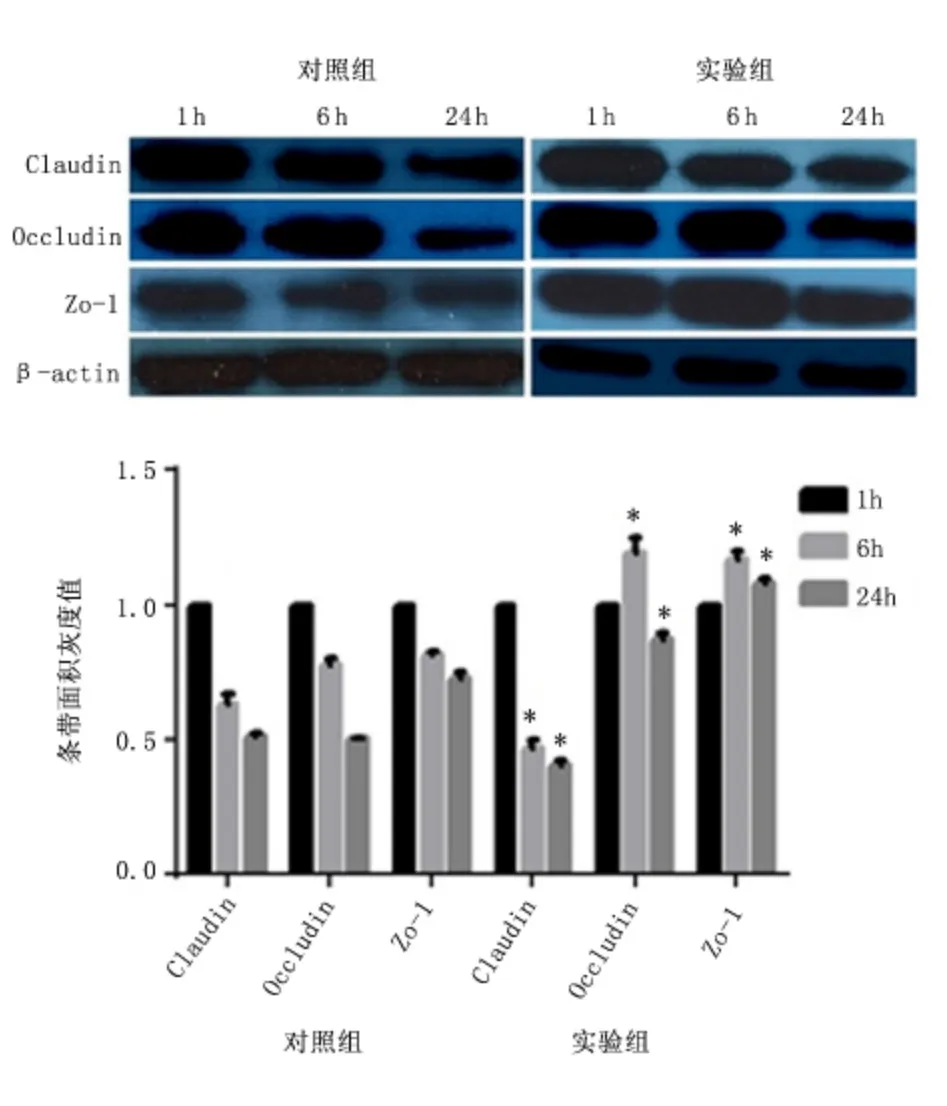
图2 Western blot 检测肠黏膜紧密连接蛋白表达水平Figure 2 The expression levels of tight junction protein in the intestional barrier checked by Western blot
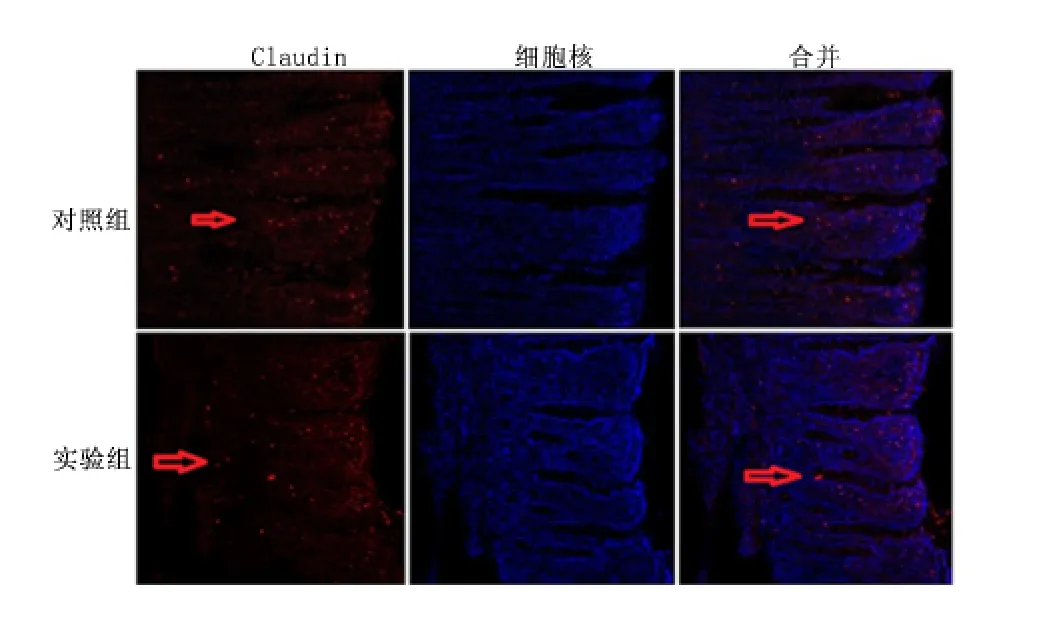
图3 激光共聚焦显微镜观察迷走神经刺激6 h Claudin 蛋白表达Figure 3 The expressions of Claudin checked by confocal laser scanning microscope at the sixth hour by vagus nerve stimulation
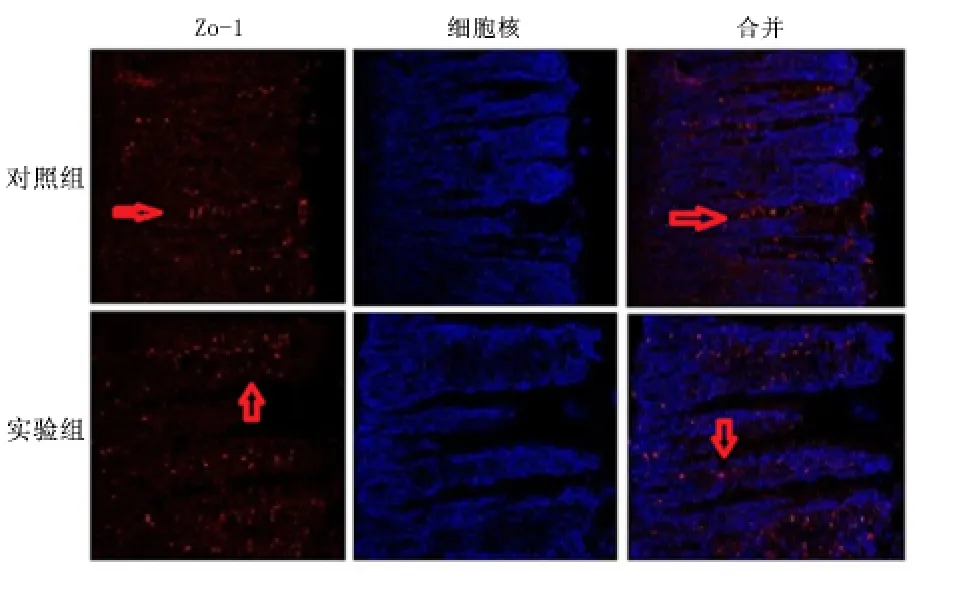
图4 激光共聚焦显微镜观察迷走神经刺激6 h ZO-1 蛋白表达Figure 4 The expressions of ZO-1 checked by confocal laser scanning microscope at the sixth hour by vagus nerve stimulation
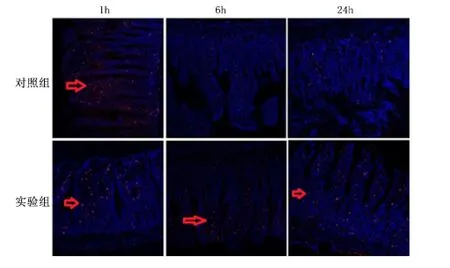
图5 激光共聚焦显微镜观察迷走神经刺激Occludin 蛋白表达Figure 5 The expressions of Occludin checked by confocal laser scanning microscope at the first,sixth and 24th hour by vagus nerve stimulation
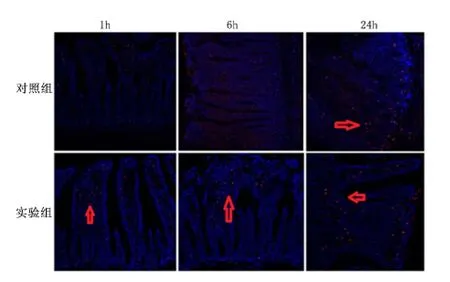
图6 激光共聚焦观察迷走神经刺激GFAP 蛋白表达Figure 6 The expressions of GFAP checked by confocal laser scanning microscope at the first,sixth and 24th hour by vagus nerve stimulation
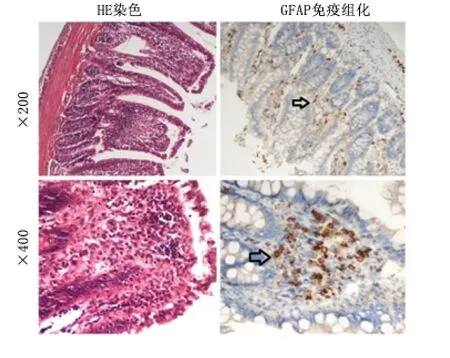
图7 肠黏膜屏障石蜡切片HE 染色和GFAP 的免疫组化染色切片Figure 7 HE stain and immune histology chemistry of GFAP in intestinal mucosal barrier
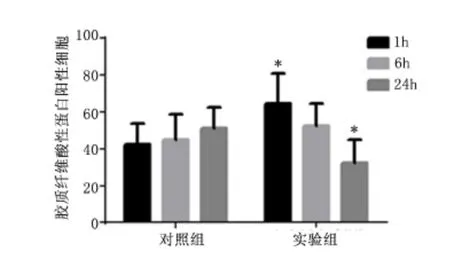
图8 免疫组化观察迷走神经刺激1、6、24 h GFAP 阳性细胞数Figure 8 The number of GFAP positive cells checked by immune histology chemistry at the first,sixth and 24th hour by vagus nerve stimulation
3 讨 论
机械屏障是肠黏膜屏障的基础,是以完整的肠黏膜上皮细胞及上皮细胞间的连接组成。紧密连接是肠黏膜上皮细胞间最主要的连接方式,只允许离子和小分子可溶性物质通过,阻止毒性物质大分子与微生物通过。机械屏障包括肠蠕动功能,能减少细菌在肠黏膜的时间,起到自洁功能[8]。动物实验已证明内毒素血症[9],失血[10]等模型中,电刺激迷走神经能够减轻炎症反应引起的组织损害和器官功能障碍[11]。
iFABP 是一种在大多数哺乳动物肠上皮细胞中广泛表达的细胞质蛋白,对长链脂肪酸和其他疏水配体高亲和力,其参与小肠中脂类的摄取和运输。体外和体内实验均证实iFABP 在肠脂类代谢和全身能量平衡中具有重要的功能。肠上皮损伤时,会导致iFABP 释放入血,从而可以间接衡量肠上皮损伤的程度[12]。
D-LA 是肠道固有微生物的代谢终产物,哺乳动物不具备将其快速代谢的能力,其血浆水平变化可部分反映肠通透性的改变[13]。孙晓庆等[14]报道,肠缺血-再灌注损伤、烫伤、急性坏死性胰腺炎模型中,血浆D-LA 可作为肠黏膜损伤、肠屏障通透性改变及肠源性内毒素血症形成的预警指标。
TNF-α 和IL-6 是重要的调节炎症反应的细胞因子,Ayala 等[15]报道,乙醚麻醉SD 大鼠,进行剖腹手术、缝合创口、动脉插管,进行失血处理,分别测定创伤和失血后血浆中IL-6 和TNF-α 表达水平,发现创伤诱导IL-6 水平升高,失血造成TNF-α 水平升高。
我们的研究显示迷走神经刺激6 h 和24 h,实验组iFABP 浓度显著高于同一时间点的对照组,此结果需要进一步研究以明确其原因。而IL-6、TNF-α、D-LA 浓度虽高于同一时间点对照组,但差异无统计学意义,说明迷走神经刺激对全身的炎症反应有一定影响,可能与迷走神经刺激的部位、强度、作用时间等有关。迷走神经刺激1 h 和6 h,血浆FD4 浓度显著低于同一时间的对照组,说明迷走神经刺激使腹部创伤模型大鼠的肠黏膜屏障通透性降低,这有助于保护机体,防止细菌和毒素趁机突破肠屏障进入血液,导致脓毒血症。
Western blot 结果表明,迷走神经刺激1、6、24 h,肠黏膜屏障中紧密连接蛋白Claudin1/2、Occludin、ZO-1 表达水平均显著高于同时期对照组,而免疫荧光激光共聚焦的结果与Western blot 的结果基本一致。说明迷走神经刺激使腹部创伤大鼠肠上皮细胞间的紧密连接蛋白表达增加,这是构成其降低肠通透性的基础,与实验组血浆FD4 浓度降低的结果相符。
有实验表明,肠胶质细胞活化能够通过改变紧密连接蛋白的表达,增强肠屏障功能。在烧伤模型中,迷走神经刺激能够防止烧伤引起的肠屏障损伤。在烧伤前进行迷走神经刺激使肠壁中GFAP 表达增高;烧伤后注射一种由活化的肠胶质细胞释放的信号分子S-亚硝基谷胱甘肽(S-nitrosoglutathione,GSNO),可起到与迷走神经刺激相似的保护作用[3]。
冰冻切片免疫荧光可见实验组的GFAP 阳性细胞,同时免疫组化实验结果显示实验组迷走神经刺激1 h,GFAP 阳性细胞数显著高于对照组,刺激24 h,GFAP 阳性细胞数显著低于对照组,说明肠胶质细胞GFAP 在迷走神经刺激1h 表达增加,肠胶质细胞活动明显增强,从而稳固肠屏障平衡。但是在迷走神经刺激24 h 却表达下降,这与Costantini 等[5]在烧伤小鼠模型中观察到的迷走神经刺激结果一致,具体机制有待更进一步研究。
迷走神经刺激对腹部创伤后肠屏障的影响较为复杂,可能与改变肠胶质细胞的活跃度及功能相关,但还需要进一步深入研究,从而为临床治疗提供更多样化的思路。
[1] 何长生,虞文魁,石佳靓,等.体外膜肺氧合联合持续肾替代治疗对肠黏膜屏障功能影响的实验研究[J].医学研究生学报,2013,26(10):1019-1023.
[2] 李 赟,吴晓滨,杜艳萍,等.应用代谢组学方法研究肠内给予丙氨酰谷氨酰胺对大鼠肠缺血再灌注损伤的保护作用[J].医学研究生学报,2012,25(3):234-240.
[3] Luyer MD,Greve JW,Hadfoune M,et al.Nutritional stimulation of cholecystokinin receptors inhibits inflammation via the vagus nerve[J].J Exp Med,2005,202(8):1023-1029.
[4] Ghia JE,Blennerhassett P,Kumar-Ondiveeran H,et al.The vagus nerve:a tonic inhibitory influence associated with inflammatory bowel disease in a murine model[J].Gastroenterology,2006,131(4):1122-1130.
[5] Costantini TW,Bansal V,Krzyzaniak M,et al.Vagal nerve stimulation protects against burn-induced intestinal injury through activation of enteric glia cells[J].Am J Physiol Gastrointest liver physiol,2010,299(6):G1308-G1318.
[6] 岳 超,赵允召.生长激素在脓毒症中应用的研究进展[J].医学研究生学报,2013,26(8):871-874.
[7] Neunlist M,Toumi F,Oreschkova T,et al.Human ENS regulates the intestinal epithelial barrier permeability and a tight junction-associated protein ZO-1 via VIPergic pathways[J].Am J Physiol Gastrointest Liver Physiol,2003,285(5):G1028-G1036.
[8] 任小龙,丁连安,曲林林.他克莫司对小鼠肠黏膜结构的影响[J].肠外与肠内营养,2014,21(3):172-174,178.
[9] 石德光,胡 森,姜小国,等.迷走神经兴奋对内毒素血症大鼠肝脏氧自由基及TNF-α 的影响[J].中国现代医学杂志,2003,13(20):35-38.
[10] Velasco IT,Baena RC.The role of the vagus nerve in hypertonic resuscitation of hemorrhagic shocked dogs[J].Braz J Med Biol Res,2004,37(3):419-425.
[11] 杜明华,罗红敏,赵增凯,等.电针足三里对肠缺血/再灌注大鼠肠通透性的影响[J].中国中西医结合急救杂志,2014,21(2):117-121.
[12] Gajda AM,Storch J.Enterocyte fatty acid-binding proteins(FABPs):Different functions of liver and intestinal FABPs in the intestine[J].Prostaglandins Leukot Essent Fatty Acids,2015,93:9-16.
[13] Smith SM,Eng RH,Buccini F.Use of D-lactic-acid measurement in the diagnosis of bacterial infections[J].J Infect Dis,1986,154(4):658-664.
[14] 孙晓庆,付小兵,张 蓉,等.创伤后肠道通透性改变血浆标志物D-乳酸的实验研究[J].中国危重病急救医学,2000,12(8):476-478.
[15] Ayala A,Wang P,Ba ZF,et al.Differential alterations in plasma IL-6 and TNF levels after trauma and hemorrhage[J].Am J Physiol,1991,260(1 Pt 2):R167-R171.
