胸壁包块起病的多发性骨髓瘤诊治
2015-05-07翟勇平周小钢
翟勇平,周小钢,宋 萍,强 勇
0 引 言
多发性骨髓瘤(multiple myeloma,MM)是常见的血液肿瘤,据国外统计MM 发病率已超过白血病。其临床表现多样,首发症状为骨痛、肾功能不全等非血液系统症状,首诊多在骨科、肾脏科等相关科室,易造成漏诊和误治[1]。为提高对MM 诊断和治疗的认识,现将我院内科查房中1 例以胸壁包块起病的MM 病例的诊治过程和经验进行分析讨论。
1 病例介绍
患者,男性,44 岁,因“右胸背麻木1 年余,左胸背痛10 余天”于2014 年12 月11 日以“胸壁肿块”入我院心胸外科治疗。患者2013 年10 月无诱因感右胸背麻木,无发热、胸痛,无盗汗、出血等,未重视。2014 年12 月初无诱因左胸背痛,仰卧、搬举重物时加重,无发热、盗汗,无咯血、呼吸困难等,至当地医院检查胸部CT:左侧多发肋骨骨质破坏。既往史:自诉15 岁时患有白癜风。40 岁左右于当地医院胃镜诊断“胃溃疡”,已愈。余无特殊病史。体格检查:体温36.7 ℃,脉搏74 次/min,呼吸16 次/min,血压108/71 mmHg(1 mmHg=0.133 kPa)。浅表淋巴结未触及,胸骨无压痛,左侧后胸壁第5、11 肋骨可见局限性肿块,第5 肋骨肿块较大约2×4×8 cm,质中,固定,表面皮肤颜色正常,两肺呼吸音清,未闻及干湿啰音及胸膜摩擦音。心律齐,各瓣膜区未闻及病理性杂音,腹软,无压痛、反跳痛,肝脾肋下未触及肿大。脊柱生理曲线存在,活动自如,双下肢无浮肿。入院诊断为多发肋骨骨质破坏待查。
临床检查:白细胞6.5×109个/L,血红蛋白128 g/L、血小板137×109/L。清蛋白32.3 g/L、球蛋白32 g/L。胸部CT:胸8 椎体、左侧第5、11 肋骨、右侧第6 肋骨骨质破坏,伴局部软组织肿块形成,见图1。于2014 年12 月15 日在全身麻醉下行开胸探查+左上肺楔形切除+左侧第5、11 肋骨部分切除术,术中见左侧第5 肋局部隆起,大小约8×5 cm,质硬、活动度差,与左上肺部分粘连紧密;左侧第11肋局部隆起,大小约6×5 cm,质硬、活动度差。术后病理示左侧第5、11 肋骨浆细胞肿瘤,结合临床及免疫组化标记,符合MM,两处均侵犯周围软组织。免疫组化标记:瘤细胞κ(3+),λ(-),CD38(3+),CD138(3+),VS38C(3+),CD79α(3+),CD20(-),CD3(-),CD43(-),Ki-67(80%+),见图2。患者术后有盗汗,无胸背痛及麻木,精神可,体力正常。
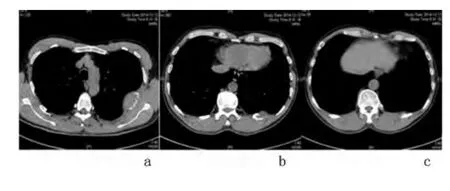
图1 患者术前胸部CT
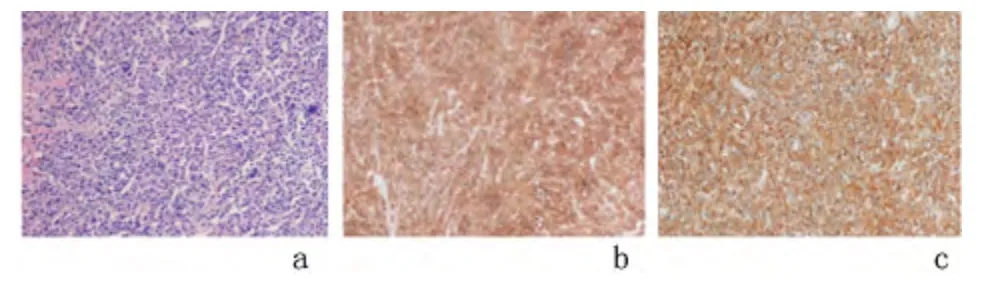
图2 患者左侧第5 肋骨及第11 肋骨部分切除术后病理(×10)
为进一步治疗,患者于2015 年1 月9 日以“浆细胞瘤”转入我院血液病科。转科检查:清蛋白32.7 g/L、球蛋白62.1 g/L、Cr 71 μmol/L。β2 微球蛋白4.10 mg/L,IgG 53.7 g/L、IgM 0.812 g/L、IgA 1.62 g/L,κ 轻链38 g/L、λ 轻链2.3 g/L。尿κ 轻链32.3 mg/24 h、尿λ 轻链<50.0 mg/24 h。血清游离轻链:κ/λ=10.9。血清免疫固定电泳(serum immunofixation electrophoresis,sIFE)见κ 型IgG 单克隆条带。头颅X 线片可见一骨质低密度影,约0.5×0.5 cm,骨盆、胸腰椎X 线片无异常。骨髓象:成熟浆细胞0.5%。骨髓免疫分型:CD38+CD138+CD45+/dim+CD19+CD20-CD28-CD200-CD33-CD117-CD56-CD27+CD81+cKappa+cLambda+的多克隆性浆细胞占0.27%;CD38+/dim+CD138+CD45-CD19-CD20-CD28-CD200+CD33+CD56-CD117-CD27+CD81+cKappa+cLambda-的单克隆性浆细胞占0.5%。骨髓荧光原位杂交(fluorescence in situ hybridization,FISH):RB1、1q21、D13S319、P53、IGH 均未见异常。骨髓染色体:46,XY[20]。骨髓活检示浆细胞瘤。免疫组化结果:CD138(3+),CD38(2+),CD68(5%+),CD163(5%+),κ(2+),λ(-),Ki-67(1%+),见图3。明确诊断为多发性骨髓瘤(IgG κ 轻链型DS ⅢA 期/ISSⅡ期)
自2015 年1 月13 日起予以硼替佐米+环磷酰胺+地塞米松方案化疗4 疗程,化疗后复查IgG 降至11.7 g/L,骨髓浆细胞未见,sIFE 仍阳性。评估疗效为非常好的部分缓解(very good partial response,VGPR)。目前已完成造血干细胞动员及采集,拟进行自体外周血造血干细胞移植术。

图3 患者骨髓穿刺活检病理(×10)
2 病例讨论
医学影像科吴新生副主任医师:MM 常伴溶骨性病变,影像学上可使用X 线摄片[2]、CT 等常规手段确定,MRI、ECT、PET/CT 等可提高诊断敏感性[2-6]。本例患者术前CT 示左侧多发肋骨骨质破坏伴局部软组织形成,需考虑局部肿瘤或骨转移癌、纤维囊性骨炎等疾病,肿瘤性可能较大。胸椎多发骨质破坏,需要考虑单纯骨质疏松等鉴别。单纯骨质疏松和MM 均可表现为广泛骨质疏松或压缩性骨折,有时难以鉴别。骨转移癌多侵犯椎弓根及毗邻的椎体,而MM 骨病通常涉及髓腔[2]。
心胸外科强勇主治医师:本例患者发病时以胸壁肿块、肋骨破坏为主要表现。需重点考虑以下疾病:①原发胸壁肿瘤,多来源于肋骨(80%)或胸骨(20%),恶性者居多[7]。如:各种肉瘤软骨肉瘤,恶性纤维组织细胞瘤,也有少见如浆细胞瘤的病理类型。小部分肿瘤源于胸壁深层软组织,如神经类肿瘤、脂肪瘤、纤维瘤、血管瘤、肉瘤等。在条件许可下应尽早手术治疗。②转移性胸壁肿瘤,如肺癌、甲状腺癌、乳腺癌、肾以及肾上腺癌、前列腺癌、鼻咽癌的胸壁转移,转移至肋骨较为多见,常造成局部破坏或病理性骨折,但肿块多不明显。切除活检是重要依据,且活检与手术计划可同时进行,以免肿瘤种植、播散[7]。③其他如非特异性肋软骨炎、胸壁结核等,均具有各自特征。本例患者胸背部疼痛剧烈,胸壁肿块明显,拒绝穿刺活检,要求手术。结合胸腰椎骨质破坏手术指征明确,遂行手术治疗,并通过活检明确了病理诊断,为下一步的全身综合治疗提供依据。
骨科吴苏稼主任医师:本例患者同时出现肋骨和胸椎的骨质破坏,骨肿瘤性疾病需重点考虑。常见累及骨的肿瘤中,MM 发生率最高,达95% ~100%。MM 和多发性骨转移癌的鉴别要点:MM 溶骨性病变呈虫蚀样破坏,骨膨胀性改变,可出现特异性肿瘤指标(M 蛋白)。而转移癌脊柱、骨盆、四肢长骨多发,骨破坏表现多样,易侵犯骨皮质。在临床实践中出现中老年男性骨的单发或多发破坏,有疼痛症状,骨质疏松症难以解释,应着重排除MM 的诊断。对于脊髓压迫、脊柱不稳定或脊柱骨折易发生脊髓压迫、脊椎压缩性骨折内科治疗后仍有顽固型的疼痛[2,4,9],可考虑行椎骨成形术或椎体后突成形术。长骨病理性骨折或有骨折风险,可行肿瘤切除加长骨稳定性的重建[2,4,8]。患者起病时为肋骨病变,手术活检是明确病灶性质的手段。虽然脊柱也有病变,但并无脊椎不稳、脊髓压迫、顽固性疼痛等手术指征,治疗上仍可以内科为主。但作为骨科医师,对老年多发骨质破坏的鉴别,需认识到MM 的可能。
病理科马捷副主任医师:病理可对活检部位浆细胞瘤作出诊断。浆细胞瘤形态上可分为成熟型、多形型和间变型。免疫表型为浆细胞表型阳性:CD138,CD38,VS38c;克隆性表达:Kappa 或lamda;CD79a+(50%病例),CD20-;也会出现令人困扰的阳性标记:EMA、CD43、CD31 等。鉴别诊断分为:①成熟型,反应性浆细胞增生(浆细胞肉芽肿)、Castleman 病(浆细胞型)、IgG4 相关性疾病淋巴浆细胞性淋巴瘤;②间变型,间变性癌、具有间变形态的淋巴瘤、恶性黑色素瘤[10]。本例患者病理呈典型的浆细胞瘤表现。浆细胞瘤诊断后,往往需要明确骨髓浆细胞累及的情况。本例患者骨髓穿刺涂片显示浆细胞仅0.5%。骨髓穿刺活检病理显示:弥漫成片排列的异常浆细胞,因此,骨髓活检较骨髓穿刺抽液更为敏感准确。
放疗科朱锡旭主任:放射治疗是孤立性浆细胞瘤的标准治疗,单纯放疗80%可达到较好的局部控制率。MM 患者对化疗和双磷酸盐治疗后仍无法缓解的顽固性骨疼痛,椎体不稳、即将发生的病理性骨折和脊髓压迫,可采用局部放疗有效迅速预防和缓解[4,9]。放疗技术上,适形放疗是最常使用的方法。射波刀在危险结构旁肿瘤的治疗中有一定优势。本例患者诊断MM,并非孤立性浆细胞瘤,骨病变部位多发、广泛,且未出现脊髓不稳、脊髓压迫、病理性骨折、顽固性疼痛等局部放疗的指征,放射治疗并不作为选项。
血液病科周小钢、宋萍主治医师:除上述科室所考虑的疾病以外,从血液病角度应鉴别以下疾病:①恶性淋巴瘤:原发于骨的淋巴瘤,可累及任何骨,长骨常见。影像学上可表现为溶骨性,病理是确诊的依据。②白血病:少数急性淋巴细胞性白血病可表现为多发骨质破坏,易误诊。但血象常有异常、骨髓象较易明确。③甲状旁腺功能亢进:甲状旁腺分泌过多甲状旁腺素而引起的钙磷代谢失常。主要表现为骨骼改变、泌尿系结石,原发性甲旁亢可表现为高钙,继发性甲旁亢可表现为低钙。X 线检查或CT 检查常可见明显的骨质疏松,甚至有明显的骨质破坏,酷似骨肿瘤。而本例患者并无钙磷代谢的问题。④浆细胞肿瘤:起源于浆细胞的肿瘤分为浆细胞瘤和MM 等形式,浆细胞瘤分为孤立性骨浆细胞瘤、髓外浆细胞瘤、多发孤立性浆细胞瘤。
本例患者肋骨病理确定为浆细胞瘤,是多发孤立性浆细胞瘤还是MM 需要鉴别,首先要判断是否累及骨髓,本患者骨髓形态成熟浆细胞0.5%,不支持累及骨髓,但是一般认为骨髓涂片敏感性低于骨髓活检[11]。经活检证实骨髓存在大片异常浆细胞。第二要判断有无骨髓瘤靶器官损害。在明确骨髓存在浆细胞瘤的前提下,患者肋骨和椎体的破坏以及软组织的侵润可视为MM 的骨病变。且手术切除主要病灶后球蛋白水平仍快速上升(自32 g/L 升至62.1 g/L),可间接反映M 蛋白的上升,不符合孤立性浆细胞瘤的特征,应诊断为MM,分型为IgG κ 轻链型,ISS Ⅱ期。患者FISH 检测未见异常,染色体正常核型,属mSMART 分层标危组[12]。治疗上选择以硼替佐米联合方案诱导治疗后续大剂量马法兰预处理加自体造血干细胞支持[13]。
血液病科翟勇平主任:通过此例患者诊治过程的讨论,反映出MM 涉及多个学科[1]。据我科200多例MM 统计初治科室34%为骨科,15%为血液科,11%为肾脏科,消化科和呼吸科为8%,还有内分泌、脑外科、耳鼻喉科和胸外科等。可以看出多数MM 患者首诊科室并非血液科。另外,MM 患者的诊断需要病理学、免疫学、分子生物学等相关科室,在治疗方面需要放疗、透析支持、骨科手术、辅助呼吸等方法。所以需要多学科协作来进一步提高MM的认识水平和诊治水平。近年来MM 治疗有了明显发展,新药的广泛应用使得疗效大幅提高。为了使患者最大获益,必须系统的、连续的规范化治疗治疗。目前MM 治疗分为初始治疗、巩固治疗和维持治疗等3 个阶段,每个阶段的治疗目标不同。治疗过程中还需考虑患者年龄、体能状况、合并症等多种相关因素,这样才能做出正确的治疗选择。尽管新药明显提高了疗效,MM 目前仍被认为是不可治愈的疾病,为获得更高和更持久的疗效需要进行治疗方案优化探索。如新药合理剂量的研究、不同药物对MM 克隆演变的影响等,这些将会为更合理的改进治疗方法提供依据。
3 结 语
MM 逐渐成为常见的血液病,其临床表现和治疗多样,涉及多学科,多学科协作诊治正成为趋势。随着新药的广泛应用、辅助治疗手段的改进,MM 患者的生存时间以及生存质量均明显提升,能使MM 患者获益的关键在于正确的早期识别、及时的诊断以及规范的治疗。
[1] 林志美,朱焕玲,饶 进,等.多发性骨髓瘤127 例首发表现及首诊科室分析[J].临床误诊误治,2013,26(4):25-27.
[2] 陈 竺,陈赛娟.威廉姆斯血液病学[M].北京:人民卫生出版社,2011:1527-1560.
[3] 杨晓萍,张 茜,刘光耀.脊柱多发性骨髓瘤的MR 诊断价值[J].解放军医药杂志,2013(8):58-60.
[4] 中华医学会血液学分会.多发性骨髓瘤骨病诊治指南[J].中华血液学杂志,2011,32(10):721-723.
[5] 吉蘅山,胡裕效,朱 虹.急性胰腺炎为首发表现的多发性骨髓瘤的PET/CT 显像分析[J].医学研究生学报,2010,23(12):1341-1342.
[6] 胡裕效,季发权,朱 虹.多发性骨髓瘤18 氟-脱氧葡萄糖PET/CT 表现分析[J].医学研究生学报,2008,21(12):1343-1344.
[7] 刘勇恩,刘宝恩,刘渊浩.胸壁肿瘤62 例诊断和治疗的探讨[J].华西医学,2008,23(4):859.
[8] Hameed A,Brady JJ,Dowling P,et al.Bone disease in multiple myeloma:pathophysiology and management[J].Cancer Growth Metastasis,2014,7:33-42.
[9] Terpos E,Morgan G,Dimopoulos MA,et al.International myeloma working group recommendations for the treatment of multiple myeloma-related bone disease[J].J Clin Oncol,2013,31(18):2347-2357.
[10] 韩秀娟,薛 力,张 伟,等.胸膜浆细胞瘤1 例报道及其临床病理特征分析[J].2007,15(80):1167-1168.
[11] 周 凡,雷 畅,郭步云.骨髓活检及涂片对多发性骨髓瘤的诊断价值的比较[J].临床军医杂志,2011,39(4):752-754.
[12] Mikhael JR,Dingli D,Roy V,et al.Management of newly diagnosed symptomatic multiple myeloma:updated Mayo Stratification of Myeloma and Risk-Adapted Therapy(mSMART)consensus guidelines 2013[J].Mayo Clin Proc,2013,88(4):360-376.
[13] Fermand JP,Katsahian S,Divine M,et al.High-dose therapy and autologous blood stem-cell transplantation compared with conventional treatment in myeloma patients aged 55-65 years:Long term results of a randomized control trial from the Group Myeloma-Autogreffe[J].J Clin Oncol,2005,23(36):9227-9233.
