低聚果糖检测分析方法对比及优劣性分析
2015-05-05张丽君
张丽君
(量子高科(中国)生物股份有限公司,广东江门 529081)
低聚果糖检测分析方法对比及优劣性分析
张丽君
(量子高科(中国)生物股份有限公司,广东江门 529081)
低聚果糖是一种功能性低聚糖,具有良好的生理功效,近年来,低聚果糖在食品工业中的应用范围不断扩大,利用现代检测技术对食品中低聚果糖的含量进行检测具有必要性。不同来源的低聚果糖不仅存在组分果糖链链长的不同,而且化学结构也不尽相同。本文系统地综述了近年来国内外检测低聚果糖的方法,包括高效液相色谱法、离子色谱法等较常用方法,以及分析了蔗果型低聚糖异构体的新检测手段,并总结了各自的优劣性,为低聚果糖有效、快速检测提供参考。
低聚果糖,高效液相色谱,离子色谱,检测
低聚果糖(FOS),又称果寡糖、果糖低聚糖或果聚糖,是一种水溶性膳食纤维,由蔗糖和1~3个果糖分子通过β(2→1)和β(2→6)糖苷键与蔗糖中的果糖基结合而成,主要由蔗果三糖、蔗果四糖和蔗果五糖等组成的混合物。低聚果糖热值低,被人体摄入后,不被消化酶和胃酸降解,不被小肠消化吸收;具有促进肠道内有益菌的增殖,改善消化系统功能,提高免疫力,防止腹泻和便秘,促进钙吸收,调控血糖等生理功能[1-6],是目前唯一获得美国FDA认可为安全食品的低聚糖。目前,低聚果糖已作为一种功能性甜味剂被广泛应用于各种乳制品、婴幼儿食品、焙烤食品、糖果和饮料中[7-8],因此,随着食品特别是功能食品中的低聚果糖逐步引起社会的关注,对低聚果糖的含量情况进行监测,进而考察产品的功效,具有重要意义。
低聚果糖是由多种聚合度不同的碳水化合物单体组成的混合物,且不同来源生产的低聚果糖,其结构也有不同;同一种物质生成的低聚果糖,也存在同分异构体,因此,准确全面分析食品中低聚果糖的含量具有一定的难度。本文对国内外报道的关于低聚果糖产品及食品中低聚果糖的检测方法、应用现状作系统的综述,并对新的检测手段应用于低聚果糖的多样化结构检测作详尽的分析,以便为食品中低聚果糖的有效、快速检测提供一定的参考。
1 不同来源的低聚果糖成分分析
1.1 蔗糖来源
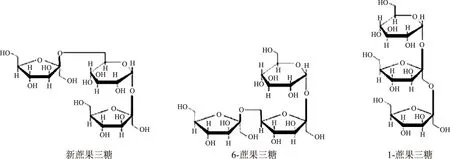
图1 蔗果三糖的三种化学结构Fig.1 Three chemical structure of kestose
以蔗糖为原料,利用黑曲霉或米曲霉产生的β-果糖基转移酶作用,形成以蔗果三糖(1-kestose,GF2)、蔗果四糖(nystose,GF3)和蔗果五糖(fructofuranosylnystose,GF4)为主要成分的直链低聚糖[9-10]。其实,蔗果型低聚糖除了现有的蔗果三糖、四糖和五糖的混合物之外,还有其同分异构体,但之前的研究,往往将异构体忽略。如蔗果三糖,按照其果糖基与蔗糖分子连接方式的不同分为三种类型。当果糖与蔗糖分子中的果糖基1碳位相连接时为1-蔗果三糖(1-kestose),为1F型[9];当果糖与蔗糖分子中果糖基6碳位相连接便形成6-蔗果三糖(6-kestose),即6F型;当一个果糖基与蔗糖分子中的葡萄糖基6碳位相连接形成新科斯糖(neokestose),即为6G型,此种三糖分子的两个末端组均是果糖基[11],见图1。
目前,用于检测低聚果糖含量的国家标准方法,都不包含蔗果型同分异构体,缘于对低聚果糖的研究不够深入以及没有相应的标准样品,过去的低聚果糖含量检测结果会相差较大。因此,对低聚果糖新结构的研究以及研发出相应的标准样品,配备相应的检测方法,对于提高低聚果糖含量检测的准确度有重大的意义。
1.2 菊苣来源
以菊粉(菊苣或菊芋产)为原料,通过酶解或酸解的方法而生成的聚合度为2~9的低聚糖,这种低聚糖中的果糖分子以β(2→1)糖苷键连接而成,其主要成分是果果三糖(inulotriose,F3)、果果四糖(inulotetraose,F4)和果果五糖(inulopentaose,F5)等,结构形式主要是Fn型(F是果糖分子,n是果糖分子数目,F1-F2-F3-F4…Fn),此外也含有一定量GFn型的蔗果型低聚糖,见图2。因此,菊粉水解产生的低聚果糖,不仅有Fn型的,还有GFn型的[12],果果型低聚果糖由于端基葡萄糖和果糖连接键的缺失,成为还原糖。此外,据研究,菊粉产生的低聚果糖不含有蔗糖产低聚果糖特有的新蔗果三糖、四糖。
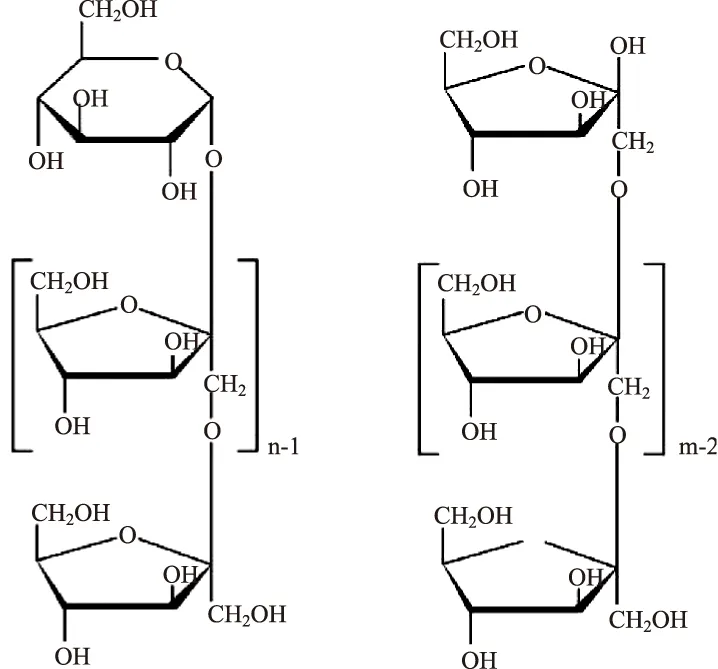
图2 GFn型和Fn型低聚果糖化学结构示意图Fig.2 Chemical structure diagram of GFn and Fn type FOS
2 低聚果糖常用分析检测方法
食品中低聚果糖检测方法主要有色谱法,包括薄层色谱法[13]、气相色谱法[14-15]、高效液相色谱法,另外,还有一些报道,使用液相色谱-质谱联用[16]、基质辅助激光解吸离子化质谱法[17]、气质联用[18]、核磁共振法等。
薄层色谱法是以薄层吸附剂为固定相,溶剂为流动相的分离分析技术,具有成本低、操作简便、快捷、灵敏度高、重现性好、不受试样挥发等优点,适用于低聚果糖的定性分析,但薄层色谱对糖的分离鉴定只有在负荷量很小的条件下才能达到满意效果,而且测定误差较大,不易进行定量分析,所需测定样品量较多。气相色谱法是以惰性气体为流动相的柱色谱法,具有分离性好,灵敏度高,分析速度快等优点。但样品要先制备成易挥发、热稳定的衍生物,才能上柱,而且,进样口温度高会使糖的衍生物分解,甚至可被留在进样口的残留物催化。沸点太高的物质或热稳定性差的物质不太适用,并且,该过程较费时且复杂,因此,在检测功能性低聚糖的应用上,薄层色谱法及气相色谱法受到了一定的限制。而高效液相色谱法则具有简便快速、操作方便、前处理简单、分离效果好,重现性好和不破坏样品等优点被最为广泛应用,原则上,对于高沸点,热稳定性差,相对分子量大的有机物都可以进行分离分析,不受试样挥发性的限制,因此,在低聚果糖的检测上广泛使用。目前,我国低聚果糖国家标准GB/T23528-2009规定,对低聚果糖含量的测定使用高效液相色谱法,经氨基柱分离,利用RID或者ELSD进行检测,用外标法或者峰面积归一化法定量[19]。
2.1 色谱法
在低聚糖的检测分析技术上,高效液相色谱法和离子色谱法的运用越来越多,尤其对其中的蔗果三糖、蔗果四糖、蔗果五糖进行检测,但未涉及到蔗果系列同分异构体的检测,也没有对不同来源的低聚果糖成分进行有效分离并分析对比。高效液相色谱法(high performance liquid chromatography,HPLC)是目前检测低聚果糖的主要方法,普及率高,具有操作简便、快速、分离效果好等特点。HPLC通常连接紫外检测器(ultraviolet detector,UVD)、荧光检测器(fluorescence detector,FLD)、示差折光检测器(refractive index detector,RID)和蒸发光散射检测器(evaporative lightscattering detector,ELSD)等。由于糖类物质在正常的紫外区和可见光范围内没有吸收或者吸收很弱,也无荧光,因此不经过衍生的糖无法使用UVD和FLD,一般使用RID或ELSD检测。
离子分离分析液相色谱技术是20世纪70年代在离子交换色谱法的基础上建立起来的[16],具有操作简便、快速灵敏、结果准确等优点,与HPLC法相比,其选择性更好,需样品量少,有毒试剂用量少,更为环保[17],一般与脉冲安培检测器连接,但目前国内应用该技术检测低聚果糖的较少。
2.1.1 高效液相色谱-示差检测器检测(HPLC-refractive index detector,HPLC-RID) 以乙腈和水作为流动相,氨基柱分离,示差检测器(RID)测定,可对低聚果糖进行定量和定性分析,这种方法最常见,但也存在如下缺点:对柱子产生影响:还原糖易与固定相的氨基发生化学反应,使氨基柱的使用寿命缩短;流动相乙腈易挥发,有毒,且价格昂贵;系统平衡需要时间长,不能梯度洗脱,灵敏度低,当样品有干扰组分时难以分离开。还有少量研究显示,使用碳水化合物柱或者糖柱分离。大量的外国文献报道以乙腈∶水(75∶25)作为流动相,流速在1.0 mL/min~1.5 mL/min之间,采用氨基柱,柱温30 ℃,测定食品中低聚果糖的含量[22-26]。Show-Ching Lin等[24]利用HPLC-RID,建立以乙腈和水为流动相,有效分离检测GF2、GF3、葡萄糖、蔗糖的分析方法。高晓娟[25]将试样经过滤膜过滤,以乙腈∶水(v/v)=70∶30作为流动相,柱温度为室温,用碳柱及示差折光检测器,对酒中的果糖、葡萄糖、蔗糖、蔗果三糖、蔗果四糖及蔗果五糖(有时还会有蔗果六糖)进行高效液相色谱法分离和测定,有很好的分离效果。龚红芳等[29]采用HPLC-RID分析了双歧杆菌发酵果蔬汁中的低聚果糖含量,采用ZORBAX NH2Analytical色谱柱,流动相为乙腈∶水(75∶25),柱温35 ℃,流速为1.0 mL/min,RID检测,有效分离果蔬汁中的低聚果糖及几种主要糖类。甘宾宾等[30]采用高效液相色谱法,水为流动相,μ-Bondapak C18柱分离,示差折光仪为检测器,测定保健食品中的果糖、蔗糖、蔗果三糖、四糖、五糖、六糖等,所得结果良好,低聚果糖的最低检出限在微克级,并且,分离到蔗果四糖、五糖、六糖的同分异构体,但由于含量少,仅作定性使用。许丽珠等[31]用HPLC-RID有效分离测定配方乳粉中7种单糖、双糖和低聚果糖,采用截留分子量3000的超滤离心管,10500 r/min离心10 min,去除样品溶液中的蛋白质、核酸和多糖等大分子物质,以乙腈-水(75∶25,v∶v)为流动相等度洗脱,Luna 氨基色谱柱分离,示差折光检测器检测。
2.1.2 高效液相色谱-蒸发光散射检测器检测(HPLC-evaporative light-scattering detector,HPLC-ELSD) 使用氨基柱和蒸发光散射检测器对低聚果糖进行检测。ELSD对非挥发性样品的分析克服了RID的不足,灵敏度高,且可以采用梯度洗脱。傅博强等[32]采用HPLC-ELSD的方法检测乳制品、糕点、酒类、饮料、糖果等食品中添加的低聚果糖含量,以水和乙腈为流动相,梯度洗脱,氨基色谱柱分离。其中,对于不同样品,前处理方式各异。对脂肪含量大于20 g/100 g的奶粉、婴儿米粉,需进行脱脂处理。奶粉类、乳酸菌饮料、糖果用乙腈脱蛋白,米粉、月饼等用亚铁氰化钾溶液和硝酸锌溶液脱蛋白,最后,再用0.45 μm的水相微孔滤膜过滤。张媛媛等[33]用HPLC-ELSD法同时对葡萄糖、果糖、蔗糖、蔗果三糖、四糖和五糖进行测定,以乙腈-水为流动性,梯度洗脱,氨基柱分离,六种糖组分有效分离,回收率为97.62%~99.55%,RSD小于3%。王银珍等[34]使用HPLC-ELSD法测定乳制品中低聚果糖含量,样品经80%乙醇沉淀蛋白,超声波提取2~3次处理后,以乙腈/水(70/30,v/v)为流动相,氨基柱分离,蒸发光散射检测器检测,样品检出限均为150 μg·mL-1,样品加标平均回收率96.6%~106.0%,RSD为1.57%~2.84%,结果满意。李灿等[35]用HPLC-ELSD法实现同时分离检测乳饮料、配方奶粉、蜂蜜、果蔬汁饮料、月饼、糖果等食品中十种单糖、双糖和低聚果糖,对配方奶粉、月饼等高脂高蛋白的食品先用石油醚脱脂,亚铁氰化钾+乙酸锌溶液处理脱蛋白处理,对乳饮料使用三氯乙酸进行脱蛋白处理,处理后的样品以乙腈-水为流动相,梯度洗脱,NH2色谱柱分离,蒸发光散射检测器检测,十种糖均在0.1~5 mg/mL内具有良好的线性,检出限均在0.1 mg/mL以下,RSD 在1.71%~7.21%之间,回收率在97.91%~103.35%之间,结果较理想。
2.1.3 离子色谱 离子色谱是液相色谱的一种,具有优异的分离能力,灵敏度高,选择性好,样品用量少和易实现自动化等优点,采用高效阴离子交换色谱-脉冲安培检测器(High performance anion exchange chromatography-pulsed amperometric detector,HPAEC-PAD)在糖的检测中应用越来越多,还有一些使用电化学检测器检测,但该方法易受复杂基质的干扰。国际上[36]AOAC997.08对食品中果聚糖的检测采用的是阴离子交换色谱法,先用酶解法处理样品,间接测定低聚果糖含量,操作较为复杂,容易产生较大误差。目前,实际的检测中,利用阴离子交换色谱检测低聚果糖基本都是直接法,通过阴离子交换色谱柱分离低聚糖,脉冲安培检测器直接检测低聚果糖各组分含量。L’Homme 等[37]研究了用CarboPac PA100 色谱柱分离,脉冲安培检测新鲜水果(苹果、梨、李子、香蕉)和煮烂的水果中F2、GF2、GF3含量的方法,最低检出限为28 μg/g。Max Feinberg 等[38]则利用HPAEC-PAD法同时确定水果汁中的三氯蔗糖和低聚果糖,从而更好地对食品加工过程和质量生产进行严格控制。张绩觅和刘玉峰等[39-40]用磺基水杨酸作为沉淀剂去除蛋白,NaOH和醋酸钠淋洗液梯度淋洗,CarboPacTMPA1(4 mm×250 mm)阴离子交换柱,氢氧化钠和乙酸钠淋洗液梯度淋洗分离,脉冲安培检测器检测奶粉、奶伴侣、低聚果糖口服液、液体奶中低聚果糖含量,奶粉与标示值接近,另外,测定低聚果糖口服液6份,RSD为2.31%~5.14%,三种低聚糖的加标回收率在96.23%~105.03%之间,测定含FOS的液态奶6份,RSD<9%,3种糖的加标回收率在94.8%~103.6%之间。耿丽秋等[41]利用HPAEC-PAD测定乳粉中低聚果糖,样品经50%(v/v)乙醇水溶液提取,亚铁氰化钾溶液+乙酸锌溶液沉淀蛋白,用水、NaOH溶液和NaAc溶液三元梯度淋洗,CarboPac PA200阴离子交换色谱柱分离,脉冲安培检测器检测,GF2、GF3、GF4的平均回收率为86.0%~114.0%,适用于乳粉中低聚果糖的测定。
综上所述,对食品中低聚果糖的检测技术已经越来越成熟,要提高测量的准确性,对样品的前处理也很重要,对于脂肪和蛋白含量较高的食品,要进行脱脂和脱蛋白处理,脂肪的处理通常采用石油醚,蛋白的去除使用乙酸锌与亚铁氰化钾溶液、硫酸铜与氢氧化钠溶液或调溶液pH=4.5、磺基水杨酸、乙醇、乙腈等方法,定性定量测定使用高效液相色谱或离子色谱等均可有效测定蔗果三糖、蔗果四糖、蔗果五糖的定性定量检测,且方法精确性和重复性都较高,操作相对简单,适用范围广。
3 低聚果糖新结构的检测及分析应用
一直以来,蔗果低聚糖的检测只是考虑蔗果三糖、四糖、五糖、六糖等,随着研究的深入,蔗果低聚糖的同分异构体也被越来越多地认识,且其也有显著的功效,因此,对于低聚果糖含量的检测应该包含异构体,这有助于提高低聚果糖含量检测的准确度,也对于低聚果糖的深入认识有重要的意义。
之前,国际上一直没有蔗果低聚糖异构体的标准样品,因此,对低聚果糖含量的检测存在争议,现在经过多年的研究,已成功研制出6种低聚果糖标准品,再配上高效阴离子交换色谱(HPAEC)分析法,那么,低聚果糖含量的检测则有了标准,完善一直以来低聚果糖含量检测存在的争议问题。该方法有效分离蔗果三糖、新蔗果三糖、蔗果四糖、蔗果五糖,还可以有效分离蔗果型和果果型低聚糖组分,并能推测出低聚果糖的来源。并且,这方法已成功在奶粉及蛋白粉中低聚果糖含量的分析检测中应用。
4 结论
目前,食品中低聚果糖的检测分析主要是通过HPLC结合RID或ELSD的方法同步检测各类食品中的蔗果型低聚果糖(蔗果三糖、蔗果四糖和蔗果五糖)的含量,然后通过累加方式获得低聚果糖的含量;而目前对新蔗果三糖及果果型低聚果糖的分析研究鲜有报道,使用HPAEC-PAD法配合相关的标准样品,有效检测新蔗果三糖,并且,该方法有效分离蔗果型及果果型低聚糖。高效液相色谱在检测方面已经广泛应用,但离子色谱法的报道相对较少,这些方法整体操作简单,适用范围较广,但不同方法和技术都有各自的优缺点,需要根据实际情况选用合适的检测方法。随着对低聚果糖的研究越来越深入,低聚果糖组分及结构越来越清晰,利用现代检测技术对低聚果糖进行全面准确的分析具有十分重要的意义。
[1]Yen CH,Kuo YW,Tseng YH,et al. Beneficial effects of fructo-oligosaccharides supplementation on fecal bifidobacteria and index of peroxidation status in constipated nursing-home residents-A placebo-controlled,diet-controlled trial[J].Nutrition,2011,27(3):322-328.
[2]KleessenL B,Hartmann L,Blaut M. Fructans in the diet cause alterations of intestinal mucosal architecture,released mucins and mucosa-associated bifidobacteria in gnotobiotic rats[J].British Journal of Nutrition,2003,89(5):597-606.
[3]汪世华,彭利民,张会,等.低聚果糖的开发与应用[J].中国乳品工业,2002(2):31-34.
[4]张伟.低聚果糖及其制备的研究进展[J].生物学杂志,2000,17(1):7-8.
[5]江波,王璋.低聚果糖——一种具有优越生理学特性的新型食品甜味剂[J].无锡轻工大学学报,1995,14(2):183-185.
[6]罗予,孟林敏.低聚果糖体内外对肠道菌的影响[J].中国微生态学杂志,2003,15(6):321-322.
[7]Camuesco D,Peran L,Comalada M,et al. Preventative effects of lactulose in the trinitrobenzenesulphonic acid model of rat colitis[J].Inflammatory Bowel Diseases,2005,11(3):265-271.
[8]张帆,汪会玲,孟晶.低聚果糖对人体肠道菌群的影响[J].现代预防医学,2006,33(2):158-159.
[9]Marx S P,Winkler S,Hartmneier W. Metabolization ofβ-(2,6)-linked fructose oligosaccharides by different bifidobacteria[J].FEMS Microbiol Letters,2000,182:163-169.
[10]Yun J W. Fructooligosaccharides-Occurrence,preparation and application[J]. Enzyme and microbial technology,1996(19):107-117.
[11]苏丁,张静娟,徐学明.新科斯糖对肠道菌体外生长影响的研究[J].食品科学,2008,29(12):405-407.
[12]殷洪,林学进.菊粉、低聚果糖的研究进展[J].中国食品添加剂,2008(3):97-101.
[13]陈金玲,黄雪松.薄层色谱法快速检测大蒜低聚果糖[J].广东农业科学,2012,39(9):103-105.
[14]Hayashi S,Yoshiyama T,Fuji N,et al.Production of a novel syrup containing neofructooligosaccharides by the cells of Penicillium citrinum[J]. Biotechnology letters,2000,22(18):1465-1469.
[15]Joye D,Hoebregs H,Joye D,et al. Determination of oligofructose,a soluble dietary fiber,by high-temperature capillary gas chromatography[J]. Journal of AOAC international,2000,83(4):1020-1025.
[16]梁达清,黄晓兰,吴惠勤,等. HPLC/ESI-MS法测定巴戟天中的低聚糖[J].天然产物研究与开发,2009,21(3):456-460.
[17]Wang J,Sporns P,Low N H. Analysis of food oligosaccharides using MALDI-MS:quantification of fructooligosaccharides[J]. Journal of Agricultural and Food Chemistry,1999,47(4):1549-1557.
[18]Hayashi S,Yoshiyama T,Fuji N,et al. Production of a novel syrup containing neofructooligosaccharides by the cells of Penicillium citrinum[J]. Biotechnology Letter,2000,22:1465-1469.
[19]全国食品工业标准化技术委员会工业发酵分技术委员会.GB/T 23528-2009 低聚果糖[S].北京:中国标准出版社,2009.
[20]Small H,Stevens T,Baunann W. Novel ion exchange chromatographic method using conductimetrie detection[J]. Analytical Chemistry,1975,47(11):1801-1809.
[21]张维.离子色谱法在公共卫生检测中的新进展[J].中国卫生监督杂志,2012,19(1):44-49.
[22]Sheu D C,Lio P J,Chen S T,et al. Production of fructooligosaccharides in high yields using a mixed enzyme system of(-fructofuranosidase and glucose oxidase[J]. Biotechnology letters,2001,23(18):1499-1503.
[23]Chien C S,Lee W C,Lin T J. Immobilization of Aspergillus japonicus by entrapping cells in gulten for production of FOS[J]. Enzyme and microbial technology,2001,29(4/5):252-257.
[24]L’Hocine L,Wang Z,Jiang B,et al. Purification and partial characterization of fructosyl transferase and invertase from Aspergillusniger AS0023[J]. Journal of biotechnology,2000,81(1):73-84.
[25]Martins B,Armands V,Janis L,et al. The effect of osmo-induced stress on product formation by Zymomonas mobilis[J]. International journal of food microbiology,2000,55(1/3):147-150.
[26]Nishizawa K,Nakajima M,Nabetani H. A forced flow membrane reactor for transfructosylation using ceramic membrane[J]. Biotechnology and bioengineering,2000,68(1):92-97.
[27]Lin S C,Lee W C. Separation of a fructo-oligosaccharide mixture by hydrophilic interaction chromatography using silica-based micropellicular sorbents[J]. Journal of Chromatography A,1998,803:302-306.
[28]高晓娟. 配制酒中低聚果糖的测定[J]. 酿酒,2008,35(4):90-91.
[29]龚芳红,贺松,张德纯,等. 双歧杆菌发酵果蔬汁中低聚果糖的高效液相色谱法分析[J]. 中国微生态学杂志,2010,22(6):489-491.
[30]甘宾宾.高效液相色谱法测定低聚果糖的组分[J].色谱,1999,17(1):87-89.
[31]许丽珠,李秀英,黄金凤,等. 超滤离心净化-高效液相色谱法同时测定配方乳粉中的单糖、双糖和低聚果糖[J]. 食品安全质量检测学报,2015,6(2):633-638.
[32]傅博强,王晶,王远兴,等.食品中低聚果糖高效液相色谱法检测方法研究[J].食品工业科技,2010,31(9):370-374.
[33]张媛媛,聂少平,万成,等.高效液相色谱-蒸发光散射检测法同时测定了单糖、双糖及低聚果糖[J].食品科学,2009,30(18):237-239.
[34]王银珍,姚评佳,魏远安. 高效液相色谱-蒸发光散射检测法测定乳制品中低聚果糖的含量[J]. 食品工业,2009(2):71-73.
[35]李灿,陈英,李培,等. HPLC-ELSD同时分离检测食品中十种单糖、双糖和低聚果糖[J]. 食品工业科技,2013,34(7):309-313.
[36]AOAC Official Method 997.08. Fructans in food products ion exchange chromatographic method[EB].
[37]L’homme C,Peschet J L,Puigserver A,et al. Evaluation of fructans in various fresh and stewed fruits by high-performance anion-exchange chromatography with pulsed amperometric detection[J].Journal of chromatography A,2001,920(1/2):291-297.
[38]Max F,Jinadevi SR,Audrey A. Determination of complex polysaccharides by HPAE-PAD in foods:Validation using accuracy profile[J].Journal of chromatography B,2009,877(23):2388-2395.
[39]刘玉峰,李东,唐华澄,等.高效离子色谱法测定乳及乳制品中低聚果糖含量[J].乳业科学与技术,2012,35(1):40-42.
[40]张绩觅,刘玉峰,唐华澄,等.高效离子色谱法测定食品中低聚果糖的含量[J].食品研究与发,2012,33(1):135-138.
[41]耿丽娟,黄峻榕,冯峰,等.高效阴离子交换色谱-脉冲安培检测法测定乳粉中的低聚果糖[J].色谱,2014,32(12):1380-1384.
Comparative analysis of Fructooligosaccharide detection and analysis of the pros and cons
ZHANG Li-jun
(Quantum Hi-Tech Biological Co. Ltd.,Jiangmen 529081,China)
Fructooligosaccharide(FOS)have multiple physiological functions. As the range of their application in the food industry as a kind of functional oligosaccharides has been increasingly broadened,it’s necessary to monitor added FOS in foods by means of modern analytical approaches. FOS derived from different sources has not only different fructosyl chain lengths,but chemical structures as well. This paper reviews several analytical techniques that have been recently developed to determine FOS in foods,including high performance liquid chromatography,ion chromatography,and new detection methods for cane oligosaccharides fruit isomers.The advantages and disadvantages of these techniques are summarized to provide valuable references for efficient and rapid determination of FOS in foods.
Fructooligosaccharide;high performance liquid chromatography;ion chromatography;detection
2015-06-05
张丽君(1985-),女,硕士,研究方向:低聚糖,E-mail:junjunfzhang5566@163.com。
TS201.1
A
1002-0306(2015)23-0395-05
10.13386/j.issn1002-0306.2015.23.074
