微波提取白鹃梅黄酮类物质及其抗氧化活性研究
2015-05-05朱玲玲张广文杨婷婷邱瑞霞
朱玲玲,张广文,杨婷婷,邱瑞霞
(暨南大学理工学院食品科学与工程系,广东广州 510632)
微波提取白鹃梅黄酮类物质及其抗氧化活性研究
朱玲玲,张广文*,杨婷婷,邱瑞霞
(暨南大学理工学院食品科学与工程系,广东广州 510632)
白鹃梅,黄酮类化合物,微波提取,响应面法,抗氧化活性
白鹃梅为蔷薇科白鹃梅(Exochorda racemosa)属,该属植物全世界共4种,其中3种(白鹃梅、齿叶白鹃梅、红柄白鹃梅)在我国分布[1],主要生长在河南、江西、江苏、浙江一带。白鹃梅的花蕾和嫩叶均可食用。研究表明每百克白鹃梅嫩叶不仅含胡萝卜素、维生素等丰富的营养物质而且含有丰富的黄酮类化合物[1-2]。实验人员采用溶剂提取法,溶剂萃取法以及超声波辅助等方法对不同白鹃梅进行黄酮类化合物的提取[3]。
本实验利用微波技术对白鹃梅总黄酮进行提取,在单因素实验的基础上,以白鹃梅总黄酮提取量为响应值,利用响应面分析法(RSM)[4-5]对微波提取白鹃梅黄酮工艺条件进行优化,并采用多元二次回归方程来拟合因素与响应值之间的函数关系来获得最优工艺参数,并且对其抗氧化活性进行体外测定。
1 材料与方法
1.1 材料与仪器
白鹃梅叶 河南平顶山舞钢市,于热风干燥箱65 ℃烘干,用粉碎机粉碎,过60目筛后备用;芦丁标准品 中国药品生物制品检定所;无水乙醇,乙酸乙酯,亚硝酸钠,硝酸铝,氢氧化钠均为分析纯。1,1-二苯基-2-三硝基苯肼(DPPH) 氨丁三醇(Tris),连苯三酚,2,6-二叔丁基对甲酚(BHT)。
LD-Y1000A高速万能粉碎机 上海顶帅电器有限公司;MAS-Ⅱ常压微波 上海新仪微波化学科技有限公司;UV-9600紫外分光光度计 北京瑞利仪器有限公司;EL104电子分析天平 METTLER TOLEDD有限公司;SB-5200超声双频清洗器 宁波新芝生物科技股份公司。
1.2 实验方法
1.2.1 白鹃梅总黄酮提取工艺流程 干燥白鹃梅→粉碎过筛→加提取溶剂→浸提→抽滤→浓缩干燥→黄酮粗提物
1.2.2 芦丁标准曲线测定 精密称取在105 ℃干燥至恒重的芦丁标准品0.0050 g,加80%乙醇溶解定容至50 mL,配制成质量浓度为0.1 mg/mL的标准品溶液。分别吸取该标准品溶液2.0、4.0、6.0、8.0、10.0 mL置于5只25 mL容量瓶中,加质量分数5% NaNO2溶液1 mL,摇匀放置6 min,加质量分数10%的Al(NO3)3溶液1 mL,摇匀放置6 min后,再加质量分数4%的NaOH溶液10 mL,并加水定容至25 mL,摇匀放置15 min,将不同质量浓度的芦丁标准溶液在510 nm处,以蒸馏水为空白参比,测定其吸光度,并绘制黄酮质量浓度与吸光度的标准曲线[6]。
1.2.3 总黄酮含量的测定 取待测液2 mL于25 mL容量瓶中,加质量分数为5%NaNO2溶液1 mL,摇匀放置6 min,加质量分数10%的Al(NO3)3溶液1 mL,摇匀放置6 min,加质量分数4%的NaOH溶液10 mL,再加水稀释至25 mL,摇匀放置15 min后,测定吸光度,代入公式(1),计算出黄酮浓度c,将其代入公式(2):
A=10.975c+0.0037
式(1)
总黄酮含量=n×c×v/1000M
式(2)
式中:A为吸光度;n为稀释倍数;M为原料质量(g);c为总黄酮质量浓度(mg/mL);V为提取液体积(mL);总黄酮含量(mg/g)。
1.2.4 单因素实验设计 以提取溶剂、料液比、提取温度、提取时间、微波功率5个因素进行单因素实验,做平行实验3次,确定影响白鹃梅总黄酮提取量的适宜单因素条件。
1.2.4.1 提取溶剂对提取效果的影响 称取白鹃梅粉末(60目)10.00 g,按料液比1∶25(g/mL)分别加入体积比为0∶1、1∶0、1∶1、2∶3、1∶2、1∶4的乙酸乙酯、无水乙醇混合溶液于250 mL烧瓶中,在45 ℃,300 W的微波功率下提取60 min。
1.2.4.2 微波功率对提取效果的影响 称取白鹃梅粉末(60目)10.00 g,按料液比1∶25(g/mL)加入体积比为1∶1的乙酸乙酯、无水乙醇混合溶液于250 mL烧瓶中,于45 ℃,分别在100、200、300、400、500 W的微波功率下提取60 min。
1.2.4.3 提取时间对提取效果的影响 称取白鹃梅粉末(60目)10.00 g,按料液比1∶25(g/mL)加入体积比为1∶1的乙酸乙酯、无水乙醇混合溶液于250 mL烧瓶中,在45 ℃,300 W的微波功率下分别提取30、40、50、60、70 min。
1.2.4.4 料液比对提取效果的影响 称取白鹃梅粉末(60目)10.00 g,按料液比1∶10、1∶15、1∶20、1∶25、1∶30(g/mL)分别加入体积比为1∶1的乙酸乙酯、无水乙醇混合溶液于250 mL烧瓶中,在45 ℃,300 W的微波功率下提取60 min。
1.2.4.5 提取温度对提取效果的影响 称取白鹃梅粉末(60目)10.00 g,按料液比1∶25(g/mL)加入体积比为1∶1的乙酸乙酯、无水乙醇混合溶液于250 mL烧瓶中,分别在35、40、45、50、55 ℃,300 W 的微波功率下提取60 min。
1.2.5 响应面分析与优化的设计 根据单因素实验结果,利用Box-Behnken中心组合实验,设计料液比、温度、提取时间、微波功率四因素三水平中心组合实验,利用Design-Expert软件进行响应面分析,建立四元二次回归方程,确定白鹃梅黄酮的最佳提取工艺条件。

表1 四因素三水平中心组合实验因素水平编码表
1.2.6 白鹃梅中黄酮类化合物的抗氧化实验 采用响应面法得到的最佳提取工艺进行总黄酮的提取;将提取液浓缩并经Sevage 法(正丁醇∶氯仿=1∶5)脱蛋白,重复脱除3次;上AB-8大孔树脂[7]层析柱,利用90%的乙醇进行洗脱,收集洗脱液,经检测洗脱液中总黄酮含量达到91.45%;旋蒸干燥得到白鹃梅总黄酮粉末。
1.2.6.1 清除DPPH·能力测定 不同浓度(0.2、0.4、0.6、0.8、1.0、1.2 mg/mL)样品溶液2 mL,加入0.2 mmol/L DPPH乙醇溶液2 mL,并以2 mL的无水乙醇作为对照,以蒸馏水作为参比。在室温下避光30 min,517 nm波长下测定吸光值。以VC,BHT作为阳性参照。3次平行实验取平均值。
清除率(%)=1-(Asample-Ablank)/Acontrol×100
注:ASample:样品溶液+DPPH的吸光度;AbLank:样品溶液+乙醇的吸光度;Acontrol:蒸馏水+DPPH·的吸光度。
1.2.6.2 清除羟自由基(·OH)能力测定 不同浓度(0.2,0.4,0.6,0.8,1.0,1.2 mg/mL)样品溶液2 mL,依次加入2.0 mL 6 mmol/L的FeSO4溶液,2.0 mL 6 mmol/L的H2O2溶液,摇匀,反应10 min,加入2.0 mL 6 mmol/L的水杨酸乙醇溶液,摇匀,反应30 min,510 nm下测吸光值,以VC、BHT作为阳性参照,3次平行实验取平均值。
清除率(%)=1-(Asample-Ablank)/Acontrol×100
注:ASample:样品溶液的吸光度;Ablank:无水杨酸时吸光度;Acontrol:空白对照吸光度。
清除率(%)=1-Asample/Acontrol×100
注:Acontrol:蒸馏水代替样品溶液吸光值;Asample:样品溶液吸光值。

2 结果与分析
2.1 总黄酮标准曲线方程
如图1所示,回归方程为A=10.975C+0.0037,(R2=0.9998)。式中A为吸光度;C为总黄酮的质量浓度(mg/mL)。结果表明,芦丁质量浓度在0.02~0.1 mg/mL之间时,线性关系良好。

图1 芦丁标准曲线Fig.1 Standard cure of rutin
2.2 单因素实验结果
由图2看出,当混合溶剂(V乙酸乙酯∶V乙醇=1∶1)时,白鹃梅总黄酮提取量最高。提取溶剂对实验结果影响不显著。实验最终提取溶剂为乙酸乙酯∶乙醇(v∶v)=1∶1。

图2 提取溶剂对总黄酮提取量的影响Fig.2 Effect of solvent on yield of total flavonoids from Exochorda racemosa
由图3可知,微波功率达到300 W时,总黄酮的提取量达到最大值。功率增大总黄酮的提取量呈明显的下降趋势,可能是功率过大,微波产生的热量过多,降低质点间的能量传递[9]从而导致黄酮类物质的提取量降低。而且微波功率对提取结果影响显著。因此选择适宜的微波功率为300 W。

图3 微波功率对总黄酮提取量的影响Fig.3 Effect of microwave power on yield of total flavonoids from Exochorda racemosa
由图4可知,提取时间对总黄酮提取量影响显著。时间超过60 min后,总黄酮提取量开始下降,可能是由于时间太长导致黄酮类物质的热分解[10-11]损失,所以选择适宜提取时间为60 min。

图4 提取时间对总黄酮提取量的影响Fig.4 Effect of time on yield of total flavonoids from Exochorda racemosa
由图5知,当料液比在1∶25 g/mL,总黄酮的提取量达到最大,料液比进一步增加,黄酮类化合物总提取量变化不大。并且,料液比对实验结果影响不显著;为了节约原料及成本选取适宜的料液比为1∶25 g/mL。

图5 料液比对总黄酮提取量的影响Fig.5 Effect of solid to liquid ratio on yield of total flavonoids from Exochorda racemosa
由图6可知,提取温度达到45 ℃时,总黄酮的提取量最大;温度继续升高,总黄酮提取量下降。主要原因是温度过高,一部分黄酮氧化分解[12-13]或是溶剂挥发剧烈而用于提取的有效溶剂相对减少所致。由图可知,温度对提取结果的影响显著。因此选择适宜的提取温度为45 ℃。

图6 温度对总黄酮提取量的影响Fig.6 Effect of temperature on yield of total flavonoids from Exochorda racemosa
2.3 Box-Behnken实验设计结果与响应面法分析
2.3.1 Box-Behnken实验设计结果 根据单因素实验结果,利用Box-Behnken中心组合实验的设计原理,设计微波功率、提取时间、料液比、提取温度四因素三水平29个实验点的响应面分析实验。实验结果见表2。
2.3.2 模型的建立及显著性检验 将所得的实验数据采用Design Expert 8.0.6软件进行多元回归拟合分析,得到以总黄酮提取量(Y)为目标函数的多元二次回归方程:
Y=14.45200+0.23000X1+0.70083X2-0.036667X3+0.24083X4+0.45000X1X2-0.21500X1X3+0.40000X1X4+0.17750X2X3+0.16000X2X4-0.067500X3X4-0.25850X12-1.43225X22-0.41350X32-0.37475X42
2.3.3 响应面分析与优化 表3方差分析中可以看出微波功率X1、提取时间X2、提取温度X4的P直均小于0.01,说明这三个因素对黄酮提取量的影响显著,影响顺序从大到小依次为:X2>X4>X1。交互项对白鹃梅总黄酮提取量的影响均不显著。二次项X22、X32、X42对总黄酮提取量具有极显著影响。
由表3可知,所选因素对响应值影响强弱次序为:提取时间>提取温度>微波功率>料液比;微波功率与提取时间、微波功率与料液比、微波功率与微波温度、微波时间与料液比、微波时间与温度、料液比与微波温度交互作用影响不显著。
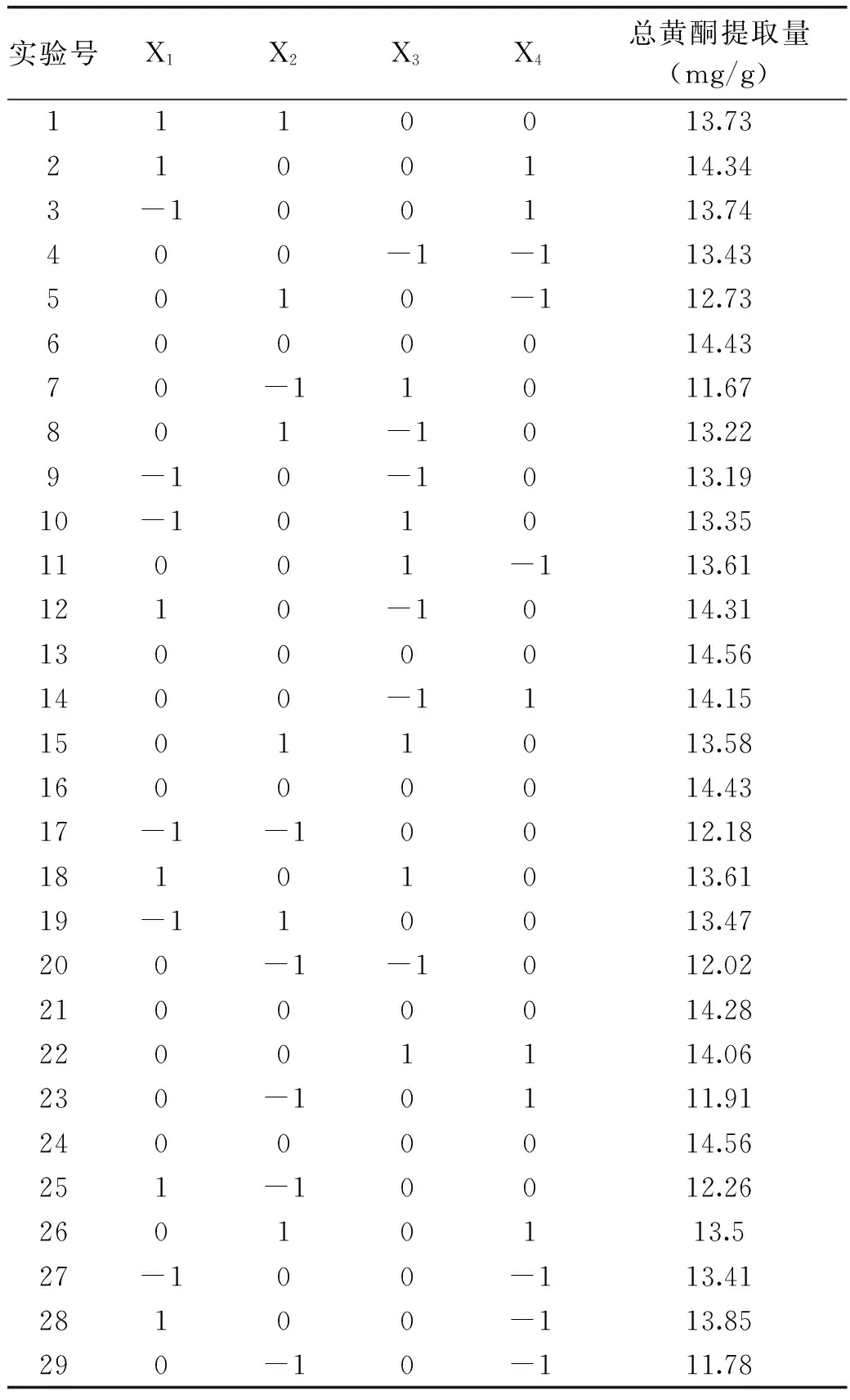
表2 Box-Behnken实验设计及结果
由岭嵴分析得到白鹃梅黄酮类化合物最佳微波提取工艺条件:微波功率357 W,提取时间62.7 min,料液比1∶26 g/mL,提取温度47 ℃,理论最佳提取量为14.67 mg/g。
2.3.4 验证实验 根据实际情况设定微波功率357 W,提取时间63 min,料液比1∶26 g/mL,提取温度47 ℃进行3次平行实验,取平均值,得到白鹃梅总黄酮提取量为14.59 mg/g,与预测值较为接近,拟合性好。实验结果验证了所建模型的正确性,说明响应面法适用于微波提取白鹃梅黄酮类化合物工艺条件的回归分析和参数优化。

表3 回归方程方差分析
注:**.差异极显著,p<0.01;*. 差异显著,p<0.05。
2.4 白鹃梅总黄酮抗氧化活性分析
由图7可以看出,随着浓度的增加,VC、白鹃梅总黄酮以及BHT对DPPH·的清除能力呈线性增加,其中VC对DPPH·的清除效果最好,白鹃梅黄酮对DPPH·的清除效果好于BHT,当浓度达到1.2 mg/mL时,白鹃梅黄酮对DPPH·的清除率达到94.23%,VC以及BHT分别为95.79%,41.21%。由图可以看出,三者对DPPH·的清除能力大小顺序为:VC>白鹃梅黄酮>BHT。由表4可以看出总黄酮对DPPH·的IC50值为0.52 mg/mL。
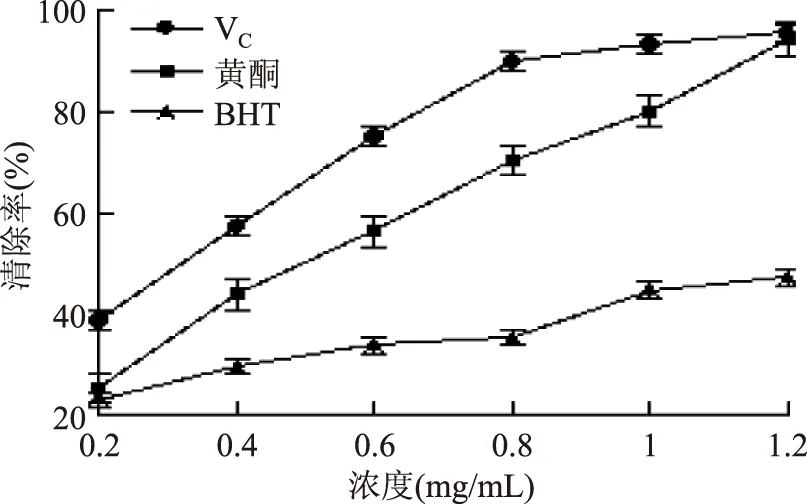
图7 对DPPH的清除效果Fig.7 Scavenging capacity of VC,total flavonoids,BHT for DPPH·
由图8可以看出,白鹃梅总黄酮对羟自由基的清除力也是线性增加的,与VC相比,总黄酮以及BHT的清除效果微差,当浓度为1.2 mg/mL时,三者的清除率分别为94.07%、85.35%、75.36%。对·OH的清除能力大小顺序为:VC>白鹃梅黄酮>BHT。由表4可以看出总黄酮的IC50值为0.55 mg/mL。
由图9可以看出,白鹃梅总黄酮对过氧化自由基的清除效果远远低于VC以及BHT,当浓度为1.2 mg/mL时,清除率仅为51.02%。此时,VC以及BHT的清除率为95.41%,89.15%。可见,总黄酮对过氧化自由基的清除能力有限。三者对过氧化自由基清除能力大小顺序为:VC>BHT>白鹃梅黄酮。由表4可以看出,总黄酮对过氧化自由基的IC50值为1.18 mg/mL。
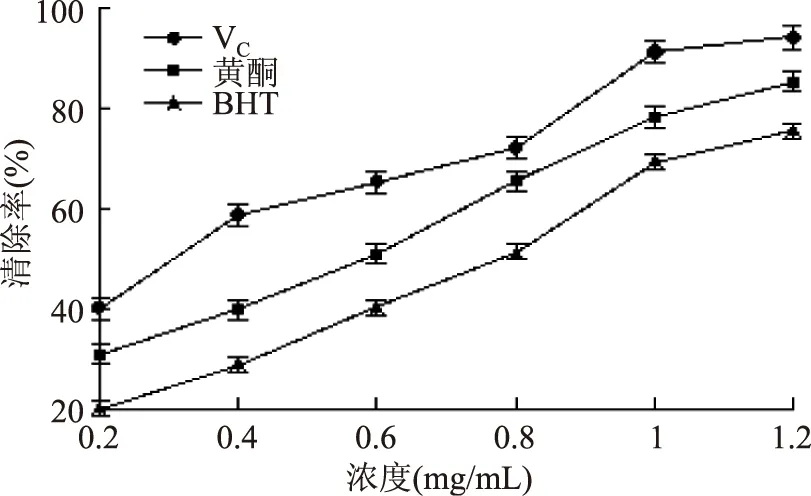
图8 对·OH的清除效果Fig.8 Scavenging capacity of VC,total flavonoids,BHT for ·OH
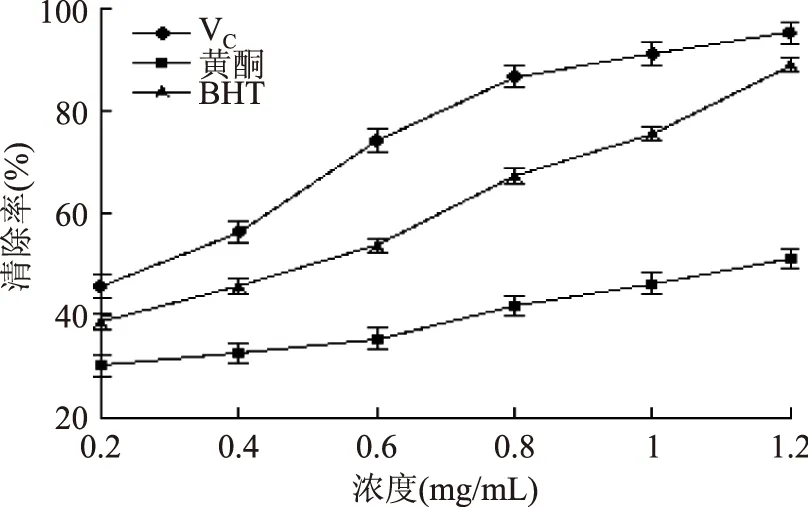
图9 对·的清除效果Fig.9 Scavenging capacity of VC,total flavonoids,BHT for ·

自由基线性回归方程相关系数(R2)IC50值(mg/mL)DPPH·Y=66.69X=15.080.99300.52·OHY=57.32X+18.330.99220.55O-2·Y=21.66X=24.390.98101.18
综上所述,从IC50值可以看出,白鹃梅总黄酮对三种自由基的清除能力不同,这主要因为黄酮类化合物对自由基的清除能力与其结构[14-15]有关,羟基的数量、位置直接影响抗氧化活性的高低。
3 结论
通过单因素实验和Box-Behnken中心组合实验以及响应面分析对微波辅助提取白鹃梅中黄酮类化合物提取工艺进行优化,得出最佳工艺条件为:微波功率357 W,提取时间63 min,料液比1∶26 g/mL,提取温度47 ℃,总黄酮的提取量为14.59 mg/g,并得到影响提取量主要因素变量的二次多元回归模型,该模型的回归极为显著,对实验拟和性好。
[1]张家佳,李香梅,任丽花,等.白鹃梅化学成分[J]. 中国中药杂志,2011,36(9):1198-1200.
[2]魏学智,刘少华,师学琴,等.红柄白鹃梅营养成分分析[J]. 西北植物学报,2005,25(8):1657-1660.
[3]邓荣华,王颖,王慧,等.红柄白鹃梅叶中黄酮类物质的提取研究[J].中国野生植物资源,2015,34(2):5-8.
[4]杨维,夏杏洲,韩维栋,等. 响应面法优化白骨壤果实中黄酮类化合物的提取工艺[J]. 现代食品科技,2011,27(2):191-195.
[5]孙美,黄艳菲,赵小燕,等.响应曲面法优化荞麦总黄酮的提取工艺[J]. 现代食品科技,2012,28(12):1714-1716.
[6]史高峰,邓丽. 微波辅助混合溶剂提取甘草渣中总黄酮的工艺研究[J]. 食品研究与开发,2011,32(10):42-45.
[7]王灵芝,刘玉强. 大孔吸附树脂分离纯化齿叶白鹃梅叶中的总黄酮[J]. 亚太传统医药,2012,8(1):15-18.
[8]Compos D,Chirinos R,Barreto O,et al. Optimized methodology for the simultaneous extraction of glucosinolates,phenolic compounds and antioxidant capacity from maca[J]. Industrial Crops and Products,2013,49:747-754.
[9]吴瑛,王秀琴,袁守亮. 响应面分析昆仑雪菊水溶性黄酮类化合物提取工艺[J]. 食品科学,2013,34(6):129-133.
[10]张玉香,屈慧鸽,杨润亚,等.响应面法优化蓝莓叶黄酮的微波提取工艺[J]. 食品科学,2013,31(16):33-37.
[11]胡崇琳,刘东莉,王蕊霞,等.葛根总黄酮的提取及抗氧化活性评价研究[J]. 食品科学,2007,28(10):232-236.
[12]Qian Xu,Yanyan Shen,Haifeng Wang,et.al Application of response surface methodology to optimize extraction of flavonoids from fructus sophorae[J].Food Chemistry,2013,138(4):2122-2129.
[13]Hua-Feng Zhang,Xiang Zhang,Xiao-Hua Yang,et al. Microwave assisted extraction of flavonoids from culitivated Epimedium sagittatum:Extraction yield mechanism,antioxidant activity and chemical composition[J].Idustrial Crops and Products,2013,50:857-865.
[14]Vanessa M Munhoz,Renata Longhini,Leite Mello,et al. Extraction of flavonoids from Tagetes patula:process optimization and screening for biological activity[J]. Industrial Crops and Products,2014,24(5):576-583.
[15]Heim K E,Tagliaferro A R,Bobiya D J. Flavonoids antioxidants:chemistry,metabolism and structure-activity relationships[J]. Journal of Nutritional Biochemistry,2002,13(10):572-584.
Study on the microwave extraction technology of flavonoids from Exochorda racemosa and the antioxidant evaluation
ZHU Ling-ling,ZHANG Guang-wen*,YANG Ting-ting,QIU Rui-xia
(Department of Food Science and Engineering,Jinan University,Guangzhou 510632,China)
Exochorda racemosa;microwave extraction;flavonoids;response surface methodology;Antioxidant activity
2015-05-13
朱玲玲(1990-),女,硕士研究生,研究方向:食品添加剂,E-mail:jiningzhulingling@163.com。
*通讯作者:张广文(1975-),男,博士,副教授,研究方向:食品添加剂,天然产物活性成分,E-mail:zgwzsu@163.com。
TS201.1
B
1002-0306(2015)23-0239-06
10.13386/j.issn1002-0306.2015.23.041
