不同浓度[Bmim][PF6]离子液体处理对啤酒酵母活性的影响
2015-05-05叶盛英郭德亮杨权华
谢 茹,叶盛英,郭德亮,杨权华
(1.广东省储备粮管理总公司东莞直属库,广东东莞 523145;2.华南农业大学食品学院,广东广州 510642)
不同浓度[Bmim][PF6]离子液体处理对啤酒酵母活性的影响
谢 茹1,叶盛英2,郭德亮2,杨权华2
(1.广东省储备粮管理总公司东莞直属库,广东东莞 523145;2.华南农业大学食品学院,广东广州 510642)
为了研究离子液体在全细胞生物催化中的作用,有必要考察离子液体对微生物活性的影响。本文以啤酒酵母为实验菌种,通过测定酵母菌的生长量、糖代谢效果、生理活性,观察菌落状态、菌体细胞壁等方法,探讨不同浓度[Bmim][PF6]离子液体处理对酵母活性的影响。结果表明:[Bmim][PF6]离子液体对酵母菌的生长有抑制作用,但离子液体对酵母菌的致死效果微弱,与超临界CO2、高浓度苯甲醇处理会导致绝大多数酵母菌死亡的效果截然不同。
不同浓度,离子液体,酵母菌,菌体活性

生物催化是催化科学的前沿之一,具有反应条件温和、无环境污染、速度快、高选择性等优点。生物催化的传统介质为有机溶剂,但有机溶剂会对生物产生毒性影响,也会污染环境。多项研究表明,离子液体可以作为生物催化反应介质,并具有有机溶剂所没有的优点。某些酶能在离子液体中保持活性,甚至提高稳定性、反应选择性和产物产率。由此可见,离子液体在生物催化反应方面具有很大潜力[14-18]。一些催化反应需要多酶体系参与,对于这类反应,直接加入菌体更便捷。因此,研究菌体在离子液体中的活性显得尤为重要。本文正是从宏观和微观的角度,全面探讨离子液体处理对酵母菌活性的影响。
1 材料与方法
1.1 材料与仪器
啤酒酵母(Saccharomycescerevisiae) 华南农业大学食品学院微生物实验室提供;1-丁基-3-甲基咪唑六氟磷酸盐(1-butyl-3-methylimidazolium hexafluorophosphate,[Bmim][PF6])离子液体(97%) 上海镁锶钡实业有限公司化学事业部提供;苯甲醇(AR) 天津市科密欧化学试剂有限公司;CO2气体 广州市卓正气体有限公司。
SFE-1L超临界CO2装置 广州汉维冷气机电工程有限公司;SW-CJ-IFD超净工作台 江苏安泰空气技术有限公司;HZS-H水浴振荡器 哈尔滨市东联电子技术开发有限公司;LRH-250生化培养箱 上海一恒科学仪器有限公司;Leica UGT超薄切片机 德国Leica仪器有限公司;TECNAI 12分析型透射电子显微镜 荷兰FEI电子光学有限公司。
1.2 实验方法
1.2.1 酵母菌液的制备 取酵母菌菌种接入若干支装有5 mL固体斜面培养基的试管,于30 ℃静置培养48 h进行活化。挑取3接种环已活化的斜面菌种接入装有50 mL液体培养基的锥形瓶,于30 ℃ 180 r/min振荡24 h扩大培养。
1.2.2 低浓度离子液体长时处理 一次培养 取扩大培养后的液体菌种1 mL分别接入6个装有28 mL液体培养基的锥形瓶,加入离子液体和无菌水,使培养基中离子液体浓度为0.0%、0.3%,0.5%,0.7%,0.9%,1.1%,于30 ℃ 180 r/min振荡培养,空白试样培养11 h,其余培养33 h。二次培养:从一次培养完毕的菌液中取1 mL加入含29 mL液体培养基的锥形瓶,于30 ℃ 180 r/min振荡培养26 h。
1.2.3 高浓度离子液体、苯甲醇短时处理 取扩大培养后的液体菌种1 mL分别接入4个装有24 mL液体培养基的锥形瓶,于30 ℃ 180 r/min振荡培养12 h。培养完毕后把培养液各自转入无菌离心管,以3000 r/min 3 min离心分离,去上清液,加入离子液体和31 g/L的磷酸氢二钠缓冲液,使溶液中离子液体浓度为0%、20%、40%,苯甲醇浓度为20%。混匀,各自转入已灭菌的4个锥形瓶,于30 ℃ 180 r/min振荡培养2.5 h。处理后,把菌液再次转入无菌离心管,离心分离,移出全部离子液体和苯甲醇,加入缓冲液使每根离心管的液量为25 mL,混匀。
1.2.4 超临界CO2短时处理 取扩大培养后的液体菌种1 mL接入装有24 mL液体培养基的锥形瓶,于30 ℃ 180 r/min振荡培养12 h。培养完毕后把培养液各自转入无菌离心管,离心分离,去上清液,加入缓冲液10 mL,摇匀,于14 MPa超临界CO2,33 ℃下处理1.5 h。
1.2.5 高浓度离子液体长时处理 取扩大培养后的液体菌液1 mL接入1个装有24 mL液体培养基的锥形瓶,于30 ℃ 180 r/min振荡培养12 h。培养完毕后把培养液转入无菌离心管,离心分离,去上清液,加入1.5 mL 97%离子液体和13.5 mL的缓冲液,混匀,转入已灭菌的锥形瓶,于30 ℃ 180 r/min振荡培养2.5 h。处理完后,把菌液转入无菌试管,静止分层,吸出全部缓冲液,试管于常温静置3个月。
1.2.6 分析方法 生长曲线测定:560 nm分光光度法[19]。降糖曲线测定:3,5-二硝基水杨酸分光光度法[20]。生理活性测定:产酯能力测定法、耐酸碱能力测定法、耐酒精能力测定法、耐盐能力测定法[21]、菌落计数法[22]、透射电镜观察法、菌落观察法。
2 结果与分析
2.1 低浓度离子液体处理对酵母菌的影响
2.1.1 酵母菌的生长趋势 从图1可以看出,随着离子液体浓度的增加,酵母菌的生长量逐渐减少,离子液体浓度达到0.7%以上时酵母菌基本不生长。添加了离子液体的试样和空白相比,生长曲线由始至终都比较平缓,说明低浓度的[Bmim][PF6]离子液体抑制了酵母菌的生长。

图1 酵母菌生长曲线Fig.1 Growth curve of yeast in low concentration ionic liquid[Bmim][PF6]
2.1.2 酵母菌的降糖趋势 培养11 h后,空白试样残糖量已达最低值,而其它添加了离子液体的大部分试样需要33 h才平衡,因此本实验采用了不同培养时长和取样间隔。从图2可以看出,离子液体浓度小于0.9%的试样残糖含量都已达到最低点,曲线趋于水平,但达到平衡的时间会随离子液体浓度的增加而逐渐增长。离子液体添加量为0.9%和1.1%的降糖曲线呈现波浪型下降,其残糖量远远大于其它试样。酵母菌的残糖量达到最低,即便继续延长培养时间,培养液中的菌体量也不会继续增加。结合生长曲线和降糖曲线,可以明显发现经处理的酵母菌虽然通过延长培养时间,能正常代谢培养液中的葡萄糖,但不能达至与空白相当的菌体生长量,其原因有待进一步研究。

图2 酵母菌降糖曲线Fig.2 Residual sugar curve of yeast in low concentration ionic liquid[Bmim][PF6]
2.1.3 二次培养菌量的比较 从图3可以看出,二次培养开始时,同样的接种量,随着离子液体浓度的增加吸光值逐渐减少,而且试样吸光值差别明显,部分试样吸光值为零甚至负数,说明一次培养后部分试样内的酵母菌极少,溶液的最大吸光值可能不在560 nm。由图4可以看出,培养26 h后,所有试样的吸光值都明显提高。添加了离子液体试样的吸光值提高的幅度尤其突出,说明一次培养中酵母菌的生长受到明显抑制,但当离子液体浓度大幅降低后酵母的生长能力得到很好的恢复。二次培养后,离子液体添加量小于等于0.5%的试样吸光值和空白试样差别不大。
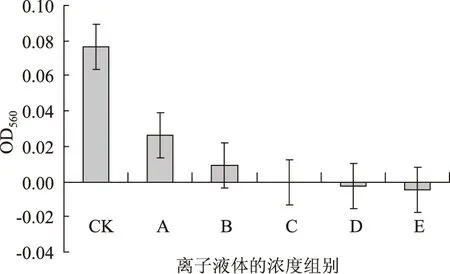
图3 二次培养0 h时的吸光值Fig.3 The optical density of yeast at 0 h in second cultivation 注:图3中组别A、B、C、D、E分别对应一次培养时离子液体浓度为0.3%、0.5%、0.7%、0.9%和1.1%的试样,图4、图5同。

图4 二次培养26 h时的吸光值Fig.4 The optical density of yeast at 26 h in second cultivation
2.1.4 二次培养残糖量的比较 从图5可以看出,除了离子液体浓度为1.1%的试样,其它试样残糖量基本一致,说明各试样中的可利用的糖原已基本消耗殆尽,浓度为1.1%的试样残糖量特别高可能与该浓度下酵母生长被严重抑制有关。本实验所采用的生长曲线测定方法为比浊法,由于菌悬液的浓度与光密度(OD值)成正比,可利用分光光度计测定菌悬液的光密度,从而推知菌液的浓度,最终得出生长曲线。此测定方法快捷简便,却不能判断是因为菌体生长造成悬液浑浊还是因为菌体自溶导致菌液光密度增加。但总的来说,二次培养后,酵母菌的糖代谢基本恢复正常。

图5 二次培养26 h时的残糖量Fig.5 Residual sugar of yeast at 26 h in second cultivation
2.1.5 酵母菌生理活性的比较 从表1可以看出,酵母菌的产酯能力、耐酸碱能力、耐酒精能力、耐盐能力都随离子液体浓度的升高而减弱。

表1 离子液体[Bmim][PF6]处理后酵母菌生理活性的比较
注:+,-及其数量分别代表各种能力的强弱有无。
2.2 高浓度离子液体处理对酵母菌的影响
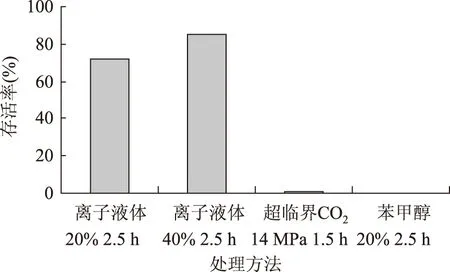
图6 酵母菌存活率Fig.6 Cell viability of yeast after short time treatment with 3 methods
2.2.1 短时处理后酵母菌的存活率 从图6可以看出,经高浓度离子液体短时处理的酵母菌存活率都超过了70%,这说明离子液体对酵母菌的杀伤性不大,而超临界CO2处理和高浓度苯甲醇处理则会使酵母严重致死。离子液体浓度为20%的酵母存活率比浓度为40%的少。可能因为[Bmim][PF6]离子液体的密度大,且不溶于水,20%离子液体在缓冲液中的分散程度比40%的高,对酵母的影响也相对剧烈。
2.2.2 短时处理后透射电镜下的酵母形态 图7是在放大倍数为1400x透射电镜下酵母的细胞切片图。图7a中的每个酵母细胞的细胞壁都厚薄均匀,其细胞壁的厚度均约为20 nm。图7b中不同切片间细胞壁厚薄不均,几乎每个细胞的细胞壁都在同一个方向上被撑大或挤压,部分细胞壁被异常撑大处有穿孔。图7c中不同细胞切片的细胞壁厚薄相差很大,但每个切片的细胞壁厚薄均匀。图7e、图7e与图7a、图7b、图7c中的细胞壁明显不同,透明细胞壁外部有一层因变性而生成的黑色物质,变性的细胞壁已不能承担运输、保护细胞等功能,此种细胞壁说明细胞已经死亡。
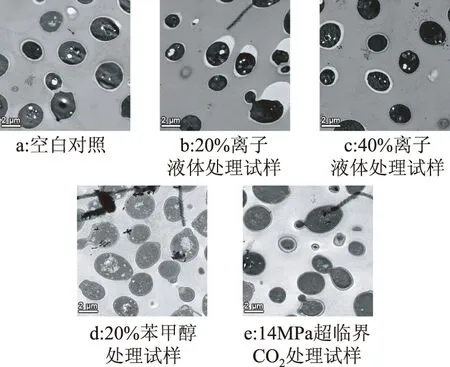
图7 酵母菌透射电镜图1400xFig.7 Analytical transmission electron microscope of yeast in 1400x
2.2.3 长时处理后酵母菌落形态 极端处理中离子液体的浓度达到了100%,图8是离子液体处理3个月后平板菌落图。可见,被高浓度离子液体长时间处理的酵母菌并没有被杀灭,菌落形态和不经处理的酵母菌相差不大。图8a中可以明显看到两个小点(箭头所示),从图8b可以看到两个小点内的菌落特别小,但数量甚多,这种现象可能由涂布平板时离子液体聚集并对酵母抑制造成。

图8 极端处理后酵母菌落形态Fig.8 Colonial morphology of yeast after long time treatment in 100% ionic liquid[Bmim][PF6]注:图8b是图8a的局部放大图。
3 结论
3.1 低浓度离子液体长时处理对酵母菌的影响
在低浓度离子液体中酵母菌生长受明显抑制但却不会死亡。随着离子液体浓度增加酵母菌的最大菌体生长量逐渐降低,达到可利用残糖最低值的时间延长,酵母菌的各项生理活性均随离子液体浓度升高而减弱。二次培养中,酵母菌的活性得到很好的恢复,再次证明低浓度离子液体长时处理对酵母菌只产生暂时的抑制作用,其致死能力不强。
3.2 高浓度离子液体短时处理对酵母菌的影响
离子液体对酵母菌的致死效果微弱。宏观上看,高浓度离子液体(大于等于20%)处理远比超临界CO2处理和高浓度苯甲醇处理试样的存活率高;微观上看,20%离子液体对酵母菌的致畸性比40%的大,但二者均不会让酵母菌严重致死,而超临界CO2及苯甲醇处理的酵母菌会因细胞壁变性而死亡。
3.3 高浓度离子液体长时处理对酵母菌的影响
经97%的离子液体处理3个月的酵母菌仍没死亡,菌体形态保持正常,进一步说明[Bmim][PF6]离子液体对酵母菌的杀伤性不大。
4 讨论
离子液体种类繁多、价格昂贵,不同离子液体的性质与用途也各不相同,本实验需要选择一种已被证实致死效果不严重的离子液体。
[Bmim][PF6]对酵母的毒性不大,但外国学者只侧重研究微生物中的酶类,而并非微生物本身。Joshua Howarth[23]等人曾提出可以用[Bmim][PF6]∶水为10∶1的溶液作为固定化面包酵母生物合成酮类物质的介质。离子液体基本不会破坏在酵母中起催化作用的酶类。Alix Lenourry等人[24]的研究发现,无论在离子液体[Bmim][PF6]还是正十四烷的作用下,Sporomusa termitida产咖啡酸的量都明显减少,但在离子液体中产咖啡酸的量相对较多。接触时间越长,离子液体对微生物的抑制越明显。
综上所述,本实验选择了[Bmim][PF6]离子液体为研究对象。该离子液体为中性,密度为1.363 kg/m3(298K),不溶于水,密度比酵母菌大,因此静置反应时与酵母菌体接触较少,这可能会导致静止培养时酵母菌存活率偏高。若要真实反映酵母菌在高浓度离子液体中的存活情况应采用振摇或搅拌的培养方式。
相对传统有机溶剂来说离子液体十分昂贵,因此注意其循环回收利用尤为重要。离子液体属于绿色溶剂,具有强大的萃取功能。在以后的研究中可扩展研究不同性质的离子液体及微生物,根据微生物的特殊需要筛选出最适合其生长代谢、生成最多目标次级代谢物的离子液体,服务科学研究和工业生产。
[1]李永红.绿色溶剂——离子液体及其应用[J].化学工程师,2006,131(8):27-29.
[2]周蓓蕾.离子液体催化酯化反应研究[D].广州:广东工业大学,2005:1-4.
[3]主均凤,张锁江,陈慧萍.室温离子液体的性质及其在化学合成反应中的应用[J].过程工程学报,2003,3(2):177-185.
[4]王寿武,冯莉,陈双平.离子液体及其在有机合成中的应用[J].日用化学工业,2005,35(2):102-106.
[5]张锁江,吕兴梅.离子液体——从基础研究到工业应用[M].北京:科学出版社,2006:196-229.
[6]Baokun Tang,Wentao Bi,Minglei Tian,et al.Application of ionic liquid for extraction and separation of bioactive compounds from plants[J].Journal of Chromatography B,2012,904:1-21.
[7]Carla Toledo-Neira,Alejandro álvarez-Lueje.Ionic liquids for improving the extraction of NSAIDs in water samples using dispersive liquid-liquid microextraction by high performance liquid chromatography-diode array-fluorescence detection[J]. Talanta,2015,134:619-626.
[8]Gregory Young,Franz Nippgen,Sebastian Titterbrandt,et al.Lipid extraction from biomass using co-solvent mixtures of ionic liquids and polar covalent molecules[J].Separation and Purification Technology,2010,72(1):118-121.
[9]Young-Hoo Kima,Yong-Keun Choia,Jungsu Park,et al.Ionic liquid-mediated extraction of lipids from algal biomass[J].Bioresource Technology,2012,109:312-315.
[10]Tom Vander Hoogerstraete,Sil Wellens,Katrien Verachtert,et al.Removal of transition metals from rare earths by solvent extraction with an undiluted phosphonium ionic liquid:separations relevant to rare-earth magnet recycling[J].Green Chemistry,2013,15:919-927.
[11]Kunping Liu,Jingjing Zhang,Guohai Yang,et al.Direct electrochemistry and electrocatalysis of hemoglobin based on poly(diallyldimethylammonium chloride)functionalized graphene sheets/room temperature ionic liquid composite film[J]. Electrochemistry Communications,2010,12(3):402-405.
[12]Michel Armand,Frank Endres,Douglas R. MacFarlane,et al.Ionic-liquid materials for the electrochemical challenges of the future[J].Nature Materials,2009,8:621-629.
[13]李汝雄,王建基. 绿色溶剂——离子液体的制备与应用[J].化工进展,2002,21(1):43-48
[14]Los Ríos A P,Hernández Fernández F J,Gómez D,et al.Biocatalytic transesterification of sunflower and waste cooking oils in ionic liquid media[J].Process Biochemistry,2011,46(7):1475-1480.
[15]Danielle Dennewald,William-Robert Pitner,Dirk Weuster-Botz.Recycling of the ionic liquid phase in process integrated biphasic whole-cell biocatalysis[J].Process Biochemistry,2011,46(5):1132-1137.
[16]Dong-Hao Zhang,Shu Bai,Meng-Yuan Ren,et al.Optimization of Lipase-Catalyzed Enantioselective Esterification of(±)-Menthol in Ionic Liquid[J].Food Chemistry,2008,(109):72-80.
[17]毛多斌,陈永森,李玉娥,等.离子液体中酶的活性、稳定性及选择性研究进展[J].郑州轻工业学院学报:自然科学版,2008,23(1):18-23.
[18]Arning,Jurgen,Matzke,et al.Toxicity of Ionic Liquids Towards Mammalian Cell Lines[J].Current Organic Chemistry,2011,15(12):1905-1917.
[19]熊海燕,李莹.不同果汁发酵液中酵母菌生长曲线的测定及pH的变化[J].农产品加工,2009,(4):26-27.
[20]赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536.
[21]郝林.食品微生物学实验技术[M].北京:中国农业出版社,2001:78-92.
[22]GB 4789.2-2010 食品安全国家标准 食品微生物学检验 菌落总数测定[S].北京:中国标准出版社,2010.
[23]Joshua Howarth,Paraic James,Jifeng Dai.Immobilized Baker’s Yeast Reduction of Ketones in an Ionic Liquid[bmim]PF6and Water Mix[J].Tetrahedron Letters Pergamon,2001,(42):7517-7519.
[24]Alix Lenourry,John M. Gardiner,Gill Stephens. Hydrogenation of C-C Double Bonds in an Ionic Liquid Reaction System Using the Obligate Anaerobe,Sporomusa Termitida[J]. Biotechnology Letters,2005,(27):161-165.
Effect of different concentrations of[Bmim][PF6]on the microbial activity ofSaccharomycescerevisiae
XIE Ru1,YE Sheng-ying2,GUO De-liang2,YANG Quan-hua2
(1.Dongguan Subordinate Grain Depot of Guangdong Province Grain Reserves Corporation,Dongguan 523145,China;2.College of Food Science,South China Agricultural University,Guangzhou 510642,China)
In order to study the role of ionic liquid as a solvent for whole cell biocatalyst,it is necessary to investigate the effect of ionic liquid treatments on microbial activity. In this study,Saccharomycescerevisiaewas selected as testing target,and the effect of different[Bmim][PF6]treatments on growth curve,sugar degradation curve,microbial activity,colonial morphology and the shape of cell wall of yeast were studied. The results showed that:[Bmim][PF6]ionic liquid would inhibit the growth of yeast,but the ionic liquid yeast lethal effect was weak,that was totally different from supercritical CO2treatment and high concentration benzene methanol treatment which would lead most yeast to death.
biocatalysis;ionic liquid;yeast;microbial activity
2015-03-07
谢茹(1985-),女,本科,研究方向:食品科学与工程,E-mail:xrspook@xlanda.net 。
TS201.3
A
1002-0306(2015)23-0204-05
10.13386/j.issn1002-0306.2015.23.034
