AI-2的体外合成及其对植物乳杆菌KLDS1.0391细菌素合成的影响
2015-05-05孟祥晨
张 筠,杨 杰,孟祥晨
(东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
AI-2的体外合成及其对植物乳杆菌KLDS1.0391细菌素合成的影响
张 筠,杨 杰,孟祥晨*
(东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
本文采用单因素实验,优化AI-2合成的孵育温度、pH、酶浓度以及孵育时间。利用优化的合成条件,成功合成具有生物活性的AI-2,活性约为阳性对照的2倍。添加合成的AI-2到MRS培养基中,研究AI-2对植物乳杆菌KLDS1.0391生长和细菌素合成的影响,并采用实时荧光定量PCR分析培养15 h的植物乳杆菌KLDS1.0391的细菌素结构基因plnEF的转录水平。结果表明:AI-2合成的最优条件为:0.5 mg/mL Pfs蛋白、1.0 mg/mL LuxS蛋白、2 mmol/L SAH,pH7.5,37 ℃孵育5 h。添加合成的AI-2对植物乳杆菌的生长无明显影响;培养3 h后,相同培养时间时添加AI-2的实验组对枯草芽孢杆菌ATCC6633的抑菌圈直径显著高于空白对照和阴性对照组(p<0.01);添加AI-2的实验组的plnEF基因的表达量上调至空白对照的2.89倍。本研究成功优化AI-2的体外合成条件;添加合成的AI-2对植物乳杆菌KLDS1.0391细菌素合成有促进作用,且这种促进作用可能与plnEF基因转录水平上调有关。
AI-2,合成,细菌素,RT-PCR
20世纪70年代,Nealson等在海洋细菌费氏弧菌(Photobacteriumfischeri)中发现了由群体感应控制的发光现象,进而认识到细菌中也存在着细胞间的信息交流[1]。群体感应又称“自动诱导”(autoinduction)或“细胞与细胞的交流”(cell to cell communication),也被称为“细菌之声交响曲”(symphony of bacterial),是微生物间通过化学分子信号传递信息的一种形式。细菌在繁殖过程中会向周围环境分泌一些特定、微小、可扩散的信号分子,这些信号分子被称为自诱导物(autoinducers,AI)。信号分子与细菌的菌体密度有关,当信号分子达到一定的阈值,细菌即可通过信号分子感受周围的环境状态以及自身的菌体密度,从而做出适应环境变化的基因调控[2-3]。研究发现,群体感应系统能够调控基因的表达,进而调控细菌的多种生理功能,如生物发光、生物被膜的形成、致病菌毒力因子的分泌、抗生素的合成、细菌素的合成以及其他代谢产物的生成等[4-9]。
许多细菌中存在几种群体感应系统,研究发现在哈氏弧菌中存在利用酰基高丝氨酸内酯(acylhomoserine lactone,AI-1)和AI-2(Autoinducer-2)的两种群体感应系统[10]。AI-2作为一种通用的信号分子,存在于革兰氏阳性和革兰氏阴性菌中[11]。目前研究发现,所有的AI-2的合成途径都是由S-腺苷高半胱氨酸经Pfs蛋白和LuxS蛋白催化生成前体物质4,5-二羟基-2,3-戊二酮(4,5-dihydroxy-2,3-pentanedione,DPD),DPD分子重排形成有活性的AI-2分子[12]。目前对AI-2信号分子基因调控功能的研究主要集中在致病菌中,而对于革兰氏阳性菌的乳酸菌研究较少。乳酸菌作为革兰氏阳性菌同样存在AI-2介导的群体感应系统。Ge等[13-14]研究发现细菌素Paracin1.7的产量与LactobacillusparacaseiHD 1.7的菌体密度相关,进一步研究发现LactobacillusparacaseiHD 1.7与Bacillussubtilis共培养可以增加细菌素Paracin1.7的产量。本实验室前期人员从内蒙古传统发酵乳制品中分离出一株能够产细菌素(植物乳杆菌素MG)的菌株植物乳杆菌KLDS1.0391,并且前期研究结果显示:该菌株中存在AI-2(autoinducer-2)介导的群体感应调控系统,且信号分子AI-2在该菌株与其他乳酸菌共培养时细菌素的合成中起重要调节作用[15]。为进一步研究AI-2信号分子对该菌株细菌素合成的影响,本实验室前期人员构建了原核表达载体pQE-30-pfs和pQE-30-luxS[16],并成功优化了重组蛋白LuxS和Pfs的诱导表达及纯化条件,获得具有生物活性的重组蛋白LuxS和Pfs,为体外合成AI-2奠定了基础。本研究将在此基础上对AI-2体外合成的条件进行优化,并利用合成的AI-2研究其对植物乳杆菌KLDS1.0391细菌素合成的影响。
1 材料与方法
1.1 材料与仪器
植物乳杆菌KLDS1.0391 本实验室保存;枯草芽孢杆菌ATCC6633 中国药品生物制品检定所;PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)、SYBR® Premix Ex TaqTM(Tli RNaseH Plus) TaKaRa公司;RNAprep Pure培养细胞/细菌总RNA提取试剂盒 天根生化科技有限公司;S-腺苷高半胱氨酸(SAH)、高半胱氨酸(L-Homocysteine) Sigma公司;5,5′-二硫代双(2-硝基苯甲酸)(DTNB) summus公司。
UV-2401PC型紫外分光光度计 日本岛津公司;日立F4500型荧光分光光度计 Hitachi High-Technologies Corporation;DK-8D型电热恒温水槽 上海一恒科技有限公司;7500实时荧光定量PCR仪 美国Applied Biosystems公司。
1.2 实验方法
1.2.1 AI-2合成最适温度的确定 使用本研究前期获得的LuxS蛋白和Pfs蛋白在10 mmol/L的磷酸钠缓冲液(pH7.5)中合成AI-2,反应体系:终浓度为2 mmol/L的S-腺苷高半胱氨酸(SAH)、0.5 mg/mL的LuxS蛋白、0.5 mg/mL的 Pfs蛋白,分别于25、30、37、42 ℃孵育15 min[17]。用超滤管Amicon Ultra-15(截留分子量3 ku)进行超滤,去除反应液中的蛋白,取适量滤液采用Ellman’s法测定AI-2浓度[17]。以产生最高浓度AI-2的温度为最适温度,定义其合成效率为100%。其他温度的AI-2产生量均和最高值进行比较,得到对应温度的相对合成效率,相对合成效率(%)=不同温度的AI-2生成量/AI-2的最高生成量×100[17]。
1.2.2 AI-2合成最适pH的确定 使用本研究前期获得的LuxS蛋白和Pfs蛋白在pH分别为4.0、5.0、6.0、7.0、7.5、8.0、9.0、10.0的10 mmol/L的磷酸钠缓冲液中合成AI-2,反应体系:终浓度为2 mmol/L 的S-腺苷高半胱氨酸(SAH)、0.5 mg/mL 的LuxS蛋白、0.5 mg/mL的 Pfs蛋白,于37 ℃孵育15 min[17]。参照1.2.1中方法去除蛋白后测定生成的AI-2浓度[17]。以产生最高浓度AI-2的pH为最适pH,定义其合成效率为100%,其他pH的AI-2产生量均和最高值进行比较,得到对应pH的相对合成效率,相对合成效率(%)=不同pH的AI-2生成量/AI-2的最高生成量×100[17]。
1.2.3 AI-2合成最佳酶浓度的确定 在最适pH的10 mmol/L磷酸钠缓冲液中,按表1加入SAH、LuxS蛋白和Pfs蛋白,在最适温度下水浴15 min。参照1.2.1中方法去除蛋白后测定生成的AI-2浓度[17]。以产生最高浓度AI-2的酶浓度为最佳酶浓度,定义其合成效率为100%,其他酶浓度的AI-2产生量均和最高值进行比较,得到对应酶浓度的相对合成效率,相对合成效率(%)=不同酶浓度的AI-2生成量/AI-2的最高生成量×100[17]。

表1 AI-2的体外合成
1.2.4 AI-2合成孵育时间的确定 在最适pH的10 mmol/L的磷酸钠缓冲液中,分别添加终浓度为2 mmol/L的SAH、1.0 mg/mL的LuxS蛋白和0.5 mg/mL的Pfs蛋白,37 ℃孵育0.5、1.0、2.0、3.0、4.0、5.0、6.0、7.0 h。用超滤管Amicon Ultra-15(截留分子量3 ku)进行超滤,去除反应液中的蛋白,收集滤液用10 mmol/L的磷酸钠缓冲液(pH7.5)稀释50倍,经0.22 μm滤膜过滤除菌储存于-80 ℃备用,作为待测样品。利用哈氏弧菌BB170报告菌株检测0、2.5、5.0、7.5、10.0、12.5、15.0、17.5、20.0 μmol/L的AI-2的生物活性,并将稀释5000倍的哈氏弧菌BB170菌液与待测样品按10∶1混合后,30 ℃、150 r/min孵育4 h后,检测样品中的AI-2活性[18]。以哈氏弧菌BB120无细胞培养上清作为阳性对照,10 mmol/L磷酸钠缓冲液(pH7.5)作为阴性对照,将阳性对照中AI-2活性定义为100%,将样品的发光强度与阳性对照相比得出样品中的AI-2活性。
1.2.5 优化条件下AI-2的体外合成 利用获得的优化条件合成AI-2,在pH7.5的10 mmol/L的磷酸钠缓冲液中,分别添加终浓度为2 mmol/L的SAH、1.0 mg/mL的LuxS蛋白和0.5 mg/mL的Pfs蛋白,37 ℃孵育5 h。用超滤管Amicon Ultra-15(截留分子量3 ku)进行超滤,去除反应液中的蛋白,滤液经0.22 μm滤膜过滤除菌储存于-80 ℃。用哈氏弧菌BB170报告菌株检测合成的AI-2的生物活性[18]。以哈氏弧菌BB120无细胞培养上清作为阳性对照,10 mmol/L磷酸钠缓冲液(pH7.5)作为阴性对照,将阳性对照中AI-2活性定义为100%,将样品的发光强度与阳性对照相比得出样品中的AI-2活性。
1.2.6 添加AI-2对植物乳杆菌KLDS1.0391生长和细菌素合成的影响 将连续培养3代的植物乳杆菌KLDS1.0391菌液按1%接种量接种到添加了3%(v/v)AI-2(2 mmol/L)的MRS培养基中,置于37 ℃培养。以未添加AI-2的MRS培养基为空白对照,以添加相同量的高半胱氨酸和腺嘌呤的MRS培养基作为阴性对照,其他与实验组操作相同。分别在培养0、3、6、9、12、15、18、21、24 h时取样,测定菌液OD600,同时取15 mL菌液置于50 mL离心管中,于12000×g、4 ℃离心15 min,收集上清,用6 mol/L的NaOH调pH至6.5,添加终浓度为5 mg/mL的过氧化氢酶37 ℃水浴2 h后,经0.22 μm滤器过滤除菌后,用冷冻干燥机进行冷冻干燥。用1/10体积的无菌水复溶后,以枯草芽孢杆菌ATCC6633作为指示菌,采用本实验室贡汉生构建的双层平板打孔法测定样品的抑菌活性,抑菌活性以抑菌圈直径表示[19]。
1.2.7 添加AI-2对植物乳杆菌KLDS1.0391细菌素结构基因转录水平的影响 参照1.2.6的方法设置AI-2实验组、空白对照和阴性对照组,置于37 ℃培养15 h。采用天根RNAprep pure培养细胞/细菌总RNA提取试剂盒提取植物乳杆菌KLDS1.0391的总RNA,采用PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)对提取的总RNA进行逆转录,采用SYBR® Premix Ex TaqTM(Tli RNaseH Plus)进行实时荧光定量PCR分析细菌素结构基因plnEF的转录水平,plnEF引物:plnEF-F:5′-TCTAGTTTTGCGTGACCGTG-3′,plnEF-R:5′-CTAATGACCCAATCGGACGG-3′;内参基因引物[15]:16S rDNA-F:5′-GGCGTGCTATTCATACCAGTC-3′,16S rDNA-R:5′-CAGGTGTTATCCC GTGCTTC-3′。以16S rDNA为内参基因,以添加3%(v/v)AI-2的MRS和阴性对照中的植物乳杆菌KLDS1.0391为待测样品,空白对照中的植物乳杆菌KLDS1.0391为校准样品,通过2-ΔΔCt分析细菌素结构基因plnEF的表达差异,其中ΔΔCt=ΔCt待测样品-ΔCt校准样品。
2 结果与分析
2.1 AI-2合成最适温度的确定
由图1可知,AI-2的体外合成具有一个较宽的温度范围,在25~42 ℃的范围内,AI-2的合成效率均保持在80%以上,孵育温度为37 ℃时,AI-2的合成效率最高,当温度高于或低于37 ℃时,合成效率均有所降低,所以选择37 ℃作为AI-2体外合成的最适温度。Li[20]和Tsao[21]等均在37 ℃孵育合成AI-2,本研究的实验结果与文献中所采用的温度一致,37 ℃时蛋白具有最高的活性,温度降低或升高均使蛋白活性降低,催化效率也会有所下降。Han等[17]研究还发现当温度升至75 ℃时,合成效率将不足37 ℃的10%。
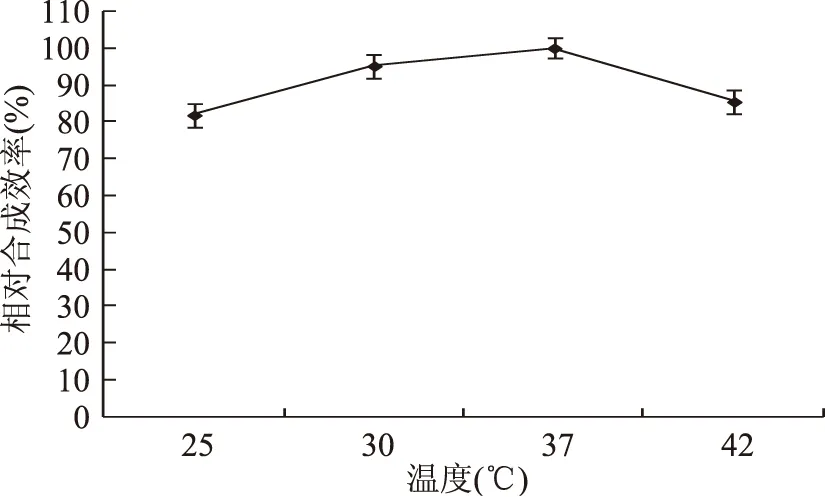
图1 温度对AI-2体外合成的影响Fig.1 Influence of temperature on the synthesis of AI-2 in vitro
2.2 AI-2合成最适pH的确定
由图2可知,AI-2的体外合成具有一个较宽的pH范围,在pH7.0~9.0的范围内,AI-2的合成效率均保持在79%以上,在pH为7.5时AI-2的合成效率最高,当pH过低或过高时,AI-2的合成效率显著降低。本研究中在pH7.5时合成效率最高,Li[20]和Tsao[21]则分别采用了pH为7.5和7.8的缓冲液作为合成AI-2的缓冲液,而Han等[17]则在pH8.0时酶活性最高,得到最高的AI-2合成效率,pH过高或过低时合成效率都显著下降,这可能与pH对蛋白质结构存在影响有关。来源于不同菌的LuxS和Pfs蛋白合成AI-2的最适pH存在一定差异,这可能与不同菌来源的蛋白的结构存在一定的差异有关。

图2 pH对AI-2体外合成的影响Fig.2 Influence of pH on the synthesis of AI-2 in vitro
2.3 AI-2合成最佳酶浓度的确定
由图3可知,当LuxS和Pfs蛋白浓度分别为1 mg/mL和0.5 mg/mL时,AI-2的合成效率最高,且明显高于其他组(p<0.01),所以选择1 mg/mL的LuxS蛋白和0.5 mg/mL的Pfs蛋白作为AI-2合成的最佳酶浓度。Fernandes等[22]用0.5 mg/mL LuxS蛋白和0.5 mg/mL Pfs蛋白合成AI-2,而Li等[20]则用1.0 mg/mL LuxS蛋白和1.0 mg/mL Pfs蛋白合成AI-2,本研究中将两种浓度进行组合发现,1.0 mg/mL LuxS和0.5 mg/mL Pfs蛋白合成AI-2的效率最高,可能本研究中LuxS和Pfs蛋白结构与文献中的蛋白结构存在差异,使得蛋白活性存在差异。
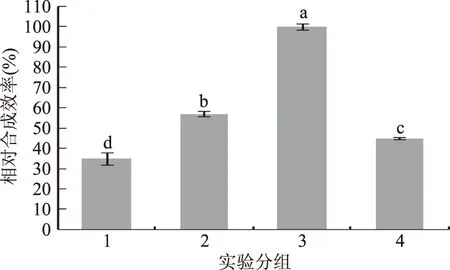
图3 酶浓度对AI-2体外合成的影响Fig.3 Influence of enzyme concentration on the synthesis of AI-2 in vitro注:1. LuxS蛋白 0.5 mg/mL,Pfs蛋白 0.5 mg/mL;2. LuxS蛋白0.5 mg/mL,Pfs蛋白1.0 mg/mL;3.LuxS蛋白1.0 mg/mL,Pfs蛋白0.5 mg/mL;4. LuxS蛋白1.0 mg/mL,Pfs蛋白1.0 mg/mL;上标字母不同表示差异极显著(p<0.01)。
2.4 AI-2合成孵育时间的确定
在稀释5000倍的哈氏弧菌BB170菌液中添加不同浓度的AI-2,检测不同浓度AI-2的活性,结果表明(图4),在AI-2浓度为0~20 μmol/L的范围内,检测到的AI-2活性随AI-2浓度的增加呈现递增趋势。在最适的AI-2合成条件下合成AI-2,分别孵育0.5、1.0、2.0、3.0、4.0、5.0、6.0、7.0 h时取样,滤除蛋白、过滤除菌后,经过适当稀释后测定不同孵育时间的AI-2活性(通过稀释使AI-2终浓度控制在0~4 μmol/L),结果表明(图5),随着孵育时间延长,检测到的AI-2活性增加,在孵育5 h后检测到的AI-2活性趋于稳定,亦表明AI-2的浓度趋于稳定,认为底物基本转换完全,合成的AI-2浓度为2 mmol/L。所以选择5 h作为AI-2体外合成的孵育时间。
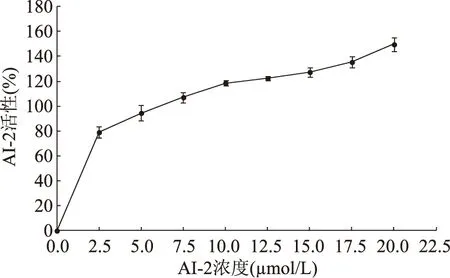
图4 AI-2活性与浓度关系曲线Fig.4 Relation curve of AI-2 activity and concentration
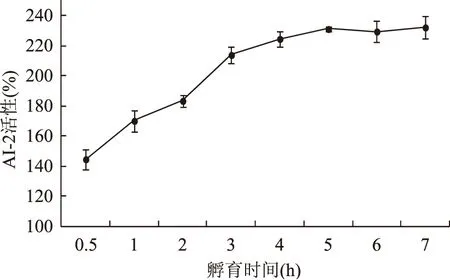
图5 孵育时间对AI-2体外合成的影响Fig.5 Influence of incubation time on the synthesis of AI-2 in vitro
2.5 优化条件下AI-2的合成
在本研究得到的最优条件下合成AI-2,采用哈氏弧菌BB170报告菌株检测合成的AI-2的生物活性,结果表明(图6),体外合成的AI-2生物活性约为阳性对照的2倍,说明合成的AI-2具有明显的生物活性,成功合成了AI-2。

图6 AI-2生物活性的测定Fig.6 Determination of AI-2 activity注:阴性对照:磷酸钠缓冲液(10 mmol/L、pH7.5)与稀释5000倍的哈氏弧菌BB170菌液按1∶10比例混合后30 ℃,150 r/min孵育4 h;阳性对照:BB120培养无细胞上清与稀释5000倍的哈氏弧菌BB170菌液按1∶10比例混合后30 ℃,150 r/min孵育4 h,定义阳性对照中AI-2活性为100%;合成的AI-2:适当稀释的合成的AI-2与稀释5000倍的哈氏弧菌BB170菌液按1∶10比例混合后30 ℃,150 r/min孵育4 h。
2.6 添加AI-2对植物乳杆菌KLDS1.0391生长和细菌素合成的影响
由图7可知,添加AI-2的实验组中植物乳杆菌KLDS1.0391的生长速率与空白对照和阴性对照组生长速率基本一致,说明外源添加AI-2并不影响植物乳杆菌KLDS1.0391的生长。由图8可知,培养3 h后,相同培养时间点添加AI-2的实验组对枯草芽孢杆菌ATCC6633的抑菌圈直径显著高于空白对照和阴性对照组(p<0.01),空白对照和阴性对照组抑菌圈直径无明显差异(p>0.05),有效排除了AI-2合成副产物的干扰,同时上清样品经调酸和去除过氧化氢,排除了有机酸和过氧化氢抑菌的可能,因此结果表明外源添加AI-2对细菌素合成有显著的促进作用。

图7 AI-2对植物乳杆菌KLDS1.0391生长的影响Fig.7 Effect of AI-2 on the growth of Lactobacillus plantarum KLDS1.0391
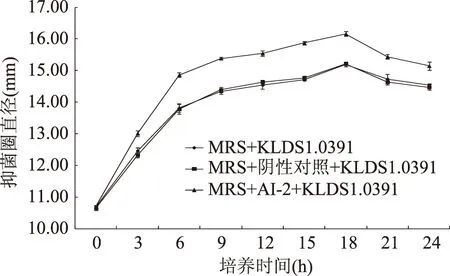
图8 AI-2对植物乳杆菌KLDS1.0391细菌素合成的影响Fig.8 Effect of AI-2 on bacteriocin synthesis of L. plantarum KLDS1.0391
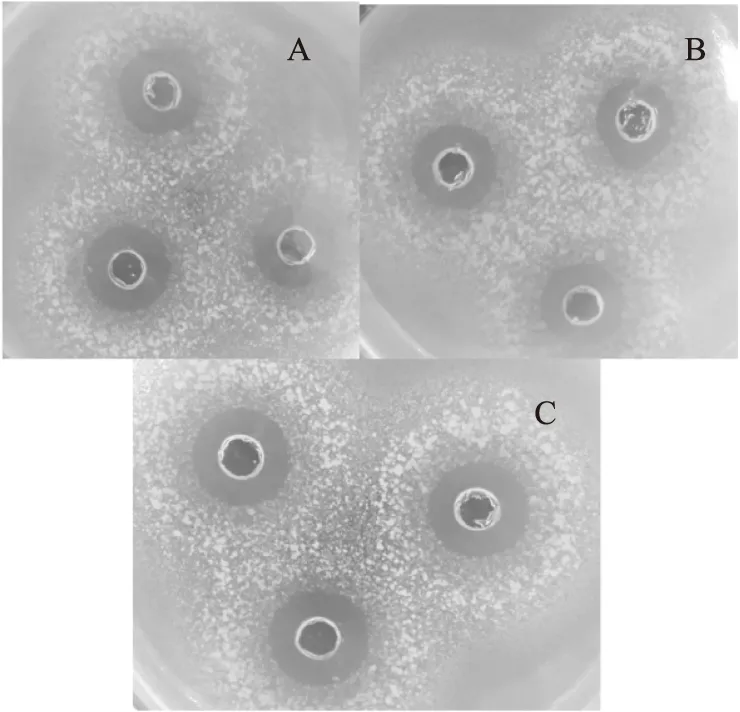
图9 培养15 h的植物乳杆菌KLDS1.0391的培养上清液的抑菌圈Fig.9 The inhibition zone of supernatant solution of L. plantarum KLDS1.0391 cultivated for 15 h注:A:空白对照;B:阴性对照;C:AI-2实验组。
2.7 添加AI-2对植物乳杆菌KLDS1.0391细菌素结构基因转录水平的影响
通过实时荧光定量PCR检测,得到细菌素结构基因plnEF的转录水平如图10所示。与空白对照和阴性对照组相比,添加AI-2的实验组的plnEF基因表达量显著上升(p<0.01),上调至空白对照组的2.89倍,阴性对照与空白对照组plnEF基因表达量无明显差异,约为空白对照组的1.13倍(p>0.05)。

图10 plnEF基因表达量变化Fig.10 The change of plnEF gene expression levels注:上标字母不同表示差异极显著(p<0.01)。
3 结论和展望
本研究成功优化了AI-2的体外合成条件,并成功合成了AI-2。研究发现,外源添加合成的AI-2对植物乳杆菌KLDS1.0391的生长无明显影响,对其细菌素合成具有明显的促进作用,且AI-2促植物乳杆菌KLDS1.0391细菌素合成作用可能与该菌细菌素结构基因plnEF表达量上调有关。
为了更好的研究AI-2对植物乳杆菌细菌素的代谢调控,以及对植物乳杆菌其他代谢的调控,本课题组的后续研究人员将构建luxS基因缺失突变株,阻断植物乳杆菌KLDS1.0391自身的AI-2合成通路,进一步研究AI-2对植物乳杆菌的代谢调控机制。
[1]Nealson K H,Platt T,Hastings J W. Cellular control of the synthesis and activity of the bacterial luminescent system[J]. Journal of Bacteriology,1970,104(1):313-322.
[2]Waters C M,Bassler B L. Quorum sensing:cell-to-cell communication in bacteria[J]. Annu Rev Cell Dev Biol,2005,21(1):319-346.
[3]满丽莉,孟祥晨,王辉,等. 群体感应系统在乳酸菌产细菌素中的作用[J]. 食品科学,2011,32(13):360-364.
[4]Irie Y,Parsek M R. Quorum sensing and microbial biofilms[J]. Current Topics in Microbiology and Immunology,2008,322:67-84.
[5]Hardie K R,Heurlier K. Establishing bacterial communities by ‘word of mouth’:LuxS and autoinducer 2 in biofilm development[J]. Nature Reviews Microbiology,2008,6(8):635-643.
[6]Higgins D A,Pomianek M E,Kraml C M,et al. The majorvibriocholeraeautoinducer and its role in virulence factor production[J]. Nature,2007,450(7171):883-886.
[7]Le Berre R,Nguyen S,Nowak E,et al. Quorum-sensing activity and related virulence factor expression in clinically pathogenic isolates ofPseudomonasaeruginosa[J]. Clinical Microbiology and Infection,2008,14(4):337-343.
[8]Derzelle S,Duchaud E,Kunst F,et al. Identification,characterization,and regulation of a cluster of genes involved in carbapenem biosynthesis inPhotorhabdusluminescens[J]. Applied and Environmental Microbiology,2002,68(8):3780-3789.
[9]Bassler B L,Wright M,Silverman M R. Multiple signaling systems controlling expression of luminescence in Vibrio harveyi :sequence and function of genes encoding a second sensory pathway[J]. Molecular Microbiology,1994,13(12):273-286.
[10]Surette M G,Miller M B,Bassler B L. Quorum sensing inEscherichiacoli,Salmonellatyphimurium,andVibrioharveyi:a new family of genes responsible for autoinducer production[J]. Proceedings of the National Academy of Sciences of the United States of America,1999,96(4):1639-1644.
[11]Holmes K,Tavender T J,Winzer K,et al. AI-2 does not function as a quorum sensing molecule inCampylobacterjejuniduring exponential growthinvitro[J]. BMC Microbiology,2009,9:214.
[12]Winzer K,Hardie K R,Burgess N,et al. LuxS:its role in central merabolism and the invitrosynthesis of 4-hydroxy-5-methyl-3(2H)-furanone[J]. Microbiology,2002,148(Pt 4):909-922.
[13]Ge J P,Fang B Z,Yuan T T,et al. Quorum-sensing behavior of Lactobacillus paracasei HD 1.7[J]. Wei Sheng Wu Xue Bao,2011,51(11):1561-1567.
[14]Ge J P,Fang B Z,Yang W,et al. Bacillus subtilis enhances production of Paracin1.7,a bacteriocin produced by Lactobacillus paracasei HD1-7,isolated from Chinese fermented cabbage[J]. Ann Microbiol,2014,64:1735-1743.
[15]满丽莉. 植物乳杆菌细菌素合成相关群体感应系统的鉴定及功能分析[D]. 哈尔滨:东北农业大学,2012.
[16]赵日红. Pfs基因和luxS基因在大肠杆菌中的表达及纯化[D]. 哈尔滨:东北农业大学,2013.
[17]Han X G,Lu C P.Invitrobiosynthesis of autoinducer 2 ofSteptococcussuisSerotype 2 using recombinant LuxS and Pfs[J]. Enzyme and Microbial Technology,2009,44:40-45.
[18]Jang Y J,Choi Y J,Lee S H,et al. Autoinducer 2 ofFusobacteriumnucleatumas a target molecule to inhibit biofilm formation ofperiodontopathogens[J]. Archives of Oral Biology,2013,58(1):17-27.
[19]贡汉生. 四株乳杆菌产细菌素的研究[D]. 哈尔滨:东北农业大学,2007.
[20]Li M,Villaruz A E,Vadyvaloo V,et al. AI-2-dependent gene regulation in Staphylococcus epidermidis[J]. BMC Microbiology,2008,8:4.
[21]Tsao C Y,Wang L,Hashimoto Y,et al. LuxS coexpression enhances yields of recombinant proteins inEscherichiacoliin part through posttranscriptional control of GroEL[J]. Applied and Environmental Microbiology,2011,77(6):2141-2152.
[22]Fernandes R,Tsao C Y,Hashimoto Y,et al. Magnetic nanofactories:Localized synthesis and delivery of quorum-sensing signaling molecule autoinducer-2 to bacterical cell surfaces[J]. Metabolic Engineering,2007,9(2):228-239.
Synthesis of AI-2invitroand effect of AI-2 on bacteriocin synthesis ofLactobacillusplantarumKLDS1.0391
ZHANG Yun,YANG Jie,MENG Xiang-chen*
(Key Laboratory of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China)
The factors including incubation temperature,pH,enzyme concentration and incubation time were optimized by single-factor experiment design. Then AI-2 was synthesized under the optimum conditions. The biological activity of the synthesized AI-2invitro,was about 1-fold higher than the positive control. In order to research effect of AI-2 on the growth and bacteriocin synthesis,LactobacillusplantarumKLDS1.0391 was cultured in MRS broth supplemented with AI-2 synthesized. The expression level ofplnEFgene encoding bacteriocin ofLactobacillusplantarumKLDS1.0391 cultivated for 15 h was studied by RT-PCR. The results showed that the optimum conditions for the synthesis of AI-2invitrowere determined as follows:the SAH concentration of 2 mmol/L,the LuxS protein concentration of 1.0 mg/mL,the Pfs protein concentration of 0.5 mg/mL,the incubation temperature of 37 ℃,pH of 7.5,and the incubation time of 5 h. Growth rate ofLactobacillusplantarumhad no significant change,and the inhibition zone againstBacillussubtilisATCC6633 increased significantly after cultivated in the MRS broth supplemented with AI-2 synthesized for 3 h. And the expression level ofplnEFgene of the experimental group was 1.89-fold higher than the blank control. In this study,the conditions for the synthesis of AI-2invitrowere optimized. AI-2 played an obvious positive regulatory role on bacteriocin production,and the regulatory effect may be associated with the increases of transcriptional level ofplnEFgene.
AI-2;synthesis;bacteriocin;RT-PCR
2015-03-27
张筠(1976-), 女, 博士研究生, 研究方向: 食品微生物与生物技术,E-mail:forever19@sina.com。
*通讯作者:孟祥晨(1970-), 女, 博士, 教授, 研究方向: 食品微生物与生物技术, E-mail:xchmeng@163.com。
教育部博士学科点专项科研基金(20122325110017);黑龙江省教育厅科学技术研究(重点)项目计划(12521Z002)。
TS201.3
A
1002-0306(2015)23-0199-06
10.13386/j.issn1002-0306.2015.23.033
