双孢菇漆酶的固定化及其对邻苯二甲酸二甲酯降解的研究
2015-05-05夏文静
李 飞,夏文静,周 惠,顾 波
(南京师范大学泰州学院 生物技术与化学工程学院,江苏泰州 225300)
双孢菇漆酶的固定化及其对邻苯二甲酸二甲酯降解的研究
李 飞,夏文静,周 惠,顾 波
(南京师范大学泰州学院 生物技术与化学工程学院,江苏泰州 225300)
为提高漆酶的利用效率,进一步开发其在环境治理中的应用,以海藻酸钠为载体,采用单因素实验对双孢菇漆酶凝胶包埋固定化的工艺进行探讨,并利用固定化漆酶对邻苯二甲酸二甲酯(DMP)进行降解实验。结果表明,采用直接包埋方式,固定化最佳单因素条件为:给酶量160 U/g载体,海藻酸钠浓度为3%,CaCl2浓度为0.15 mol/L,固定化时间为2 h,可以获得较佳的固定化效果。利用固定化漆酶降解DMP时,降解率随DMP初始浓度的增加而下降,在pH3、4.5对DMP具有较好的降解效果,在25 mg/L的DMP溶液(pH4.5)中添加小分子介质ABTS浓度达到0.3 mmol/L,投加2 U/g固定化小球反应24 h,降解率最高达到56.9%。研究结果为处理含DMP污染提供了一种有效的方法和理论基础。
漆酶,固定化,邻苯二甲酸二甲酯,降解
邻苯二甲酸酯类(Phthalic acidester,PAEs)被广泛用于塑料、农药、化妆品、汽车、服装、电线电缆等产业[1-2],是世界上生产量大,应用范围广的人工合成有机化合物之一[3]。由于邻苯二甲酸酯增塑剂并非与树脂共价连接,在塑料及其制品中呈游离状态,稳定性较差,极易释放到环境中,广泛存在于大气、水体、土壤、食品以及生物体内[4-6],成为全球最普遍的污染物之一[7-8]。研究表明,PAEs及其降解产物会引起癌症并损害肾脏,干扰动物及人类的生殖系统和发育[9-11]。此外,土壤中的PAEs污染对植物生长、品质和生理生化特征及土壤微生物代谢多样性和遗传多样性产生显著影响[12-14]。
PAEs在环境中的自然理化降解十分缓慢,主要依赖生物降解作用[5,15-16]。国内外学者已就PAEs的微生物降解做了大量的研究,主要集中在筛选高效降解菌株及其降解特性[3,5,9,17]。迄今为止,利用生物酶制剂降解PAEs的报道较少,有研究报道几丁质酶和酯酶对PAEs具有较好的降解效果[18]。漆酶是一种含铜的多酚氧化酶,可催化多种酚类及其衍生物、羧酸及其衍生物和非酚类化合物等氧化,因其广泛的底物特异性,在环境治理领域具有广阔的应用前景,能显著减少排放到环境中的有毒污染物[19]。而利用真菌漆酶催化降解邻苯二甲酸酯类还未见报道。由于漆酶易溶于水,限制了它在实际中的应用。固定化酶可以保持酶高效催化的特点,提高酶的稳定性,此外,固定化酶极易与底物、产物分开,有利于酶的多次重复,从而提高了酶的使用效率[20]。本实验选用廉价的海藻酸钠作为载体,研究了固定化双孢菇漆酶的方法及其条件,并以PAEs中结构最简单的邻苯二甲酸二甲酯(DMP)作为研究对象,首次利用固定化漆酶对DMP进行降解研究,旨在促进漆酶在处理含DMP污染等方面提供重要参考。
1 材料与方法
1.1 材料与仪器
漆酶由双孢菇菌株(Pleurotuseryngii)液态发酵法制备,其粗酶液的酶活力为3.5 U/mL。2,2′-连氮-双(3-乙基苯并噻唑-6-磺酸)(简称ABTS)购自sigma公司,甲醇为色谱纯,邻苯二甲酸二甲酯及海藻酸钠等试剂均为分析纯。
5810型高速冷冻离心机 德国Eppendorf公司;UV1000紫外可见分光光度计 上海天美科学仪器有限公司;Mili-Q纯水系统 美国Milipore公司;1260型液相色谱仪 美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 漆酶的固定化及固定率的测定 将质量分数为3%的海藻酸钠和漆酶酶液(3.5 U/mL)按照一定比例混合均匀,用10 mL注射器将海藻酸钠与漆酶混合液逐滴加入到0.15 mol/L的等体积的CaCl2溶液中,形成光滑的凝胶小球,于4 ℃冰箱中固化2 h后取出洗净,贮存于4 ℃冰箱中备用。
比较不同单因素对漆酶固定化的影响,包括固定化时间(1~4 h,间隔1 h)、海藻酸钠浓度(0.5%、1%、2%、3%、4%)、给酶量(40、80、120、160、300 U/g绝干载体)及CaCl2浓度(0.1、0.15、0.2、0.25、0.3 mol/L)。若无特殊说明,固定化条件采用:在海藻酸钠质量浓度为3%,CaCl2浓度为0.15 mol/L,给酶量为160 U/g载体条件下固化2 h。
分别测定固定化过程中加入游离酶的总活力M0以及固定化后上清液中酶的总活力M1。固定率(%)=(M0-M1)/M0×100。
1.2.2 固定化漆酶对DMP的降解 以DMP为降解对象,探索合适的降解条件,包括降解时间(4、8、12、24、30、48 h)、反应pH(3~5,间隔0.5)、DMP浓度(5、10、15、20、25、50 mg/L)、给酶量(1~5 g固定化小球,2 U漆酶活力/g固定化小球)和小分子介质ABTS浓度(0.01、0.05、0.1、0.2、0.3 mmol/L)。若无特殊说明,降解条件采用:40 mL反应体系含50 mmol/L pH4.5柠檬酸-柠檬酸钠,DMP(初始浓度为25 mg/L),漆酶酶量(1 g固定化小球,2 U/g固定化小球),30 ℃降解24 h后利用高效液相色谱法测定DMP含量。用同样的方法在DMP溶液中以不加入固定化小球作为对照。以上实验处理均为3次重复。
DMP降解率=(ρ0-ρ1)/ρ0×100%,式中,ρ0为降解前DMP质量浓度/(mg/L);ρ1为降解后DMP质量浓度/(mg/L)。
1.2.3 漆酶活力的测定 漆酶测定以2,2′-连氮-双(3-乙基苯并噻唑-6-磺酸)(简称ABTS)为底物[21]。3 mL反应体系中含有1 mmol/L ABTS底物1 mL,50 mmol/L pH5.0柠檬酸-柠檬酸钠缓冲液和酶液共计2 mL,420 nm(ABTS的ε=3.6×104mol/(L·cm))下测定反应液3 min内的吸光值变化。一个酶活力单位定义为在当前反应条件下每分钟氧化1 μmol ABTS所需的酶量。
1.2.4 DMP分析方法 样品处理:将反应液抽滤除去固定化小球,按1∶1向滤液中加入正己烷,震荡萃取10 min,收集有机相,水相再用正己烷萃取2次,合并有机相,浓缩至5 mL[22]。用安捷伦1260型液相色谱仪测定DMP含量。
1260型液相色谱仪条件:色谱柱Agilent HC-C18(4.6 mm×150 mm,5 μm),柱温40 ℃,流动相甲醇∶水=70∶30,流速为1 mL/min。检测器波长为225 nm,进样量为20 μL。
2 结果与分析
2.1 海藻酸钠凝胶固定漆酶条件优化
2.1.1 固化时间对漆酶固定率的影响 如图1所示,漆酶固定率随着固化时间的延长而增加,当固化时间超过2 h后固定率随着时间的延长而逐渐下降,可能是因为Ca2+通过海藻酸钠胶囊由外向内置换Na+形成海藻酸钙,如果固定化时间太长,交联程度高,导致海藻酸钙凝胶结构过于紧密,从而影响到酶促反应时的反应速率[20],所以最佳固化时间选择为2 h。

图1 固化时间对漆酶固定率的影响Fig.1 Effect of immobilized time on the rate of immobilized laccase
2.1.2 海藻酸钠浓度对漆酶固定率的影响 如图2所示,当海藻酸钠的质量浓度为3%时,固定率最高,浓度过高或过低都不利于漆酶的固定化。可能是海藻酸钠浓度影响凝胶孔径的大小,浓度过低导致凝胶内的酶分子容易流失,而浓度过大导致凝胶孔径太小,使底物和产物的扩散受到限制[23]。因此,海藻酸钠载体的最佳浓度为3%。
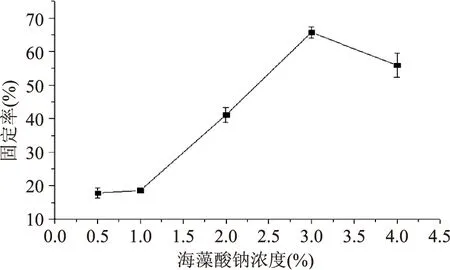
图2 海藻酸钠浓度对漆酶固定率的影响Fig.2 Effect of concentration of sodium alginateon the rate of immobilized laccase
2.1.3 给酶量对漆酶固定率的影响 如图3所示,给酶量对酶固定率影响显著,随着给酶量的增加,固定率逐渐增加,最大值达到65.7%,当给酶量超过每g绝干载体含160 U时,固定率趋于稳定。可能是当给酶量超过160 U/g载体后,交联载体活性基团结合达到饱和,使得过量的酶呈现游离状态,无法固定在载体上[20]。为节约成本,固化时给酶量为160 U/g载体较为适宜。
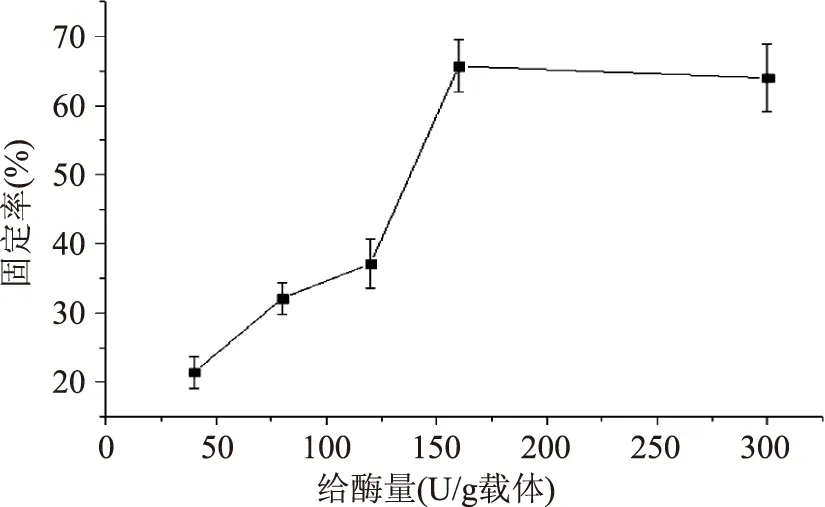
图3 给酶量对漆酶固定率的影响Fig.3 Effect of different enzyme amounts on the rate of immobilized laccase
2.1.4 CaCl2浓度对漆酶固定率的影响 Ca2+作为交联剂和海藻酸钠分子中的-COO-结合,从而使海藻酸钠-漆酶复合液的液滴交联固化,形成微球。因此,体系中Ca2+的质量分数对微球的形成和机械强度也有较大的影响。如图4所示,随着CaCl2浓度的增加,固定率呈现先增加后降低的趋势,当CaCl2浓度为0.15 mol/L时,对漆酶的固定率最高。主要原因是当CaCl2浓度过小时,海藻酸钙凝胶固化不充分,凝胶小球孔径较大,导致漆酶包埋不完全,容易流失;而CaCl2浓度过高,使固定化小球的交联程度变强,导致小球的空隙减少,影响物质的传质[20]。因此,固化时CaCl2最佳浓度为0.15 mol/L。

图4 CaCl2浓度对漆酶固定率的影响Fig.4 Effect of concentration of CaCl2 on the rate of immobilized laccase
2.2 固定化漆酶对DMP的降解
2.2.1 反应时间对固定化漆酶降解DMP的影响 如图5所示,随着作用时间的延长,固定化漆酶对DMP的降解逐渐增加,当超过24 h后,对DMP的降解作用变得缓慢,可能是固定化酶经过长时间作用稳定性降低,且凝胶小球机械强度下降,导致酶活力下降,从而降解作用减弱。因此,选择最佳降解时间为24 h。

图5 反应时间对漆酶降解DMP的影响Fig.5 Effect of time on DMP degradation byimmobilized laccase
2.2.2 反应pH对固定化漆酶降解DMP的影响 如图6所示,在pH3~4范围内,固定化酶对DMP的降解率随着pH的增大而减小;而pH4~5范围内,对DMP的降解呈现先增大后减小的趋势。不同pH条件下,底物与漆酶的结构和稳定性改变,影响与DMP的亲和力,从而影响降解效果[24]。对双孢菇漆酶的酶学性质研究表明,该漆酶最适反应pH为3,酶活力随着pH的增大而减小,在30 ℃,pH3条件下处理24 h,酶活力丧失52.3%,而在pH4~5条件下处理24 h漆酶仍保持90%以上的活力,表明该漆酶在pH4~5条件下具有较好的稳定性,这与固定化酶对DMP的降解结果一致,在pH3、4.5具有较好的降解率。

图6 反应pH对漆酶降解DMP的影响Fig.6 Effect of pH value on DMP degradation by immobilized laccase
2.2.3 固定化酶用量对固定化漆酶降解DMP的影响 如图7所示,DMP的降解效果随着酶用量的增大而增大,在酶用量达到1 g固定化小球时,DMP的降解率达到26.2%,继续增大酶用量,降解效果反而下降。可能是酶用量越多,反应体系内凝胶小球越拥挤,使固定化酶不能充分结合底物,从而降低了固定化酶对DMP的作用。

图7 固定化酶用量对漆酶降解DMP的影响Fig.7 Effect of immobilized laccase amout on DMP degradation
2.2.4 DMP浓度对固定化漆酶降解DMP的影响 如图8所示,固定化酶对DMP的降解率随着DMP浓度的增加而显著下降。DMP浓度在5~15 mg/L之间时,具有较好的降解效果,降解率均在40%以上。可能是高浓度的DMP对固定化漆酶产生了较大的毒性,大部分漆酶在失活之前没有参与催化反应,导致对DMP的降解率下降[25]。综合考虑催化效率及污染实际情况,本研究采用较大的DMP浓度25 mg/mL为研究对象。
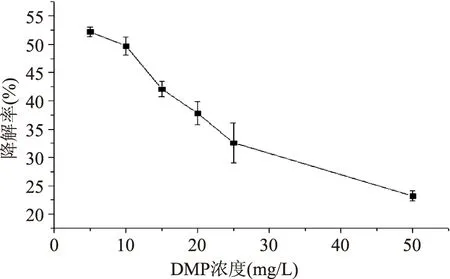
图8 DMP浓度对漆酶降解的影响Fig.8 Effect of different initial DMP concentration on DMP degradation
2.2.5 小分子介质(ABTS)浓度对固定化漆酶降解DMP的影响 漆酶在一些小分子氧化还原介体的协助下具有更强的催化氧化能力,扩大漆酶对底物的作用范围[26]。由于小分子介质价格昂贵,浓度过高会产生有毒的衍生物,本实验选择在反应体系中添加较低浓度的ABTS,结果如图9所示。小分子介质ABTS的加入能显著增强固定化酶对DMP的降解,降解率随着ABTS浓度的增加而增加。当ABTS浓度为0.3 mmol/L时,对DMP的降解率达到56.9%,与不加ABTS相比,降解率增加了一倍。可能是小分子介质ABTS作为电子载体,克服了阻碍漆酶与DMP直接作用的空间结构的影响,从而提高催化效率[27]。

图9 ABTS浓度对漆酶降解DMP的影响Fig.9 Effect of ABTS concentration on DMP degradation by immobilized laccase
3 结论与讨论
邻苯二甲酸酯类有机化合物污染问题是全球共同关注的问题之一,美国环境保护署和中国环境监测总站已先后将该类污染物列为优先控制的污染物[22]。自然环境中邻苯二甲酸酯完全矿化的主要依赖于微生物降解,但归根结底取决于微生物代谢过程中所分泌的降解酶类。近年来,邻苯二甲酸酯的生物降解方面有一些研究,主要集中在对邻苯二甲酸酯降解菌的筛选及降解途径,曾峰等[28]从处理石化厂废水的活性污泥中分离出1株邻苯二甲酸酯降解菌FS 1,对邻苯二甲酸二甲酯具有高效降解作用。金雷等[29]从长期受食品塑料垃圾污染的土壤中通过富集培养和分离纯化,获得一株DBP高效降解菌H-2能高效降解短链邻苯二甲酸二甲酯、邻苯二甲酸二乙酯和DBP,而对长链邻苯二甲酸二辛酯的降解效果较差。尽管在筛选降解有效微生物方面取得了不错的进展,但利用关键酶对邻苯二甲酸酯进行降解的研究较少。Kim等[18]报道利用几丁质酶和酯酶对各类邻苯二甲酸酯进行纯酶降解的比较研究,发现几丁质酶对邻苯二甲酸酯的降解更具高效性,且降解产物无毒。漆酶由于其独特的作用机理,可催化多种酚类和非酚类化合物氧化,在环境治理领域有着广泛的应用和深入的研究,利用真菌漆酶催化降解邻苯二甲酸酯类还未见报道。
本实验研究了双孢菇漆酶的固定化工艺,并利用固定化漆酶对邻苯二甲酸二甲酯进行降解,单因素实验结果表明漆酶的适宜固定化条件为给酶量160 U/g载体,海藻酸钠浓度为3%,CaCl2浓度为0.15 mol/L,固定化时间为2 h。在上述条件下,利用固定化漆酶降解DMP,可知固定化漆酶在pH3、4.5,DMP浓度在5~15 mg/L范围内具有较好的降解效果,降解率均高于40%。最佳降解时间为24 h,适宜给酶量为1 g固定化小球,当添加小分子介质ABTS时能显著促进漆酶对DMP的降解,且降解率随ABTS浓度的增加而提高,当DMP浓度为25 mg/mL,添加ABTS浓度为0.3 mmol/L时,最高降解率达到56.9%。
研究表明固定化漆酶对DMP具有一定的降解效果,显示漆酶在处理含DMP污染方面存在一定的应用潜力,研究结果与金德才等[22]报道的利用细菌JDC-3降解DMP的降解率相似,但与曾峰[28]等报道的利用FS 1降解DMP,降解率在24 h内达到100%相比,本研究利用漆酶对DMP的降解效果并不高,还需要进行大量长期的研究工作。
[1]张传贵. 增塑剂污染及其对人体的影响[J]. 生物学通报,1999,34(2):20.
[2]张建,石义静,崔寅,等. 土壤中邻苯二甲酸酯类物质的降解及其对土壤酶活性的影响[J].环境科学,2010,31(12):3056-3061.
[3]李建龙,邵向丽,刘书亮,等. 邻苯二甲酸二丁酯降解菌株的筛选鉴定及其降解特性研究[J]. 现代食品科技,2014,30(10):108-114.
[4]Nilsson C. Phthalate Acid Esters Used as Plastic Additives-Compar-isons of Toxicological Effects[M]. Brussels:Swedish National Chemicals Inspectorate,1994.
[5]严佳丽,陈湖星,杨杨,等. 一株高效DEHP降解菌的分离、鉴定及其降解特性[J]. 微生物学通报,2014,41(8):1532-1540.
[6]Li J,Gu JD,Pan L. Transformation of dimethylphthalate,dimethylisophthalate and dimethylterephthalate by Rhodococcus rubber Sa and modeling the process using the modified Gompertz model[J]. Int Biodeterior Biodegrad,2005,55(3):223-232.
[7]Petersen JH,Breindahl T. Plasticizers in total diet samples,baby food and infant formulae[J]. Food Addit Contam,2000,17:133-141.
[8]Gu JD,Li JX,Wang YY. Biochemical pathway and degradation of phthalate ester isomers by bacteria[J]. Water Sci Technol,2005,52:241-248.
[9]骆祝华,黄翔玲,叶德赞. 环境内分泌干扰物—邻苯二甲酸酯的生物降解研究进展[J]. 应用与环境生物学报,2008,14(6):890-897.
[10]李玲,简英,刘贺荣. 邻苯二甲酸二丁酯对体外人肝细胞HL-7702毒性作用的研究[J]. 宁夏医学院学报,2007,29(1):38-40.
[11]张晓峰,李百祥. 邻苯二甲酸二丁酯的环境暴露及对雄性生殖系统的损害[J]. 中国男科学杂志,2005,19(3):70-72.
[12]谢慧君,石义静,滕少香,等. 邻苯二甲酸酯对土壤微生物群落多样性的影响[J]. 环境科学,2009,30(5):1286-1291.
[13]Yin R,Lin XG,Wang SG,et al. Effect of DBP/DEPH invegetable planted soil on the quality of capsicum friut[J]. Chemosphere,2003,50:801-805.
[14]张慧芳,苗艳明,丁献华,等. 邻苯二甲酸酯对小麦幼苗生理指标的影响[J]. 安徽农业科学,2010,38(7):3374-3377.
[15]刘庆,杨红军,史衍玺,等. 环境中邻苯二甲酸酯类(PAEs)污染物研究进展[J]. 中国生态农业学报,2012,20(8):968-975.
[16]Staple AC,Peterson DR,Parkerton TH,et al. The environmental fate of phthalic esters:a literature review[J]. Chemosphere,1997,35(4):667-749.
[17]Pradeepk umar,Sharanagouda,Karegoudar TB. Metabolism of dimethylphthalate byAspergillusniger[J]. J Microbiol Biotechn,2000,10:518-521.
[18]Kim YH,Min J,Bae KD,et al. Biodegradation of dipropyl phthalate and toxicity of its degradation products:A comparison ofFusariumoxysporumf.sp.pisicutinase andCandidacylindraceaesterase[J]. Arch Microbiol,2005,184:25-31.
[19]Baldrian P. Fungal laccase-occurrence and properties[J].FEMS Microbiol Rev,2006,30(2):215-242.
[20]赵林果,李丽娟,王平,等. 海藻酸钠固定化β-葡萄糖苷酶的研究[J]. 生物加工过程,2007,5(4):25-31.
[21]Camarero S,Ibarra D,Martinez MJ,et al. Lignin-derived compounds as efficient laccase mediators for decolorization of different types of recalcitrant dyes[J]. Appl Environ Microb,2005,71(4):1775-1784.
[22]金德才,吴学玲,梁任星,等. 一株DMP降解菌的分离鉴定及其降解特性[J]. 微生物学通报,2009,36(9):1318-1323.
[23]杨本宏,蔡敬民,吴克,等. 海藻酸钠固定化根霉脂肪酶的制备及其性质[J]. 催化学报,2005,26(11):977-981.
[24]张营,杨革,张剑飞. 固定化漆酶对弱酸性蓝RAW脱色降解的研究[J]. 染料与染色,2012,49(2):48-51.
[25]谌斌,赵亮亮,孙秋芳,等. 红芝所产漆酶对蒽醌染料的脱色研究[J]. 环境科学与技术,2010,33(11):50-53.
[26]Fabbrini M,Galli C,Gentili P. Comparing the efficiency of some mediators of laccase[J]. J Mol Catal B Enzym,2002,16:231-240.
[27]Morozova OV,Shumakovich GP,Shleev SV,et al. Laccase mediator systems and their applications:A review[J]. Appl Biochem Microbiol,2007,43:523-535.
[28]曾锋,傅家谟,盛国英,等. 邻苯二甲酸二甲酯的微生物降解研究[J]. 环境科学研究,1999,12(4):12-14.
[29]金雷,陈瑜,严忠雍,等. 邻苯二甲酸二丁酯高效降解菌H-2的分离鉴定及其降解特性[J]. 食品科学,2014,35(15):202-206.
Immobilization of laccase fromAgaricusbisporusand the degradation of dimethyl phthalate
LI Fei,XIA Wen-jing,ZHOU Hui,GU Bo
(College of Biochemical Engineering,Nanjing Normal University Taizhou College,Taizhou 225300,China)
In order to improve the utilization efficiency and explore the application of laccase in environmental governance,the immobilization process of the laccase fromAgaricusbisporusin sodium alginate gel spheres and the degradation of dimethyl phthalate(DMP)using the immobilized enzyme were investigated by single-factor experiments. According to the research,the best efficiency of immobilization was obtained by using the direct embedding method when the enzyme dosage was 160 U/g carrier,the concentration of sodium alginate was 3%,the concentration of CaCl2was 0.15 mol/L and the immobilized time was 2 h. The degradation rate of DMP was decreased with the improvement of the initial concentration of DMP. In a initial pH of 3 and 4.5,the DMP has a good degradation effect. At a initial DMP concentration of 25 mg/L(pH4.5),the degradation rate of DMP reached 56.9% within 24 h,with 2 U/g the amount of immobilized enzyme-ball and 0.3 mmol/L of ABTS as redox mediator added. The research provided an efficient way and theoretical basis for DMP waste treatment.
laccase;immobilization;dimethyl phthalate;degradation
2015-03-25
李飞(1986-),男,硕士,讲师,主要从事天然产物的开发、酶工程、基因工程,E-mail:kasber-lee@163.com。
泰州市社会发展项目(TS019、TS201337);南京师范大学泰州学院青年项目(Q201242);2015年江苏省高等学校大学生创新训练计划项目;江苏省高校自然科学研究项目(15KJB220004)。
TS201.3
A
1002-0306(2015)23-0177-05
10.13386/j.issn1002-0306.2015.23.028
