高产γ-氨基丁酸酿酒酵母的筛选及其在梨酒酿制中的应用
2015-05-05赵国群关军锋
赵国群,关军锋
(1.河北科技大学生物科学与工程学院,河北石家庄 050018;2.河北省农林科学院遗传生理研究所,河北石家庄 050051)
高产γ-氨基丁酸酿酒酵母的筛选及其在梨酒酿制中的应用
赵国群1,关军锋2,*
(1.河北科技大学生物科学与工程学院,河北石家庄 050018;2.河北省农林科学院遗传生理研究所,河北石家庄 050051)
从梨果实表面筛得到8株既能高产γ-氨基丁酸(GABA),又有较强产酒精能力的酵母菌株,其中菌株KS45产生GABA能力最强,达到了1.146 g/L。经鉴定,菌株KS45为酿酒酵母。当在含有梨汁的发酵培养基中静置发酵时,酿酒酵母KS45高产GABA,这表明梨汁中可能含有刺激酵母合成GABA的物质。将酿酒酵母KS45接种到鸭梨汁中,30 ℃下静置发酵10 d,获得了富含GABA 的梨酒,其中GABA含量达到了2.427 g/L。实验发现,在富含GABA梨酒发酵过程中,GABA的产生伴随着酒精的消耗,呈现耦合关系,其机理尚不清楚。随着发酵温度的升高,梨酒的最终酒精度显著降低。装液量对GABA产生有很大影响。随着装液量的增加,梨酒中GABA含量急剧下降,这可能与氧气供给不足有关。
γ-氨基丁酸,酿酒酵母,梨酒,筛选
γ-氨基丁酸(γ-Aminobutyric Acid,GABA)是一种非蛋白质的天然氨基酸,广泛存在于植物、动物和微生物中[1]。GABA具有抗衰老、降血压、改善肝功能、调节激素分泌、改善睡眠、增强记忆力、防治肥胖等重要生理功能[2-3]。GABA主要是通过谷氨酸脱羧酶催化谷氨酸脱羧转化而成的[4]。乳酸菌[5-7]、霉菌[8-9]、酵母菌[10-11]以及其他微生物中均含有这种酶,因此,可通过提取谷氨酸脱羧酶或通过微生物发酵来生产GABA。随着人们生活水平的提高和保健意识的增强,富含GABA的功能性食品已经成为研究和开发的热点。
目前,采用微生物发酵已经开发的富含GABA食品有发酵乳[12]、清酒[13]、饮料酒[14]、米醋[15]等,但富含GABA 的果酒尚未见报道。梨果肉质细脆,含糖量高,香甜爽口,营养丰富,含有各种蛋白质、矿物质和多种维生素等,是酿造果酒的良好原料[16]。本研究从梨果实表面筛选出了既能高产GABA,又仍有较强产酒精能力的酿酒酵母,并用于梨酒的酿制,获得了富含GABA的梨酒。
1 材料与方法
1.1 材料与仪器
鸭梨、雪梨 河北省赵县产;溴甲酚绿 天津市百世化工有限公司,分析纯;琥珀酸 天津市博迪化工有限公司,分析纯;50%乙醛酸溶液 上海源叶生物科技有限公司。
SP-722E型分光光度计 上海光谱仪器有限公司;SPX-250B-II型生化培养箱 上海贺德实验设备厂;安捷伦6820高效气相色谱仪 美国惠普公司。
1.2 实验方法
1.2.1 培养基 YPD培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,琼脂20 g/L,pH自然;GABA筛选培养基[17]:葡萄糖20 g/L,蛋白胨20 g/L,酵母粉10 g/L,琼脂20 g/L,溴甲酚绿0.1 g/L,琥珀酸2 g/L,乙醛酸2 g/L,pH自然;WL琼脂培养基[18]酵母浸粉5 g/L,胰蛋白胨5 g/L,葡萄糖50 g/L,琼脂 20 g/L,磷酸二氢钾0.55 g/L,氯化钾0.425 g/L,氯化钙0.125 g/L,氯化铁0.0025 g/L,硫酸镁0.125 g/L,硫酸锰0.0025 g/L,溴甲酚绿0.022 g/L,pH为6.5;发酵培养基[19]:蔗糖 200 g/L,酵母浸粉10 g/L,硫酸铵 1.0 g/L,磷酸二氢钾1.0 g/L,硫酸镁1.0 g/L pH自然;梨汁发酵培养基:50%鸭梨汁+发酵培养基。实验所用的鸭梨汁中GABA含量为0.76~1.03 g/L。
1.2.2 酵母的富集培养 选择糖分含量高、香气浓、充分成熟、无霉烂果的梨果,去核、不去皮,用螺杆式榨汁机榨汁。分别取100 mL果汁于250 mL锥形瓶中,并加入适量果渣。加入5%亚硫酸钠溶液,使得果汁SO2浓度为50 mg/L;用8层干净的纱布封口,放置于30 ℃的恒温培养箱中培养,直到有酒味产生为止。
1.2.3 高产GABA酿酒酵母的初筛 将发酵后的梨汁进行适当稀释后涂布到GABA筛选培养基上,于30 ℃恒温培养箱中培养3 d。观察菌落颜色和形态,挑取具有酵母形态、绿色较深的菌株进行分离纯化。纯化菌株保藏于试管斜面,并保存于4 ℃冰箱中。将初筛出的高产GABA菌株,接种YPD液体培养基,活化24 h后接种到WL琼脂培养基,30 ℃培养3 d后观察,挑选出浅黄色-绿色、表面光滑、球形突起的、不透明的菌株。
1.2.4 高产GABA酿酒酵母的复筛 将初筛得到的高产GABA菌株,分别接种到100 mL发酵培养基、梨汁发酵培养基中,30 ℃静置发酵6 d。待发酵结束后测定发酵液中GABA的含量和酒精含量。
1.2.5 高产GABA酿酒酵母的鉴定 将复筛所得到GABA产量最高的酵母菌株KS45,进行赖氨酸培养基鉴定[20],并送交上海生工生物工程股份有限公司进行分子鉴定。
1.2.6 富含GABA梨酒的酿制
1.2.6.1 酿酒酵母种子液的制备 在100 mL YPD液体培养基中,分别接入2~3环斜面保藏的酿酒酵母KS45,30 ℃、180 r/min 摇床培养2 d。
1.2.6.2 梨汁的制备 选择新鲜无病的成熟鸭梨,清水洗净、去核后,用螺杆式榨汁机榨汁,并用蔗糖调整其糖度为20%。
1.2.6.3 发酵时间的影响 将150 mL梨汁加入250 mL的三角瓶中,并按10%接种量接入种子液,用8层干净的纱布封口,在30 ℃下分别静置发酵4、6、8、10、12 d。
1.2.6.4 发酵温度的影响 按10%接种量向150 mL梨汁中接入种子液,分别在15、20、25、30、35 ℃下恒温静置发酵10 d。
1.2.6.5 装液量的影响 将制备好的梨汁装入500 mL三角瓶中,装液量分别控制为100、200、300、400 mL,接入10%种子液,分别在30 ℃下静置发酵10 d。
1.3 分析方法
1.3.1 GABA测定 采用Berthelot比色法[21]。每个实验设置三个平行实验,测定GABA,取其平均值。
1.3.2 酒精度测定 梨酒蒸馏后,以正丁醇为内标物,采用气相色谱仪测定其乙醇含量。每个实验设置三个平行实验,测定酒精度,取其平均值。
2 结果与分析
2.1 高产GABA酸酿酒酵母的筛选
2.1.1 高产GABA酿酒酵母的初筛 黄丽华等[17]在筛选高产GABA的酵母菌株时,使用了一种含有溴甲酚绿、琥珀酸和乙醛酸的筛选培养基。这种培养基对GABA具有显色专一性,菌落绿色越深,表明该菌株产生的GABA越多,从而可快速地初筛出GABA高产菌株。课题组曾采用柠檬酸、草酸、乳酸、盐酸、硫酸、磷酸验证过其准确性,发现这些有机/有机酸在该筛选培养基上均不显色,只有GABA显示出黄绿色,这表明该筛选培养基对GABA具有良好的选择性和灵敏性。
将自然发酵后的梨汁进行适当稀释后涂布到GABA筛选培养基上,30 ℃培养3 d,其中一个平板的培养结果见图1。观察菌落颜色和形态,挑取出具有酵母形态、绿色较深的菌株进行分离纯化,获得了83株高产GABA酵母菌株。WL培养基对酿酒酵母的筛选可信度达到100%[18]。将上述获得83株酵母菌株,活化后接种到WL琼脂培养基,挑选出了67株呈浅黄色-绿色菌株,初步判定其为酿酒酵母。

图1 不同酵母菌株在GABA筛选培养基上的菌落形态Fig.1 The colonies of different yeast strains on the GABA selecting medium
2.1.2 高产GABA酿酒酵母的复筛 本研究的目的是获得富含GABA的梨酒,因此,复筛时采用了静置发酵。将初筛得到的高产GABA酵母菌株分别接种到发酵培养基进行静置发酵,发酵结束后,检测其中的GABA和酒精含量。实验发现,所有酵母菌株均产生不同浓度的酒精,但均检测不出GABA。分析其原因很可能是由于静置发酵时氧气供给太低造成的。与之相反,当将初筛得到的高产GABA酵母菌株在梨汁发酵培养基进行静置发酵时,发现所有酵母菌株在产生酒精的同时,均可检测到有不同浓度的GABA产生,这说明梨汁中可能含有刺激GABA合成物质。这些刺激GABA合成物质使得酵母菌能够在厌氧条件合成了较多GABA。在梨汁发酵培养基上经过复筛,共获得了8株高产GABA酿酒酵母(表1),其中菌株KS45产生的GABA最多,达到了1.146 g/L。从表1中还可以发现,普通酿酒用的安琪酿酒酵母可以产生酒精,但不产生GABA。菌株KS45在高产GABA的同时,仍具有良好的产生酒精的能力,其发酵酒精度达到8%,因此,本研究采用菌株KS45来酿制富含GABA梨酒。菌株KS45的菌落形态特征为:乳白色,球形突起,表面光滑,不透明,奶油状(图2)。

表1 高产GABA酵母菌株的复筛结果
注:表1中GABA产量为酵母菌株产生的净GABA值。

图2 酵母菌株KS45的菌落形态Fig.2 The colonies of yeast strains KS45
2.1.3 高产GABA酿酒酵母的鉴定 酿酒酵母不能利用赖氨酸作为氮源,因而在赖氨酸培养基上不能生长。将复筛所得到GABA产量最高的酵母菌株KS45,接种到赖氨酸培养基进行培养,发现菌株KS45不能在赖氨酸培养基形成菌落,因而基本上可确定菌株KS45为酿酒酵母。为了更加准确和可靠,将菌株KS45送交上海生工生物工程股份有限公司进行了分子鉴定。提取KS45菌株的基因组DNA,用通用引物NS1和NS6进行扩增可知18S rDNA 的PCR长度约为1300 bp。经测序,菌株KS45的18S rDNA核苷酸序列大小为1335 bp,与NCBI数据库序列比对结果显示:菌株KS45的18S rDNA核苷酸序列与酿酒酵母(Saccharomycescerevisiae)18S rDNA(GeneBank登记号为EU011664.1)核苷酸序列一致性达到99%,因此将菌株KS45鉴定为酿酒酵母。
2.2 富含GABA梨酒的酿制
2.2.1 发酵时间的影响 将酿酒酵母KS45接种到梨汁中进行酒精发酵,定时取样监测梨汁中GABA含量和酒精度的变化,实验结果见图3。从图3中可以看出,在发酵的前4 d,随着酵母菌体的生长和发酵时间的延长,酒精浓度急剧上升,并在第4 d达到最高值,9.5%;而与此同时,梨酒中GABA含量却逐渐下降,在第4 d达到最低值,0.88 g/L。在葡萄酒酿造过程中也观察到类似的现象,可能是GABA用作氮源而被菌体吸收利用[22]。4 d发酵以后,随着发酵时间的延长,发酵液中酒精度呈近似线性地下降,而GABA含量却呈近似线性地上升,直至发酵结束。这个结果表明GABA产生的同时伴随着酒精的消耗,呈现耦合关系,且为负相关。在我们的另外实验中,发现发酵过程中酒精度的降低并不是由于醋酸菌的醋酸发酵而造成酒精的减少(数据未显示)。那么,酿酒酵母KS45在合成GABA的同时,为什么消耗乙醇,其机理尚不清楚。参考葡萄酒对酒精度(≥7.0%)要求,因此,富含GABA梨酒的适宜发酵时间为10 d。

图3 发酵时间的影响Fig.3 The effect of fermentation time
2.2.2 发酵温度的影响 温度是影响酿酒酵母生长和酒精发酵的一个重要因素。如图4所示,当发酵温度较低(15~25 ℃)时,菌体产生GABA的量很低。发酵温度为30 ℃时,菌体产生GABA的能力最强,发酵液中GABA浓度达到最大值,2.427 g/L。当发酵温度升高至35 ℃,菌体产生GABA量显著下降。胡超等[23]也发现酿酒酵母产生GABA的最适温度为30 ℃。对于普通梨酒及其他果酒而言,一般是较高发酵温度下所获得的酒精度要高于较低发酵温度,或者发酵温度对最终酒精度影响不大[24-25]。然而,从图4中却发现,随着发酵温度的升高,梨酒中酒精度呈显著下降趋势。造成这种现象的部分原因可能是:GABA的产生与酒精的消耗呈负相关(见2.2.1);在较低的发酵温度下,菌株KS45产生的GABA较少,酒精消耗也较少,因而使得梨酒的最终酒精度较高。发酵温度为35 ℃时,GABA和酒精度均显著降低,可能是高温(35 ℃)既抑制乙醇的产生,也抑制GABA的合成。

图4 发酵温度的影响Fig.4 The effect of fermentation temperature
2.2.3 装液量的影响 装液量的多少直接影响酿酒酵母酒精发酵过程中氧气的供给。从图5中可以看出,随着装液量的增加,梨酒的酒精度逐渐上升,而梨酒中GABA含量却急剧下降。关于GABA生物合成的机理研究基本上都集中于乳酸菌,而对酿酒酵母合成GABA的机理国内外都极少研究。关于酿酒酵母合成GABA是否需氧,国内外文献均没有明确说明。蒋冬花等[11]、胡超等[23]在摇床发酵研究酿酒酵母产GABA发酵条件时,发现高摇床转速产生的GABA高于低摇床转速。结合本研究结果,可初步推断酿酒酵母生物合成GABA是一个需氧过程。当梨汁装液量较高时,由于氧气供给的不足,造成酿酒酵母产生较少的GABA。
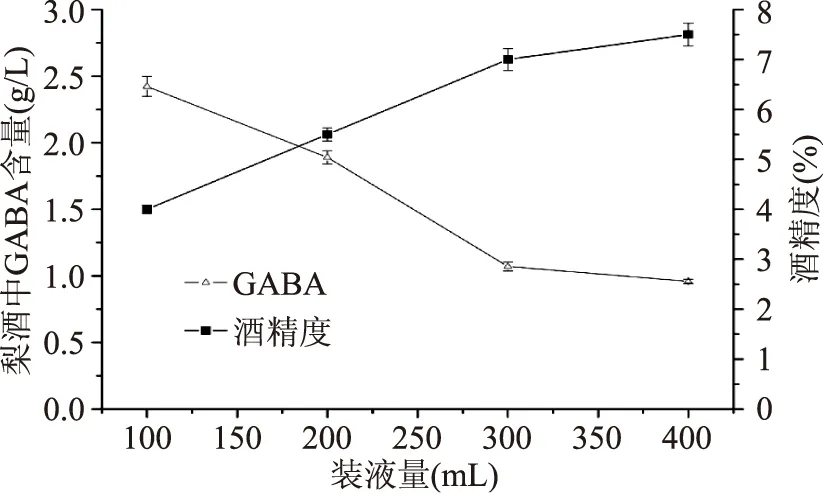
图5 装液量的影响Fig.5 The effect of broth volume in the fermentor
3 结论
本研究从梨果实表面筛选出了8株既能高产GABA,又有较强产酒精能力的酵母菌株,其中菌株KS45产生GABA能力最强,达到了1.146 g/L。经鉴定,菌株KS45为酿酒酵母。实验发现,只有在含有梨汁的发酵培养基中,筛选出的酵母菌才能在静置发酵时高产GABA,这表明梨汁中可能含有刺激酿酒酵母合成GABA的物质。将酿酒酵母KS45按10%接种量接入到鸭梨汁中,30 ℃下静置发酵10 d,获得了富含GABA 的梨酒,其酒精度为7.0%,GABA含量达到了2.427 g/L,比发酵前(梨汁)增加了2倍多。实验还发现,在富含GABA梨酒发酵过程中,GABA产生的同时伴随着酒精的消耗,呈现耦合关系,其机理尚不清楚。随着发酵温度的升高,梨酒的最终酒精度显著下降。装液量对GABA产生有很大影响。随着装液量的增加,梨酒中GABA含量急剧下降,这可能与氧气供给不足有关。
[1]梁恒宇,邓立康,林海龙,等. 新资源食品-γ-氨基丁酸(GABA)的研究进展[J]. 食品研究与开发,2013,34(15):119-123.
[2]王辉,项丽丽,张锋华.γ-氨基丁酸(GABA)的功能性及在食品中的应用[J].食品工业,2012,40(11):186-188.
[3]金红星,田楠,成文玉,等. 微生物发酵合成γ-氨基丁酸的研究进展[J]. 安徽农业科学,2012,40(11):6385-6386.
[4]林亲录,王婧,陈海军.γ-氨基丁酸的研究进展[J]. 现代食品科技,2008,24(5):496-500.
[5]Park K B,Oh S H. Cloning and expression of a full-length glutamate decarboxylase gene from Lactobacillus plantarum[J]. Journal of Food Science and Nutrition,2004(9):324-329.
[6]Yokoyama S,Hiramatsu J I,Hayakawa K. Production ofγ-aminobutyric acid from alcohol distillery lees by Lactobacillus brevis IFO-12005[J]. Journal of Bioscience and Bioengineering,2002,93(1):95-97.
[7]黄桂东,毛健,姬中伟,等. 一株产γ-氨基丁酸植物乳杆菌MJ0301培养基的优化[J].食品科学,2013,34(17):165-170.
[8]边鑫,吴非.高产γ-氨基丁酸霉菌菌株的筛选及诱变育种[J].食品科学,2012,33(21):213-216.
[9]张圆林,王昌禄,陈勉华,等.高产γ-氨基丁酸的红曲霉菌株筛选及发酵条件优化[J]. 食品科学技术学报,2014,32(5):35-40.
[10]乌云达来,王肇悦,郭雪娜,等. 产γ-氨基丁酸酵母菌的筛选及菌种鉴定[J].内蒙古农业大学学报,2013,34(6):110-114.
[11]蒋冬花,李杰,后家衡,等.水果表面高产γ-氨基丁酸酵母菌菌株的筛选、鉴定和发酵条件优化[J].浙江农业学报,2008,20(6):396-401.
[12]薛玉清,单艺,满朝新,等.γ-氨基丁酸发酵乳的研制[J].食品与发酵工业,2013,39(11):85-90.
[13]吴岱熹,吴非. 富含γ-氨基丁酸清酒酒曲的研究[J].食品工业科技,2012,33(21):188-192.
[14]陈成,常洪娟. 利用发芽糙米制备γ-氨基丁酸低度饮料酒的研究[J]. 酿酒,2012,39(2):73-75.
[15]Chen C X,Chen F S. Study on the conditions to brew rice vinegar with high content ofγ-amino butyric acid by response surface methodology[J]. Food and Bioproducts Processing,2009,87(3):334-340.
[16]金磊,董文宾,张丹,等.梨酒酵母的筛选及鉴定[J].食品工业科技,2012,33(10):231-249.
[17]黄丽华,胡超,左斌,等.高产γ-氨基丁酸酵母菌株的亚硝基胍诱变选育[J].现代生物医学进展,2010,10(6):1106-1109.
[18]薛军侠,徐艳文,杨莹,等. WL培养基在酿酒酵母筛选中的应用[J].中国酿造,2007(10):36-39.
[19]王慧,张立强,刘天明,等. 产地葡萄酒优良酵母菌株的筛选及鉴定[J]. 酿酒科技,2007(9):29-31.
[20]蒋文鸿,严斌,陶永胜.昌黎赤霞珠葡萄相关酿酒酵母的分离与筛选[J]. 食品工业科技,2014,35(12):202-206.
[21]梁金钟,李雯,王风青. 产γ-氨基丁酸乳酸菌的筛选及诱变育种[J]. 食品科学,2013,34(23):228-232.
[22]李波,李磊,邓旭衡,等.葡萄酒发酵过程中γ-氨基丁酸含量变化的研究[J].中国酿造,2011(7):171-173.
[23]胡超,左斌,谢达平. 酵母产γ-氨基丁酸发酵条件的研究[J]. 现代生物医学进展,2011,11(5):861-863.
[24]薛桂新. 苹果梨酒生产工艺的研究[J]. 酿酒科技,2007(6):103-106.
[25]向敏,匡晓东,王聪田,等.干型金秋梨酒酿造工艺研究[J].中国农学通报,2010,26(18):87-91.
Screening of highγ-aminobutyric acid-yield yeast strains ofSaccharomycesCerevisiaeand application in brewing of pear wine
ZHAO Guo-qun1,GUAN Jun-feng2,*
(1.College of Bioscience and Bioengineering,Hebei University of Science and Technology,Shijiazhuang 050018,China;2.Institute of Genetics and Physiology,Hebei Academy of Agriculture and Forestry Sciences,Shijiazhuang 050051,China)
Eight yeast strains which could produce high yield ofγ-aminobutyric acid(GABA)and ethanol were screened from the surface of pear fruits,among which,yeast strain KS45 had the highest capability of GABA production(1.146 g/L). Strain KS45 was then identified asSaccharomycescerevisiae. WhenS.cerevisiaeKS45 was cultivated in pear juice-contained culture media,it could produce high yield of GABA in anaerobic condition,which indicated that pear juice might had compounds that could stimulateS.cerevisiaeKS45 to produce GABA. AfterS.cerevisiaeKS45 was inoculated in Ya pear juice and fermented in a incubator at 30 ℃ for 10 d,pear wine with rich GABA(2.427 g/L)was obtained. It was found that GABA production was coupled with ethanol consumption during the brewing of pear wine,and its mechanism was not clear. The final ethanol concentration of pear wine decreased significantly as the fermentation temperature increased. The volume of culture medium in the fermentor could affect the production of GABA. With increasing of the volume of culture medium,GABA concentration of the pear wine rapidly decreased,and the possible reason was that supply of oxygen was not sufficient.
γ-aminobutyric acid;Saccharomycescerevisiae;pear wine;screening
2015-02-09
赵国群(1963-),男,博士,教授,研究方向:食品生物技术,E-mail:gqzhao18@126.com。
*通讯作者:关军锋(1966-),男,博士,研究员,研究方向:果品贮藏加工,E-mail:junfeng@126.com。
国家现代农业[梨]产业技术体系建设专项(cars-29)。
TS255.47
A
1002-0306(2015)23-0173-05
10.13386/j.issn1002-0306.2015.23.027
