P53蛋白参与灵芝酸抑制癌细胞增殖的过程
2015-05-05王雨蔷孙培龙欧阳晶晶
唐 文,吴 颖,王雨蔷,孙培龙,欧阳晶晶
(1.上海应用技术学院 香料香精技术与工程学院 食品系,上海 201418;2.上海应用技术学院 化学与环境工程学院,上海 201418)
P53蛋白参与灵芝酸抑制癌细胞增殖的过程
唐 文1,吴 颖2,王雨蔷1,孙培龙1,欧阳晶晶1
(1.上海应用技术学院 香料香精技术与工程学院 食品系,上海 201418;2.上海应用技术学院 化学与环境工程学院,上海 201418)
通过对灵芝三萜类物质(灵芝酸T)抑制肺癌H1299(p53-/-)细胞、肺癌95-D(p53+/+)细胞增殖实验,考察了P53蛋白对灵芝酸抑制增殖作用的影响。结果表明:通过比较IC50,表达野生型P53蛋白的95-D细胞比不表达P53蛋白的H1299细胞对灵芝酸T的敏感性高3.3倍。P53抑制剂Pifithrin-α与灵芝酸T联合处理能显著地降低灵芝酸T对95-D细胞增殖的抑制率(p<0.05)。进一步研究表明灵芝酸T可诱导95-D(p53+/+)中P53蛋白表达,并促进细胞凋亡。以上结果提示P53蛋白参与了灵芝酸T抑制肿瘤细胞增殖的过程,可能是灵芝三萜类物质抗肿瘤的作用靶点。本研究可为开发辅助抑制肿瘤类保健食品研究提供理论基础。
灵芝酸T,P53蛋白,增殖抑制,保健食品
灵芝(Ganodermalucidum)是一种传统的药用真菌,《中华人民共和国药典》收录了灵芝作为法定中药材[1],2001年灵芝被列入《可用于保健食品的真菌菌种名单》。截止到2013年,国内已注册近600种灵芝类保健食品,其中64%具有免疫调节作用,6%具有护肝作用,4%具有辅助抑制肿瘤作用(基于对中国国家食品药品监督管理局网中灵芝保健品公开信息的统计分析),保健功能主要集中在免疫调节功能上,需要在灵芝保健功能研究方面加以拓展和深化。同时,随着生活方式、环境条件及人口老龄化等影响肿瘤发生发展因素的改变,自20世纪70年代以来,我国癌症呈明显上升趋势,现已成为城、乡居民的首要死因,其中肺癌的上升趋势尤为明显[2]。因此,研究灵芝辅助抑制肿瘤保健功能具有一定的理论和实际意义。
三萜类化合物(如灵芝酸类)是灵芝中重要活性物质之一[3-4]。自Toth O等[5]报道灵芝三萜类化合物的抗癌活性以来,多种灵芝酸被证实具有抑制肿瘤增殖和转移功能[6-7]。本课题组前期研究表明灵芝酸诱导肿瘤细胞凋亡的途径是依赖于线粒体的内源性凋亡途径[8],P53蛋白在灵芝酸抑制肿瘤转移过程中发挥作用[9]。但P53蛋白是否参与灵芝酸抑制肿瘤细胞增殖的过程还未见报道。
本研究拟采用表达p53基因的95-D肺癌细胞和p53基因缺失的H1299肺癌细胞,通过研究灵芝酸T抑制两种细胞增殖效果的差异,分析P53蛋白在灵芝酸抗癌细胞增殖过程中的作用,研究结果将为开发功能因子明确的具有辅助抑制肿瘤作用的保健食品提供依据。
1 材料与方法
1.1 材料和仪器
细胞株:H1299(人非小细胞肺癌细胞,p53-/-)和95-D(人高转移肺癌细胞,p53+/+) 购于中国科学院上海生命科学研究院细胞资源中心;灵芝酸T(纯度>99%)从赤芝(Ganoderma lucidum)子实体中经制备色谱分离提取,经核磁谱图与标准品比对鉴定,以DMSO(二甲亚砜)溶解备用。噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide,MTT)、Pifithrin-α-hydrobromide(Pifithrin-α)、RPMI 1640培养基、小牛血清、凋亡分析试剂盒 购于华美生物技术有限公司;鼠抗人p53单克隆抗体(即用型)、DAB显色试剂盒 购于北京中杉金桥生物技术有限公司。
酶标仪Bio-Rad,USA;CO2培养箱Heraeus,USA;流式细胞仪BD Bioscience,USA。
1.2 实验方法
1.2.1 细胞培养方法 H1299和95-D细胞采用常规RPMI1640培养基,青霉素和链霉素双抗,10%小牛血清,37℃,5% CO2条件下培养和继代。
1.2.2 抑制细胞增殖能力的测定 分别取对数生长期细胞1×105个/mL接种于96孔培养板,每孔0.2mL,6h贴壁后分别加入不同终浓度(8.5,10,25,50μg/mL等)的灵芝酸T溶液处理,对照组加等量体积的溶剂。置37℃,5% CO2及饱和湿度的培养箱培养24h,实验终止前4h每孔加入5μg/mL MTT 10μL,培养结束后每孔加入0.04mol/L DMSO 200μL,振荡保温15min,待MTT还原产物完全溶解,酶标仪以570nm为分析波长,测定吸光度。通过计算得到抑制率:抑制率(%)=(处理组吸光度的平均值/对照组吸光度的平均值)×100。独立进行3次实验。每次实验重复6次,取平均值[8]。
1.2.3 凋亡分析 对数生长期95-D细胞培养4h后,经各种浓度的药物作用特定的时间后,经胰蛋白酶消化,离心收集细胞(1500r/min × 10min),PBS 洗涤两遍,以PBS调整细胞浓度为106个/mL,加入RNase,终浓度为100U/mL,37℃保温30min,加入Annexin V和PI,终浓度为50μg/mL,在常温下暗反应30min,然后200目滤膜过滤,经流式细胞仪分析凋亡,每次记录1000~1500个细胞。
1.2.4 P53蛋白的western blotting分析 Western blotting分析P53蛋白,方法完全按照参考文献[8]的流程操作。
1.2.5 统计学方法 采用SPSS统计软件对各组数据进行显著差异性分析,在*p<0.05水平和**p<0.01水平下判断其显著差异性。
2 结果与分析
2.1 灵芝酸T抑制95-D和H1299细胞增殖效果的差异
通过比较灵芝酸T抑制H1299(人肺癌细胞,p53-/-)、95-D(人肺癌细胞,p53+/+)细胞增殖效果,考察P53 蛋白是否对抑制过程有影响。图1表明灵芝酸T对95-D和H1299肺癌细胞增殖均具有抑制能力,表现出一定的浓度依赖性。表达P53 蛋白95-D细胞的生长被明显地抑制,与之相比,不表达P53 蛋白的H1299细胞对灵芝酸T敏感性较低。灵芝酸T对95-D肺癌细胞的IC50为24.5μg/mL,对H1299肺癌细胞的IC50的理论计算值是80μg/mL,约是95-D的3.3倍。50μg/mL的灵芝酸T处理可抑制78%的95-D细胞增殖,而对H1299细胞的抑制率只有31%。以上结果表明:灵芝酸T剂量依赖性地抑制95-D和H1299细胞增殖,且对95-D细胞更敏感。95-D细胞是表达P53蛋白的肿瘤细胞,因此,可以推测P53蛋白可能参与了灵芝酸T抑制细胞增殖的过程。
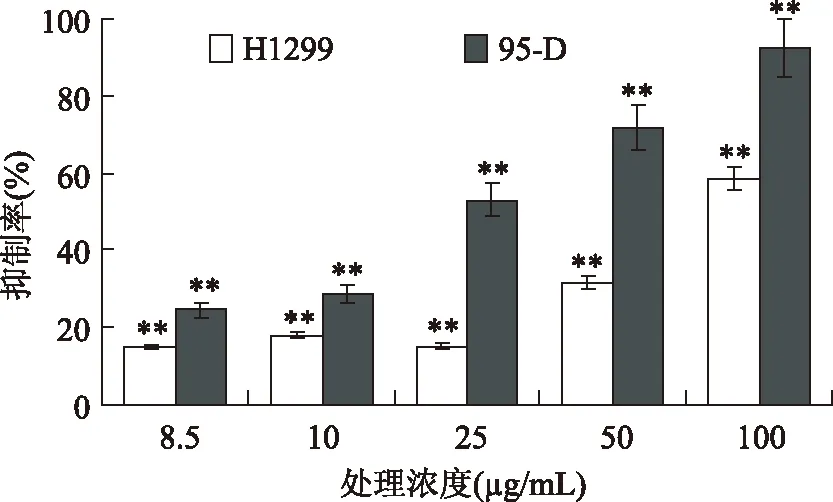
图1 灵芝酸T对H1299和95-D细胞的细胞毒性Fig.1 The cytotoxicity of ganoderic acid T on H1299和95-D cells
图2表明灵芝酸T处理时间对95-D和H1299细胞增殖过程的影响,根据图1结果计算出两种细胞的半数致死浓度为24.5、80μg/mL,做为灵芝酸T处理浓度。结果表明在高浓度(80μg/mL)条件下,灵芝酸T对95-D和H1299细胞增殖的影响在25h之前有极其显著地差异(p<0.01),对95-D细胞的抑制率显著地高于对H1299细胞的抑制率。相同浓度(80μg/mL)下,灵芝酸T对95-D细胞在实验5h即表现出很强的抑制率,达到76%;而H1299细胞在后期才表现出相同的抑制率。在较低浓度(25μg/mL)条件下,灵芝酸T对95-D和H1299细胞增殖的影响在实验前期(19h之前)差异不显著,而在实验后期(19h以后)表现出显著差异(p<0.05),95-D细胞增殖抑制率显著高于H1299细胞增殖抑制率。

图2 灵芝酸T处理时间对H1299 和95-D细胞增殖的影响Fig.2 The time course of the cytotoxicity of ganoderic acid T on H1299和95-D cells
以上结果表明:不表达P53 蛋白的H1299细胞对灵芝酸T处理的抑制反应要比表达的95-D细胞延迟和降低,提示P53 蛋白参与了灵芝酸T抑制肿瘤细胞增殖的过程。
2.2 P53抑制剂Pifithrin-α抑制了灵芝酸T对95-D细胞的细胞毒性
为了确证P53蛋白参与了灵芝酸T抑制肿瘤细胞增殖的过程,选择P53抑制剂进行比较研究。Pifithrin-α是一种常用的P53抑制剂,能可逆地抑制P53依赖的基因转录激活[10]。图3表明,Pifithrin-α对95-D细胞具有一定的细胞毒性,但在低于5μmol/L浓度下对95-D细胞的毒性很小(抑制率低于2.5%),因此选择5μmol/L作为下一步实验的处理浓度。

图3 Pifithrin-α对95-D细胞的细胞毒性Fig.3 The cytotoxicity of Pifithrin-α on 95-D cells
添加5μmol/L P53抑制剂Pifithrin-α后,不同浓度灵芝酸T抑制95-D细胞增殖的效果显著下降,10,25μg/mL处理组和对照组间抑制率有显著性差异(p<0.01)。而H1299细胞因为不表达P53蛋白,Pifithrin-α对灵芝酸T抑制其增殖没有影响(数据未列出)。图4结果表明:P53蛋白参与介导了灵芝酸T抑制肺癌细胞95-D增殖的过程。但50μg/mL处理组差异不显著,提示在较高浓度下,灵芝酸T可能还有其他的不依赖于P53调节的抑制癌细胞增殖的途径[8],因此对p53基因野生型和缺陷型细胞都具有较大的毒性。

图4 Pifithrin-α和灵酸T联合用 对95-D细胞增殖的影响Fig.4 The cytotoxicity of Pifithrin-α and Ganoderic acid T on 95-D cells
2.3 灵芝酸T处理增加了细胞内P53蛋白的表达量并诱导95-D细胞凋亡并
灵芝酸T(50μg/mL)分别处理95-D细胞0,4,8h后收集细胞,进行P53蛋白的western blotting分析,结果如图5所示。结果表明灵芝酸T可诱导95-D细胞内P53蛋白表达量增加,具有时间依赖性。以上结果表明:在灵芝酸T抑制细胞增殖过程中,P53蛋白参与了这个过程。

图5 灵芝酸T诱导95-D细胞P53蛋白的表达Fig.5 Ganoderic acid T induced the accumulation of P53 protein in 95-D cells
灵芝酸T(50μg/mL)分别处理95-D细胞0,4,8h后进行流式细胞术分析。结果表明灵芝酸T可诱导95-D细胞的凋亡,且随着处理时间增加凋亡率逐渐增加。灵芝酸T(50μg/mL)处理8h后,总凋亡率(早期凋亡和晚期凋亡)可达到69%。P53蛋白是细胞生长的负调控因子,可通过诱导凋亡抑制癌细胞增殖,图5、图6数据显示随着P53蛋白表达量的增加,癌细胞总凋亡率增加。
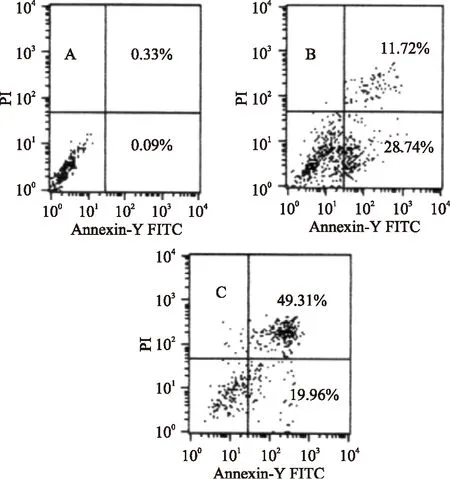
图6 灵芝酸T诱导95-D细胞凋亡Fig.6 Ganoderic acid T induced the apoptosis of 95-D cells注:A:0h;B:4h;C:8h。
P53蛋白是一种53ku的核内磷酸化蛋白,是细胞生长的负调控因子。以上数据表明较低浓度灵芝酸T可以刺激95-D肿瘤细胞内野生型P53蛋白表达,进而诱导凋亡并抑制细胞增殖。同时较高浓度灵芝酸T有直接的细胞毒性,对不表达P53蛋白的癌细胞也具有抑制增殖能力。虽然进一步的调控机制有待深入研究,但现有数据已证明灵芝酸T通过诱导P53蛋白表达和凋亡进而抑制肿瘤细胞增殖。结合我们前期的灵芝酸增敏增效作用研究[2],提示灵芝酸具有辅助抑制肿瘤作用。
3 结论与讨论
灵芝酸T对H1299肺癌细胞的细胞毒性要明显地低于对95-D肺癌细胞的细胞毒性,这两种细胞的主要差异体现在P53蛋白表达上,H1299肺癌细胞为p53基因缺失型,不表达P53蛋白[11]。95-D肺癌细胞可表达野生型P53蛋白[7]。添加p53抑制剂后,灵芝酸T抑制95-D细胞增殖的能力显著下降。Western blotting 分析表明,灵芝酸T处理提高了95-D细胞内P53蛋白的表达量并诱导癌细胞凋亡。以上结论表明:灵芝酸处理95-D细胞会刺激P53蛋白的表达,P53蛋白介导了灵芝酸T抑制肿瘤细胞增殖和诱导凋亡的过程。P53蛋白或p53基因可能是灵芝酸发挥抗癌作用的靶点之一。以上结论对于灵芝保健食品研究具有一定的意义。
我国是保健食品生产和消费大国,但保健食品行业创新水平参差不齐,技术创新率总体偏低。第三代保健食品的研发尚处于起步阶段。在已注册的近600种灵芝类保健食品中,主成分为粗多糖的产品占39%,主成分为三萜粗提物的产品占31%,主成分为粗多糖和三萜粗提物混合物的产品占12%,未标注主成分的产品占18%。特别是所有产品均未标注具体的组成成分及各成分比例,导致功效成分不准确,产品质量控制标准不清晰、作用机制不明确等问题的出现。因此,迫切需要确切功效和特定成分之间的对应关系研究。
我国中药材品种丰富,且有长期的临床使用实践,是保健食品研制的有效物质和重要理论来源。因此,充分利用这些优势,结合现代药理学研究技术,提升保健食品的品质和功能,对发展有中国特色的保健食品具有重要的意义。
[1]林志彬. 灵芝的现代研究[M]. 北京:北京医科大学北京协
和医科大学联合出版社,1996.
[2]杨玲,李连弟,陈育德. 中国肺癌死亡趋势分析及发病、死亡的估计与预测[J]. 中国肺癌杂志,2005,8(4):274-278.
[3]唐文.灵芝酸Me提高多药耐药性KB-A-1/Dox细胞对阿霉素敏感性的初步研究[J]. 食品工业科技,2013,34(23):97-100.
[4]付海英,贾婷,张英林,等. 三种赤灵芝粉对免疫抑制模型小鼠免疫功能的调节作用[J].中国免疫学杂志,2012,28(8):712-716.
[5]Toth O,Luu B,Ourisson G. Les acides ganoderiques taz:triterpens cytotoxiques de Ganoderma lucidum(polyporacee)[J]. Tetrahedron Letter,1983,24:1081-1084.
[6]Liu RM,Li YB,Zhong JJ.Cytotoxic and pro-apoptotic effects of novel ganoderic acid derivatives on human cervical cancer cellsinvitro[J]. European Journal of Pharmacology,2012,681(1-3):23-33.
[7]Zhou L,Shi P,Chen NH,et al. Ganoderic acid Me induces apoptosis through mitochondria dysfunctions in human colon carcinoma cells[J]. Process Biochemistry,2011,46(1):219-225.
[8]Tang W,Liu JW,Zhong JJ,et al. Ganoderic acid T from ganoderma lucidum mycelia induces mitochondria mediated apoptosis in lung cancer cells[J]. Life Sciences,2006(80),205-211.
[9]Chen NH,Zhong JJ. p53 is important for the anti-invasion of ganoderic acid T in human carcinoma cells[J]. Phytomedicine,2011,18(8-9):719-725.
[10]Mendjargal A,Odkhuu E,Koide N,et al. Pifithrin-α,a pharmacological inhibitor of p53,down regulates lipopolysaccharide-induced nitric oxide production via impairment of the MyD88-independent pathway[J]. International Immuno pharmacology,2013,15(4):671-678.
[11]王智琴,齐以涛,罗红烨,等. 苯并芘对不同p53基因型细胞的周期影响[J].毒理学杂志,2009,(3):205-208.
Inhibition of ganoderic acid mediated by P53 protein on cancer cells proliferation
TANG Wen1,WU Ying2,WANG Yu-qiang1,SUN Pei-long1,OUYANG Jing-jing1
(1.Department of Food Science and Technology,School of Perfume and Aroma Technology,Shanghai Institute of Technology,Shanghai 201418,Chin;2.School of Chemical and Environmental Engineering,Shanghai Institute of Technology,Shanghai 201418,China)
The roles of P53 protein in the inhibitory effect of ganoderic acid T(GA-T)on human lung cancer cells proliferation were evaluated by H1299(p53-/-)and 95-D(p53+/+)cells. The results showed that 95-D cell which expressed P53 protein was more sensitive to the GA-T than H1299 cell which unexpressed P53 protein. The cytotoxicity of GA-T on 95-D cells was 3.3 times higher than that of H1299 cell significantly. The cytotoxicity of GA-T on 95-D cancer cells decreased significantly after pifithrin-α treatment(p<0.05). Furthermore,GA-T stimulated the expression of P53 in 95-D cancer cells and induced the apoptosis of 95-D cancer cells dose-dependently. The results mentioned above proved that P53 participated in the process of anti-proliferation of cancer cell by GA-T and should be a potent target of ganoderic acids. The results in this paper should provide the theoretical foundation for development of functional food.
ganoderic acid T;P53 protein;anti-proliferation;function food
2014-05-04
唐文(1970-),男,博士,副教授,研究方向:食品生物技术、生化药理学。
TS201.3
A
1002-0306(2015)11-0193-04
10.13386/j.issn1002-0306.2015.11.030
