PCR-DGGE技术分析混菌发酵乳中马克斯克鲁维酵母与乳酸菌的相互作用
2015-05-05姜铁民闵伟红陈历俊
范 维,李 路,姜铁民,张 彧,闵伟红,陈历俊,*
(1.大连工业大学,辽宁大连 116034;2.吉林农业大学,吉林长春 130118;3.北京三元食品股份有限公司,北京 100076)
PCR-DGGE技术分析混菌发酵乳中马克斯克鲁维酵母与乳酸菌的相互作用
范 维1,3,李 路2,3,+,姜铁民3,张 彧1,闵伟红2,陈历俊3,*
(1.大连工业大学,辽宁大连 116034;2.吉林农业大学,吉林长春 130118;3.北京三元食品股份有限公司,北京 100076)
利用变性梯度凝胶电泳(Denaturing Gradient Gel Electrophoresis,DGGE)技术,对混菌发酵及贮藏过程中马克斯克鲁维酵母与乳酸菌之间的相互作用进行分析,进而对整个过程中微生物优势菌群及其稳定性进行跟踪监测。结果表明:混菌发酵及贮藏过程中微生物组成比较稳定,优势菌为嗜热链球菌(Streptococcusthermophilus,ST);发酵过程中,马克斯克鲁维酵母(Kluyveromycesmarxianus)的添加对乳酸菌生长起到促进作用,尤其是对保加利亚乳杆菌(Lactobacillusbulgaricus,LB)效果显著,贮藏期间该作用转变为抑制;整个过程乳酸菌的存在对酵母菌的生长具有一定的抑制作用。该研究可为深入探讨乳酸菌与酵母菌共同发酵机理及新型发酵乳制品的开发提供理论基础。
混菌发酵,变性梯度凝胶电泳,菌群分析,马克斯克鲁维酵母
众所周知,传统发酵剂是由保加利亚乳杆菌与嗜热链球菌组成的,两者之间存在共生作用。长久以来,酸奶中的酵母菌被认为是腐败菌,是引起酸奶变质的主要原因[1]。随着研究的深入,发现利用酵母菌特有的产醇、产气特性与乳酸菌共同发酵乳,其制品不但具有特殊清香味而且还保留了酸乳独特的营养价值[2-3]。因此,酵母菌作为一种新型产品将具有广阔市场前景。目前,关于酵母菌与乳酸菌之间相互影响的研究主要采用分离培养鉴定[4]、经典平板计数[5]等方法,以含有的微生物细胞数量为指标,对于发酵乳中含有的微生物组成及其优势菌群变化不能进行全面分析,并且操作过程繁琐、费时。近年来,分子生物学技术在微生物混合培养体系中的应用极大地提高了分析样品的灵敏性和准确性[6-9]。
DGGE技术是一种分子生物学研究中常用的分析方法,基于细菌16S rDNA基因中可变区域碱基组成差异,而将不同细菌进行快速检测和鉴定,不但能避免耗时的平板划线菌种分离,更能快速准确地进行复杂微生物区系菌群结构演替和优势菌群分析[10]。本研究将DGGE技术引入混菌发酵乳这一简单生态系统中,对发酵乳中微生物菌群组成稳定性、优势菌群及菌群间相互作用进行分子研究,并用分离培养方法进行对比验证,为混合型发酵产品的品质控制提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种 保加利亚乳杆菌菌粉(Lactobacillusbulgaricus,LB)、嗜热链球菌菌粉(Streptococcusthermophilus,ST) 丹尼斯克菌种有限公司;马克斯克鲁维酵母(Kluyveromycesmarxianus) 北京三元食品股份有限公司实验室保藏。
1.1.2 培养基 全脂乳粉 新西兰西部乳业有限公司。
1.1.3 主要试剂及仪器 丙烯酰胺、甲叉双丙烯酰胺、去离子甲酰胺、尿素、四甲基乙二胺(TEMED)、过硫酸铵 Sigma公司;DNA提取、PCR扩增等分子操作所用试剂、酶及DNA Marker E 赛百盛生物技术公司;玻璃珠 北京索莱宝生物公司;PCR所用引物 诺赛基因公司;GoldViewTM核酸染料 赛百盛生物技术公司;琼脂糖 基因科技有限公司。
光学显微镜 BX51,奥林巴斯公司;基因扩增仪 S1000TMThermal CyclerBio-Rad公司;变性梯度凝胶电泳仪 DcodeTM,Bio-Rad公司;凝胶成像系统 Alphalmager HP,Proteinsimple公司;电泳仪 Kyso4033-DYYⅢ型电泳槽,Bio-Rad公司;冷冻离心机 3K-15型,sigma公司;微量高速离心机 D-37520 Osterode,Thermo公司等。
1.2 实验方法
1.2.1 样品制备及采集 准备三份12%的全脂乳培养基,分别命名A、B、C。A培养基中按106cfu/mL接菌量接种乳酸菌(LB∶ST=1∶1),按乳酸菌∶酵母菌为30∶1的比例接种马克斯克鲁维酵母;B培养基按以上接菌量只接入LB和ST;C培养基按以上比例只接入马克斯克鲁维酵母。将接种好的三份12%全脂乳培养基于35℃条件下进行恒温发酵,发酵期间每间隔1h分别取一次样,直至凝乳完成(约6h)。后将三份培养基转至4℃条件下进行贮藏,分别于第1、3、5、7、10、14、21d进行取样。
1.2.2 形态观察 取全脂乳培养基中培养的LB单菌、ST单菌、马克斯克鲁维酵母单菌及混菌发酵6h的混合菌进行革兰氏染色,在光学显微镜下观察样品中微生物个体形态并显微照相。
1.2.3 总DNA的提取 分别取1mL无水乙醇、1mL氨水、1mL石油醚加入到5.00g发酵乳中,混合均匀,10000r/min离心10min,弃上清。沉淀菌体用0.5mL灭菌双蒸水重悬,将重悬菌体转移到2mL离心管中,室温下12000r/min离心1min,弃上清,在漩涡混合器上快速振荡分散菌体沉淀。菌体用300μL破菌缓冲液重悬,加0.3g玻璃珠及200μL酚/氯仿/异戊醇(25∶24∶1),高速振荡3min。加入200μL 1×TE缓冲溶液(pH=8),快速振荡,12000r/min离心5min。室温下将水相转移到一个干净的离心管中,加入1mL无水乙醇,颠倒混匀。室温12000r/min离心3min,去上清,沉淀用0.4mL TE缓冲溶液重悬。再向其中加入10μL 4mol/L的乙酸铵及1mL无水乙醇,颠倒混匀,12000r/min离心3min,弃上清。干燥沉淀,DNA用50μL TE 重悬,即得总DNA。破菌缓冲液的配制方法:Tritonx-100 20mL,SDS 10g,1mol/L(pH8.0)Tris-HCL 10mL,0.5mol/L EDTA 2mL,NaCl 5.85g,加双蒸水定容至1L,至于4℃冰箱内备用。
1.2.4 PCR扩增 第一轮PCR扩增:细菌用引物27F,5′-AGAGTTTGATCCTGGCTCAG-3′和引物1492R,5′-GGTTACCTTGTTACGACTT-3′[11]进行16S rDNA全长扩增。真菌用引物NL1,5′-GCATATCAATAAGCGGAGGAAAAG-3′和引物NL4,5′-GGTCCGTGTTTCAAGACGG-3′[12]进行26S rDNA D1/D2区扩增。50μL反应体系:PCR荧光染料(Dye)5μL,10×PCR buffer 5μL,DNTPs 1μL,上、下游引物各1μL,模版DNA 2μL,Taq酶0.5μL ,ddH2O 34.5μL。扩增反应程序:95℃,5min;95℃,45s;55℃,45s;72℃,1min,30个循环;最终72℃,10min。
第二轮PCR扩增:细菌用引物gc-338F,5′-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGG GGGGACTCCTACGGGAGGCAGCAG-3′和引物518R,5′-ATTACCGCGGCTGCTGG-3′[13]进行16S rDNA V3区扩增。真菌用引物gc-NL1,5′-GCGGGCCGCGCGACCGCCGGGACGCGCGAGCCGGCGGCGCGG CGGGCCATATCAATAAGCGGAGGAAAAG-3′和引物LS2,5′-ATT CCC AAA CAA CTC GAC TC-3′[14]进行26S rDNA D1区扩增。50μL反应体系:PCR荧光染料(Dye)5μL,10×PCR buffer 5μL,DNTPs 1μL,上、下游引物各1μL,模版DNA 2μL,Taq酶0.5μL ,ddH2O 34.5μL。细菌扩增反应程序:95℃,5min;94℃,30s;56℃,30s;72℃,1min,30个循环;最终72℃,7min。真菌扩增反应程序:95℃,5min;95℃,60s;52℃,45s;72℃,60s,30个循环;最终72℃,7min。
1.2.5 变性梯度凝胶电泳(DGGE)分析 采用Bio-Rad DcodeTM,DGGE电泳仪对样品16S rDNA V3区扩增产物和26S rDNA D1区扩增产物进行电泳。使用8%聚丙烯酰胺凝胶,细菌和真菌均采用35%~55%[100%变性剂含有7mol/L 尿素和40%(v/v)甲酰胺]的变性梯度,在1×TAE电泳缓冲液中先200V预电泳5min,然后85V恒压电泳15h。GoldViewTM染色30min后放入凝胶成像仪内照相。
1.2.6 条带深浅分析 经凝胶成像仪照出的照片用Alpha view软件进行条带密度分析。该软件可以根据条带亮度、光密度值来判断表达量的高低,且条带亮度会以峰值表现出来,峰面积大小与表达量大小呈正比。
2 结果与分析
2.1 形态观察
对在12%全脂乳培养基中进行传代培养的微生物进行革兰氏染色,其镜鉴结果如图1:嗜热链球菌为兼性厌氧或微好氧的革兰氏阳性菌,以两个卵圆型为一对的球菌连成约0.7nm到0.9nm的长链。保加利亚乳杆菌属于兼性厌氧性革兰氏阳性菌,菌体长2~9μm,宽0.5~0.8μm,单个体呈长杆状或成链,两端钝圆,不具运动性,也不会产生孢子。马克斯克鲁维酵母是单细胞真核微生物,细胞的形态为椭圆形,比细菌的单细胞个体大,无鞭毛,不能游动,会产生孢子。
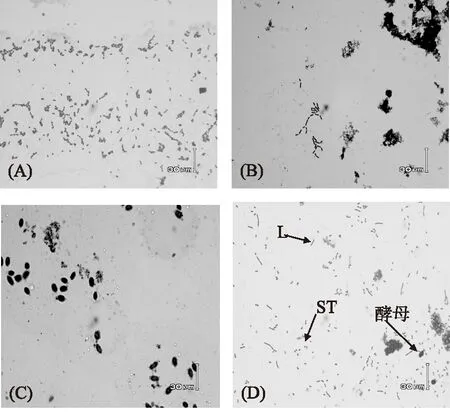
图1 混菌发酵乳中微生物光学显微镜图Fig.1 Microscoph of microbiological in fermented milk注:A:ST菌;B:LB菌;C:马克斯克鲁维酵母菌; D:混菌发酵中各菌形态。
2.2 PCR扩增结果
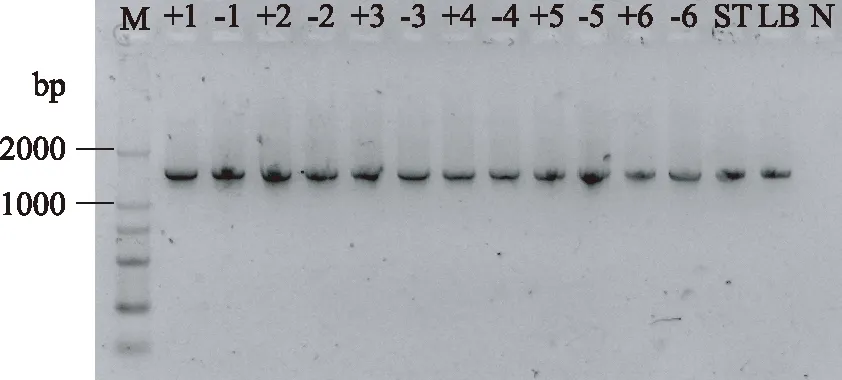
图2 发酵过程中细菌16S rDNA扩增产物电泳图Fig.2 Electrophoresis photo of PCR products of 16S rDNA during fermentation注:M代表Marker E;数字代表发酵时间(h); +代表含有马克斯克鲁维酵母;—代表不含 马克斯克鲁维酵母;ST代表纯嗜热链球菌; LB代表纯保加利亚乳杆菌;N代表阴性对照。
2.2.1 第一轮扩增结果 细菌16S rDNA全长扩增结果经1.5%琼脂糖凝胶电泳检测后(图2~图3),获得大小在1500bp左右的全长扩增片段,真菌26S rDNA D1/D2区扩增(图4)后获得大小在600bp左右的片段,均与所需要的片段大小相符合。从图中可以看出所有样品都有比较清晰的扩增条带,适合进行第二轮PCR扩增。
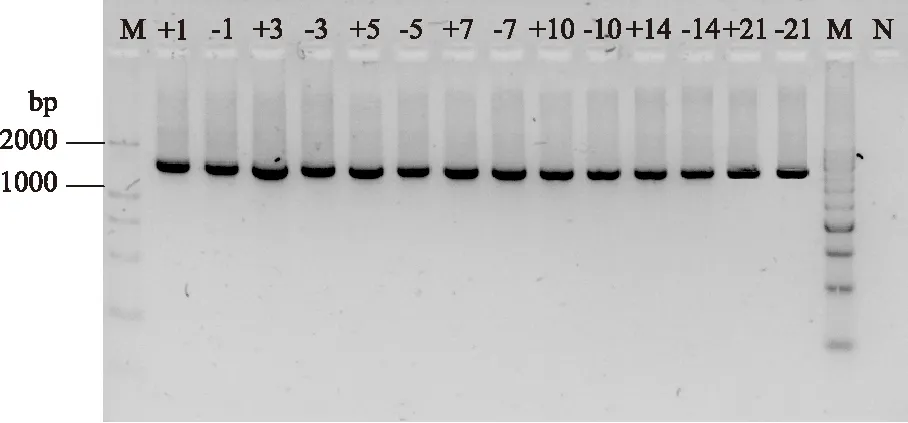
图3 贮藏过程中细菌16S rDNA扩增产物电泳图Fig.3 Electrophoresis photo of PCR products of 16S rDNA during storage注:M代表Marker E;数字代表贮藏时间(d); +代表含有马克斯克鲁维酵母; —代表不含马克斯克鲁维酵母;N代表阴性对照。

图4 发酵过程中酵母菌26S rDNA D1/D2 区扩增产物电泳图Fig.4 Electrophoresis photo of PCR products of 26S rDNA D1/D2 during fermentation注:M代表Marker E;数字代表发酵时间(h); +代表含有乳酸菌;—代表不含乳酸菌; N代表阴性对照。
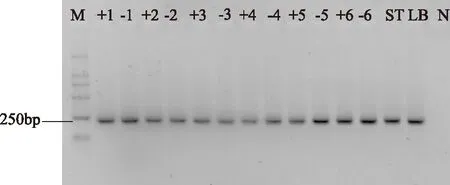
图5 发酵过程中细菌16S rDNA V3区扩增产物电泳图Fig.5 Electrophoresis photo of PCR products of 16S rDNA V3 during fermentation注:M代表Marker E;数字代表发酵时间(h); +代表含有马克斯克鲁维酵母;—代表不含 马克斯克鲁维酵母;ST代表纯嗜热链球菌; LB代表纯保加利亚乳杆菌;N代表阴性对照。
2.2.2 第二轮扩增结果 细菌16S rDNA V3可变区的PCR扩增结果经过1.5%琼脂糖凝胶电泳检测,图5、图6中显示各个样品均扩增出约为230bp的条带,真菌26S rDNA D1区扩增出的条带约为250bp,如图7,均符合预期扩增效果[14],而且条带亮度也较好,无非特异性条带出现,适用于DGGE分析。
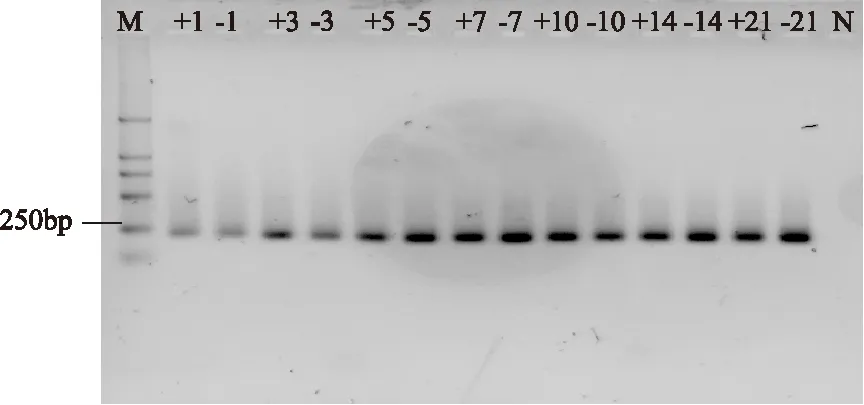
图6 贮藏过程中细菌16S rDNA V3区扩增产物电泳图Fig.6 Electrophoresis photo of PCR products of 16S rDNA V3 during storage注:M代表Marker E;数字代表贮藏时间(d); +代表含有马克斯克鲁维酵母;—代表不含 马克斯克鲁维酵母;N代表阴性对照。
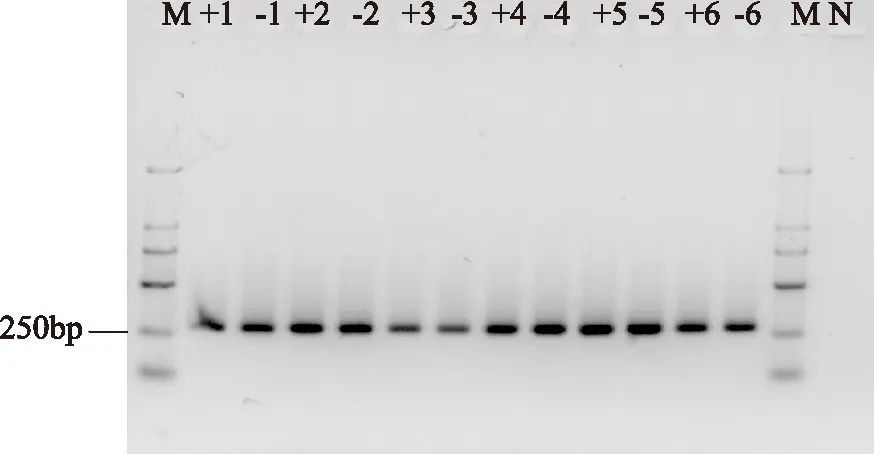
图7 发酵过程中酵母菌26S rDNA D1区扩增产物电泳图Fig.7 Electrophoresis photo of PCR products of 26S rDNA D1 during fermentation注:M代表Marker E;数字代表发酵时间(h); +代表含有乳酸菌;—代表不含 乳酸菌;N代表阴性对照。
2.3 PCR-DGGE结果分析
2.3.1 乳酸菌参考菌株 DGGE 图谱标准模型的建立 将嗜热链球菌单菌和保加利亚乳杆菌单菌分别提取DNA,经过2次PCR后得到的产物以15μL的上样量进行变性梯度凝胶电泳(DGGE)分离,获得标准模型如图8:由此标准模型可知样品中上方条带代表LB,下方条带代表ST。
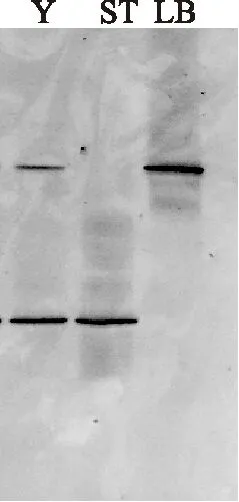
图8 参考菌株 DGGE 图谱标准模型Fig.8 DGGE profiles of PCR products of 16S rDNA V3 from reference strains as ladder注:Y代表样品。
2.3.2 发酵过程中马克斯克鲁维酵母对乳酸菌生长影响 将发酵过程中细菌16S rDNA V3可变区的PCR扩增产物以15μL的上样量进行DGGE分离,结果如图9所示。
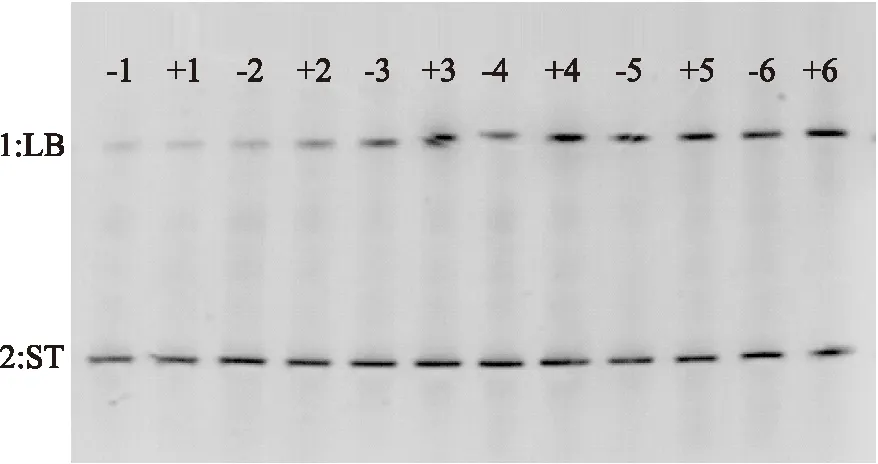
图9 发酵期间乳酸菌DGGE图谱Fig.9 DGGE analysis of lactobacillus during fermentation注:数字代表发酵时间(h);+代表含有 马克斯克鲁维酵母;—代表不含马克斯克鲁维酵母; 上方条带代表LB;下方条带代表ST。
从图中可以看出,整个发酵过程样品始终含有两条带,与混菌发酵初始只添加两种乳酸菌的事实相符合,说明该产品质量比较稳定。从表1中可以看出,随着发酵时间的延长两条带峰面积逐渐变大,说明发酵过程中两种菌都在分裂生长。整个发酵过程,两种发酵乳中,ST菌作为绝对优势菌其条带均较LB菌条带深,尤其在最初发酵2h内,该结果与Pette[15]等人研究结果相似,产生这种现象的原因是混菌发酵过程中乳酸菌生长分成两阶段:培养初期,由于在LB菌作用下游离出来的氨基酸的刺激作用,ST菌首先快速生长,ST菌的快速生长使乳中大量氧气被除去的同时积累了较多的乳酸,致使ST菌的生长变慢,而后耐酸性的LB菌受ST菌产生的各种成分的刺激,而大量增殖起来[15]。从表1、图9中均可看出,含有酵母菌条带的峰面积普遍较不含酵母菌条带的峰面积大且颜色深,说明马克斯克鲁维酵母对乳酸菌的生长起到促进作用。这种现象在LB菌上尤其明显,含酵母菌发酵乳中LB从2h开始条带变深,而不含酵母菌发酵乳从3h开始条带变深,说明酵母菌使LB提前进入对数生长期,即马克斯克鲁维酵母菌主要对乳酸菌中的LB起到促进作用。
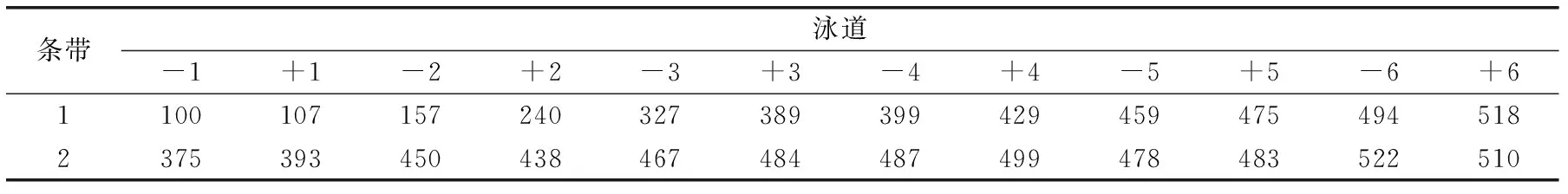
表1 发酵期间乳酸菌DGGE图谱条带峰面积Table 1 DGGE Band peak area of lactobacillus during fermentation

表2 发酵期间酵母菌DGGE图谱条带峰面积Table 2 DGGE Band peak area of Kluyveromyces marxianus during fermentation
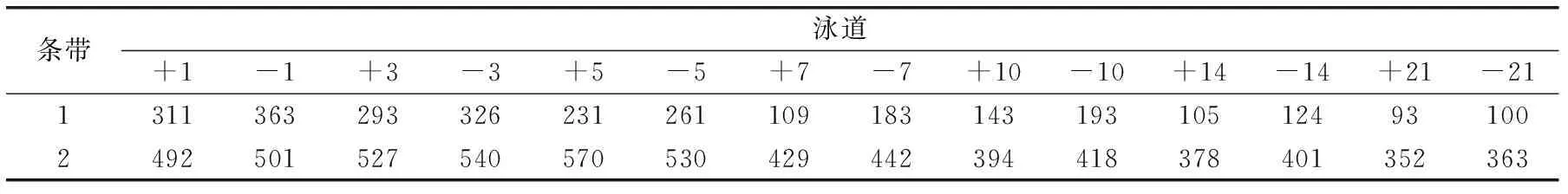
表3 贮藏期间乳酸菌DGGE图谱条带峰面积Table 3 DGGE Band peak area of lactobacillus during storage
2.3.3 发酵过程中乳酸菌对酵母菌生长的影响 将发酵过程中真菌26S rDNA D1区的PCR扩增产物以15μL的上样量进行DGGE分离,结果如图10所示。
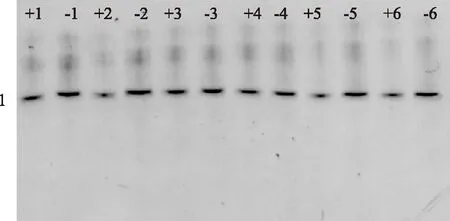
图10 发酵期间马克斯克鲁维酵母菌DGGE图谱Fig.10 DGGE analysis of Kluyveromyces marxianus during fermentation注:数字代表发酵时间(h);+代表含有乳酸菌; —代表不含乳酸菌;条带为马克斯克鲁维酵母。
从图10中可以看出,发酵过程中对于真菌只分离出一条带,这与混菌发酵乳中只加入一种酵母菌的事实相符。随着发酵时间的延长,同一组条带(+组各条带相比较或-组各条带比较)之间颜色深浅变化不显著,与表2结果相符,说明整个发酵过程中马克斯克鲁维酵母活菌数变化不大,该结果与田裕春[16]的研究结果相似。而含有乳酸菌的条带峰面积小于不含有乳酸菌的条带,说明乳酸菌在一定程度上会影响马克斯克鲁维酵母的生长。该现象可能是由于乳酸菌产生的化合物如苯乳酸、4-羟基-苯乳酸、环肽对酵母菌有抑制作用[17]。
2.3.4 贮藏期间马克斯克鲁维酵母对乳酸菌生长影响 将贮藏过程中细菌16S rDNA V3可变区的PCR扩增产物以15μL的上样量进行DGGE分离,结果如图11所示。

图11 贮藏期间乳酸菌DGGE图谱Fig.11 DGGE analysis of lactobacillus during storge注:数字代表贮藏时间(d);+代表含有马克斯克鲁维酵母; —代表不含马克斯克鲁维酵母; 上方条带代表LB;下方条带代表ST。
从图11中可以看出,随着贮藏时间的延长代表LB和ST菌的条带逐渐变浅变细,说明随着贮藏时间的延长微生物数量在不断减少。表3反映出,贮藏期间ST依然作为优势菌,含有酵母菌的发酵乳中ST的峰面积在前5d增加之后减小,较不含有酵母菌的发酵乳中ST峰面积下降延迟2d,说明马克斯克鲁维酵母的加入延缓ST的凋亡,而LB的峰面积从第1d起均开始减小,第7d之后显著下降。通过LB条带可知,含有马克斯克鲁维酵母菌的发酵乳条带浅且峰面积小,说明酵母菌对LB的作用由发酵期间的促进作用转变为抑制作用,可能的原因是马克斯克鲁维酵母是高产脂肪酶的酵母,会产生较多脂肪酸,贮藏期间过多脂肪酸堆积对乳酸菌产生了抑制作用[18]。整个贮藏过程中,DGGE条带依然只含有2条带,说明4℃条件下贮藏可以较好的抑制杂菌生长,有助于产品品质稳定。
3 结论
在欧洲、亚洲和非洲一些国家含酵母菌在内的天然微生物菌丛制作的发酵乳已广泛存在,如开菲尔乳、非洲自然发酵乳、马奶酒等[19]。随着微生物菌株生理生化特性研究的深入,利用菌株的优势互补和协同作用,由酵母菌参与的混菌发酵乳逐渐由家庭作坊式生产向工业化生产转变。而通过研究乳酸菌与酵母菌之间相互影响,可为深入探讨乳酸菌与酵母菌共同发酵机理及新型发酵乳制品的开发提供理论基础。
本文利用分子生物学手段PCR-DGGE技术检测混菌发酵及贮藏过程中菌群组成及优势菌群变化,结果发现发酵及贮藏过程中混菌发酵乳中的菌群组成十分稳定,嗜热链球菌始终为绝对优势菌;在发酵期间,马克斯克鲁维酵母菌的添加对乳酸菌的生长具有一定的促进作用,尤其是对保加利亚乳杆菌促进效果显著,使其提前进入对数生长期,而乳酸菌的存在会抑制马克斯克鲁维酵母的生长;贮藏期间马克斯克鲁维酵母对保加利亚乳杆菌的促进作用转变为抑制,但酵母菌的存在可以延迟嗜热链球菌的衰亡。
[1]Fleet G H. Yeasts in dairy products-A review[J]. Journal of Applied Microbiology,1990,68:199-211.
[2]I De Freitas,Pinon N,Maubois J L,et al. The addition of a cocktail of yeast species to cantalet cheese changes bacterial survival and enhances aroma compound eormation[J]. International Journal of Food Microbiology,2009,129:37-42.
[3]Gori K,Mortensen H D,Arneborg N,et al. Ammonia production and its possible role as a mediator of communication for debaryomyces hansenii and other cheese-relevant yeast species[J]. Journal of Dairy Science,2007,90:5032-5041.
[4]韩雪,雷朋.发酵乳制品中乳酸菌与酵母菌相互作用研究进展[J].食品工业科技,2014,35(7):388-390.
[5]贺银凤.传统发酵乳制品中乳酸菌和酵母菌的相互关系[J].中国乳品工业,2010,38(10):43-45.
[6]Khaljq A,Abbasi M K,Hussain T. Effects of integrated use of organic and inorganic nutrient sources with effective microorganisms(EM)on seed cotton yield in Pakistan[J]. Bioresource Technology,2006,97(8):967-972.
[7]Duthoit F,Godon J J,Montel M C. Bacterial community dynamics during production of registered designation of origin salers cheese as evaluated by 16S rRNA gene single-strand conformation polymorphism analysis[J]. Applied and Environmental Microbiology,2003,69(7):3840-3848.
[8]Franco L,Vladimir K,Camilla C,et al. Specific[J]. FEMS Microbiology Letters,1998,158:273-278.
[9]Amann R I,Ludwig W,Schleifer K H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J]. Microbiological Reviews,1995,59(1):
143-169.
[10]汪孟娟,熊顺强.PCR-DGGE监测豆豉制曲过程中菌群的动态变化[J].南昌大学学报:理科版,2010,34(6):572-574.
[11]Karita S,Nakayama K,Goto M,et al. A Novel Cellulolytic,Anaerobic,and Thermophilic Bacterium,Moorella sp strain F21[J]. Bioscience,Biotechnology and Biochemistry,2003,67(1):183-185.
[12]刘宁,刘延琳.核糖体RNA基因在酵母分类鉴定中的应用[J].中国农业科学,2010,43(22):22-23.
[13]唐玲,王晓静.运用PCR-DGGE技术分析原料乳中腐败细菌的多样性[J].贵州农业科学,2013,41(5):151-154.
[14]张春林.内蒙古传统发酵酸粥中微生物多性分析[D].呼和浩特:内蒙古农业大学,2010.
[15]Pette J W,Lolkema H. Yoghurt I synibioseen antiliose in mengcultures van Lactobacillus bulgaricus en Streptococcus thermophilus[J]. Netherlands Milk and Dairy Journal,1950,4:197-208.
[16]田玉春.酵母菌对传统乳制品中脂类代谢影响的研究[D].大连:大连工业大学,2013.
[17]Nielsen M S,Frisvad J C,Nielsen P V. Protection by Fungal Starters against Growth and Secondary Metabolite Production of Fungal Spoilers of Cheese[J]. International Journal of Food Microbiology,1998,42:91-99.
[18]Dennis P,Bayrock W. Michael Ingledew Inhibition of Yeasty by Lacteria in Continuous Culture:nutrient Depletion and/or Acid Toxicity[J]. Ind J Microbiology Biotechnology,2004,30:362-368.
[19]郭本恒.功能性乳制品[M].北京:中国轻工业出版社,2001:269-270.
《食品工业科技》扩增审稿专家的通知
首先感谢广大读者和作者对《食品工业科技》杂志的支持与帮助。
近年来《食品工业科技》杂志投稿量大幅增加,并且由于食品科学稿件覆盖面广,交叉学科多,现有审稿专家很难满足读者希望稿件及时审回的要求。为了进一步缩短审稿时间,及时发布稿件评审情况,本刊拟增加审稿专家,希望得到相关领域专业人士的支持。
审稿专家需同时符合以下基本条件:
1、 食品、生物、营养、化学、分析检测及相关专业。
2、 具有较高的专业英文水平。
3、 高级职称。
4、 以第一作者或通讯作者在中文核心期刊发表论文5篇以上。
5、 能及时将稿件审回。
请有意者提供真实姓名、出生年、职称、学历、单位、联系电话、电子信箱、详细通信地址及自己最擅长的研究方向,并列举五篇最能体现您学术水平的论文。
以上信息发送至food100419@163.com。
收到您提交的信息后,杂志社组织遴选,对入选的审稿专家,我们会给您发送采编平台专家审稿区的用户名和密码。编辑部会根据您的研究方向提交送审稿件,审稿方式为登陆我刊网站在线审稿。编辑部会定期按审稿数量和我刊审稿费标准邮寄审稿稿酬。
谢谢支持!
《食品工业科技》杂志社
Application of PCR-DGGE to analyze the interaction betweenKluyveromycesmarxianusand the lactic acid bacteria during fermentation and storage process
FAN Wei1,3,LI Lu2,3,+,JIANG Tie-min3,ZHANG Yu1,MIN Wei-hong2,CHEN Li-jun3,*
(1. College of Food Science ,Dalian Polytechnic University,Dalian 116034,China;2.College of Food Science and Engineering,Jilin Agricultural University,Changchun 130118,China;3. Beijing Sanyuan Foods Co. Ltd.,Beijing 100076,China)
Denaturing gradient gel electrophoresis(DGGE)technique were applied to analyze the interaction betweenKluyveromycesmarxianusand the lactic acid bacteria during fermentation and storage process for tracking and monitoring advantages microbial flora and microbial stability. The results showed that during mixed fermentation and storage process,microbial composition was relatively stable,Streptococcusthermophiluswas regarded as dominant flora. Mixed fermentation process,the growth of lactic acid bacteria were promoted by addingKluyveromycesmarxianus,especiallyLactobacillusbulgaricus, while the growth of lactic acid bacteria was inhibited in storage. The whole process,yeast growth was inhibited by lactic acid bacteria. This study provided a theoretical basis for further research on the mechanism of lactic acid bacteria and yeast fermentation and development of new fermented dairy products.
mixed fermentation;DGGE;flora analysis;KluyveromycesMarx
2014-08-19 +并列第一作者。
范维(1989-),女,在读硕士,研究方向:食品科学与工程。 李路(1987-),女,在读硕士,研究方向:发酵微生物的选育与代谢调控。
*通讯作者:陈历俊(1967-),男,博士,教授级高工,研究方向:乳品科学。
“十二五”科技支撑计划项目(2013BAD18B04);国家星火计划(2012GA600001)。
TS252.1
A
1002-0306(2015)11-0147-06
10.13386/j.issn1002-0306.2015.11.021
