组织培养结合秋水仙素诱导南瓜多倍体
2015-04-29闵子扬童龙杨红波李涵成娟张琼谢向阳孙小武
闵子扬 童龙 杨红波 李涵 成娟 张琼 谢向阳 孙小武
摘 要: 以‘红栗2号南瓜子叶为外植体,探讨外植体消毒时间、激素组合和培养基中秋水仙素浓度对芽诱导率的影响,对所得植株的倍性进行鉴定。结果表明:外植体在3%(w) NaClO溶液中消毒15 min,污染率为0且外植体活力较高;MS+6-BA 3.0 mg·L-1+NAA 0.1 mg·L-1+秋水仙素40 mg·L-1是诱导‘红栗2号南瓜产生四倍体的最适培养基,诱导率达到25.71%;组培苗形态及根尖染色体有四倍体存在。
关键词: 南瓜; ‘红栗2号; 组织培养; 秋水仙素; 诱导; 四倍体
Study on polyploid induction of pumpkin by tissue culture combined with colchicines
MIN Ziyang1, TONG Long1, YANG Hongbo1,2, LI Han1,CHENG Juan1, ZHANG Qiong1,2, XIE Xiangyang2, SUN Xiaowu1,2
(1. Hunan Agricultural University, Changsha, 410128, China; 2. Hunan Province Melon Research Institute, Shaoyang, 422001, China)
Abstract:The cotyledon of pumpkin-‘Hongli 2is used as explant to study the influence of disinfect time,hormone combination and different concentrations of colchicine of medium on bud induction rate. The ploidy of regenerated plant is also identified .The results showed that the explants disinfect in 3% Naclo solution for 15 min,the pollution rate can be reduced to zero and the explants showed higher activity. MS+6-BA 3.0 mg/L+NAA 0.1 mg/L+colchicine 40 mg/L was the optimal medium to induce ‘Hongli 2to generate tetraploid. The bud induction rate was up to 25.71%. The observation of somaclone form and root tip chromosomes showed the existence of tetraploid.
Key words: Pumpkin; ‘Hongli No. 2; Tissue culture; Colchicine; Induction; Tetraploid
南瓜是葫芦科(Cucurbitaceae)南瓜属(Cucurbita)中的一年生草本植物,起源于中、南美洲,栽培种及野生近缘种共有 30 个,其中有5个南瓜栽培种,而在我国栽培的主要有 3 个:南瓜(Cucurbita moschata Dvch.)又名中国南瓜、笋瓜(C. maxima D.)又名印度南瓜、西葫芦(C. pepo L.)又名美洲南瓜。南瓜栽培历史悠久,适应性强,种植面积大,具有世界性蔬菜的美称,不仅产量高、耐贮藏,而且南瓜营养价值十分丰富,富含胡萝卜素、戊聚糖、果胶、甘露醇、葫芦巴碱、腺嘌岭、矿质元素等多种营养成分,其中所含的一些药用成分对多种疾病均有疗效,尤其是南瓜多糖,是预防糖尿病的活性成分,受到国内外的关注[1-2]。然而,我国南瓜的优良品种类型少,品种更新换代慢,并且随着近年来生产面积的不断扩大,规模化种植和连作障碍,南瓜病害有逐年加重的趋势,尤其是针对南瓜的主要病害如疫病、白粉病、病毒病等的抗病性研究严重滞后于生产。
与正常倍性植株相比多倍体植株一般表现出营养物质更加丰富,贮运性更好并且具有较强的抗病性和抗逆性等特点,所以越来越受到育种工作者的关注。利用组织培养与秋水仙素相结合获得四倍体植株是多倍体育种的一个重要途径,这已经在西瓜[3]和甜瓜[4]等瓜类作物的多倍体育种中得到了应用,但是在南瓜上的相关报道还比较少。本文通过对组织培养和秋水仙素相结合的方法诱导南瓜四倍体的研究,为南瓜新品种的选育提供理论依据和实践指导。
1 材料与方法
1.1 试验材料
试验材料为‘红栗2号南瓜种子,由湖南省瓜类研究所提供。
1.2 试验方法
1.2.1 无菌苗的获得 选取籽粒饱满、大小均匀一致的‘红栗2号南瓜种子,剥去种壳,在25 ℃ 的恒温水中浸种5~6 h。在超净工作台上用75%(φ) 的酒精表面消毒30 s后用无菌水冲洗3遍,然后置于3%(w)的NaClO溶液中分别消毒9、12、15、18 min以观察不同消毒时间对无菌苗萌发的影响,消毒期间要不停摇动,然后用无菌水冲洗5~6次,将消毒过的种子放在无菌滤纸上吸干表面的水分后接种到不添加任何激素的MS培养基上进行暗培养,待种子发芽后转入光下培养,光照周期为16 h·d-1,光强2 500 lx,整个培养期间一直处于(25±1)℃ 的温度条件下。试验中每处理接种3瓶,每瓶接种6个外植体,重复3次。
1.2.2 外植体的切取和不同激素组合对芽诱导的影响 以‘红栗2号南瓜刚转绿2 d的子叶为外植体,在取用子叶时,去掉子叶边缘部分后将剩下的横切为二,再取其近叶柄端[5]纵切为二,每片子叶得到2块约3 mm×5 mm的外植体。将从子叶上切取的外植体正面朝上接种到添加不同质量浓度的6-BA(2.0、3.0、4.0 mg·L-1)和NAA(0.1、0.2 mg·L-1)激素组合的MS培养基中进行芽诱导培养。培养条件为光照16 h·d-1,光强2 500 lx、温度(25±1)℃,25 d后观察统计不同激素浓度组合对芽诱导率的影响。试验中每种激素组合接种3瓶,每瓶接种4个外植体,重复3次。
1.2.3 培养基中秋水仙素浓度对‘红栗2号四倍体诱导效果的影响 在1.2.2中筛选的最适南瓜芽诱导培养基的基础上,将切取的外植体分别接种在添加不同浓度秋水仙素的芽诱导培养基上,秋水仙素质量浓度分别为20、30、40、50、60、70 mg·L-1,同时以未添加秋水仙素的最适芽诱导培养基为对照,培养条件为光照16 h·d-1,光强2 500 lx、温度(25±1℃),25 d后观察统计不同秋水仙素浓度对芽诱导率及成活率的影响。试验中每个处理接种3瓶,每瓶接种4个外植体,重复3次。
1.2.4 不定芽的生根培养 参照任桂红、林荣[6]的方法,将长至2 cm左右的不定芽转接到MS+NAA 1.0 mg·L-1的培养基中诱导不定芽生根以形成完整植株。
1.2.5 多倍体植株的鉴定 (1)形态学鉴定:对所得植株外观进行观察,并且与正常植株相比较,观察指标包括植株高度、茎粗度、叶片大小、叶片厚度、叶片颜色。(2)根尖染色体计数鉴定:在陈解放[7]的关于南瓜根尖染色体计数方法的基础上稍作改进,将解离时间调整为10 min,卡宝品红染色液染色时间增加到15 min,其他不变,以此来观察所得植株根尖的染色体倍性组成。
2 结果与分析
2.1 消毒时间对种子萌发的影响
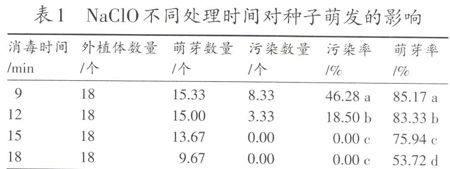
在组织培养的过程中,外植体的消毒是最基础也是最重要的步骤,消毒情况的好坏严重影响着试验的进程,所以获得污染率较低且活力较高的外植体是至关重要的。本试验中先用75% 的酒精处理30 s然后用3% 的NaClO溶液处理不同的时间,其对种子萌发的影响见表1。
表1 NaClO不同处理时间对种子萌发的影响
[消毒时间
/min\&外植体数量
/个\&萌芽数量
/个\&污染数量
/个\&污染率
/%\&萌芽率
/%\&9
12
15
18\&18
18
18
18\&15.33
15.00
13.67
9.67\&8.33
3.33
0.00
0.00\&46.28 a
18.50 b
0.00 c
0.00 c\&85.17 a
83.33 b
75.94 c
53.72 d\&]
[注] 不同小写字母表示在P<0.05水平上差异显著。后表同。
从表1可以看出:消毒效果与消毒时间的长短有密切关系,当消毒时间只有9 min的时候污染率达到46.28%,随着消毒时间的延长,消毒效果逐渐增强,当消毒时间达到15 min的时候污染率为0。但是,随着消毒时间的增加NaClO对种子的毒害作用越来越强,当消毒时间为18 min的时候种子的萌芽率只有53.72%。从表中可以看出消毒时间18 min与消毒15 min相比污染率都为0,但种子萌芽率降低了22.22百分点,所以消毒15 min是较适宜的处理时间。在试验中还发现,随着消毒时间的延长不但外植体的萌芽率降低,而且萌芽的外植体畸形率也随之提高,具体表现为下胚轴不伸长或稍微伸长,子叶扭曲或子叶呈白化状无法转绿。
2.2 不同激素组合对芽诱导率的影响
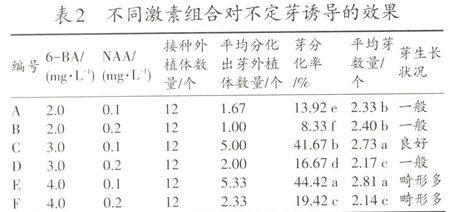
外源激素是诱导子叶产生不定芽所必需的物质,不同激素配比决定着芽诱导率的高低。本试验中不同激素配比对不定芽诱导的效果见表2。
从表2可以看出,当NAA浓度一定时随着6-BA浓度的增加,芽分化率逐渐提高,最高可达到44.42%;当6-BA浓度一定时随着NAA浓度极小幅度的增加,芽分化率急剧下降,说明低浓度的NAA能有效地诱导芽的分化而高浓度的NAA却抑制芽的分化。当NAA浓度为0.1 mg·L-1,6-BA浓度为3.0 mg·L-1或4.0 mg·L-1的时芽诱导率没有明显差异,但是在3.0 mg·L-1时诱导出的芽生长状况良好(图版—a),而在4.0 mg·L-1的时诱导出的芽有较多畸形芽存在(图版—b)。综合评价认为MS+6-BA 3.0 mg·L-1+NAA 0.1 mg·L-1是诱导南瓜子叶形成不定芽的最适培养基。
2.3 培养基中秋水仙素浓度对‘红栗2号四倍体的诱导效果
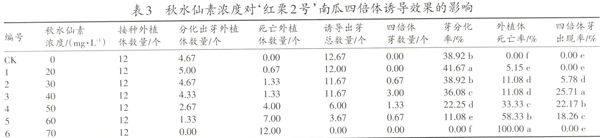
在正常的诱导培养基中加入适宜浓度的秋水仙素来诱导四倍体芽(包埋法)能显著提高四倍体的诱导率,这已经在其他种类的瓜类作物上得到了验证,本试验在他人的研究成果上采用“包埋法”对‘红栗2号南瓜子叶进行了四倍体诱导,具体情况见表3。
由表3可知:随着秋水仙素浓度的提高,死亡外植体数目逐渐增加,当秋水仙素达到70 mg·L-1时外植体全部死亡;在低浓度秋水仙素(0~40 mg·L-1)条件下芽分化率差别不大,但是当其浓度大于40 mg·L-1时秋水仙素对外植体的毒害作用明显加强导致芽诱导率急剧下降;四倍体芽的出现率跟秋水仙素的浓度密切相关,在低浓度下出现率为0,在适宜的浓度范围内随着秋水仙素浓度的提高四倍体芽的出现率也随之提高,在40 mg·L-1时达到最大值25.71%,但是超过适宜浓度以后秋水仙素对生长的抑制作用明显加强,导致四倍体诱导率降低。综上所述认为MS+6-BA 3.0 mg·L-1+NAA 0.1 mg·L-1+秋水仙素40 mg·L-1是诱导‘红栗2号南瓜产生四倍体的最适培养基(图版—c)。
2.4 不定芽的生根效果
将长至2 cm左右的不定芽转接到MS+NAA 1.0 mg·L-1的培养基上,很容易诱导不定芽生根以形成完整植株,在诱导生根培养基中15 d以后生根率达到98%(图版—d)。
2.5 植株的倍性鉴定
2.5.1 形态学鉴定 在植株形成以后对其外部形态进行观察以大致了解其倍性构成情况,对比正常二倍体组培苗(图版—e)观察发现有一些植株高度较高,茎明显增粗,叶片稍微变小,叶片厚度增加,表现出四倍体植株的形态特征(图版—f)。
2.5.2 根尖染色体计数 分别取正常二倍体组培苗根尖和表现出四倍体形态特征的组培苗根尖进行染色体计数,结果表明,表现出四倍体形态特征的组培苗染色体数目大于44条(图版—g),而正常二倍体植株染色体数目为44(2n=2x=44)条(图版—h)。试验过程中诱导得到了组培苗(图版—i)。
3 讨论与结论
外植体消毒完成以后表面会残留一些水分,试验过程中发现如果不用无菌滤纸吸干表面的水分而是直接进行无菌苗的诱导,污染率将大幅上升,吸干表面水分以后接种就可以得到有效的改善,这可能是因为外植体表面有大量水分存在的情况下,微生物更容易繁殖。
试验过程中发现,经诱导培养基诱导出的丛生芽在后续发育的过程中不易伸长生长,表现出老小苗现象,将丛生芽切成单芽转接培养后单芽容易死亡,这可能是由于芽体内激素水平不平衡的缘故。
秋水仙素有剧毒,在组织培养的过程中对外植体有毒害作用,明显抑制不定芽的分化甚至导致外植体死亡,这与郑永强、徐坤的结论相同[8]。另一方面,秋水仙素在诱导四倍体植株产生的过程中又是必不可少的能显著提高诱变率,后面可以进一步研究有没有物质能够在不影响秋水仙素诱导效果的前提下降低其毒害作用或寻找秋水仙素的替代诱变剂,这对以“混培法”来诱导多倍体的产生至关重要。
南瓜根尖染色体数目较多,形态较小,压片时不易分散,并且组培苗的根大多部分木质化不易解离所以观察起来费时费力,后面试验的过程中要进一步研究多倍体植株的形态跟倍性之间的关系,争取在植株生长前期就可以大致确定植株的倍性构成情况,这对后续的工作具有指导意义。
‘红栗2号南瓜以子叶为外植体在秋水仙素存在的情况下通过组织培养的方式诱导四倍体植株的产生具体步骤如下:选取籽粒饱满、大小均匀一致的‘红栗2号南瓜种子,剥去种壳,在25 ℃ 的恒温水中浸种5~6 h后在超净工作台上用75%(φ)的酒精表面消毒30 s然后置于3%(W)的NaClO溶液中消毒15 min,无菌滤纸吸干表面水分后接种到不添加任何激素的MS培养基中,暗培养4 d后光照培养,子叶转绿后切取近叶柄端转接到MS+6-BA 3.0 mg·L-1+NAA 0.1 mg·L-1+秋水仙素40 mg·L-1的培养基上诱导芽的形成,待芽长至2 cm左右后转接到MS+NAA 1.0 mg·L-1的培养基上诱导生根,最后对诱导出的植株进行形态学和细胞学鉴定,以确定是否为四倍体植株。
参考文献
[1] 陈智民,王修梅. 南瓜粉降血糖、降血压作用的人体研究[J]. 江西中医药,1994,25(2): 50.
[2] 熊学敏,叶士玲. 南瓜多糖对四氧嘧啶糖尿大鼠的降糖果作用[J]. 江西中医学院学报,1998,10(4): 174-175.
[3] Compton M E,Gray D J. Shoot organogenesis and plant regeneration from Cotyledons of diploid,triploid and tetraploid watermelon[J]. Journal of the American Society for Horticultural Science,1993,118(1):151-157.
[4] Ezura H, Amagai H,Yoshioka K,et al . Efficient production of tetraploid melon(Cucumis melo L.)by somatic embryogenesis[J]. Japanese Journal of Breeding,1992,42(1): 137-144.
[5] 赵建萍,艾西丝. 南瓜子叶的离体培养[J]. 园艺学报,1999,26(3):196-197.
[6] 任桂红,林 荣. 南瓜子叶再生体系的建立[J]. 北方园艺,2010(23): 133-135.
[7] 陈解放. 南瓜未受精胚珠离体培养体系的优化[D]. 郑州:河南农业大学,2010.
[8] 郑永强,徐 坤. 秋水仙素在植物体细胞染色体加倍中的应用研究进展[J]. 中国农学通报,2003,19(5): 89-91.
