分枝杆菌噬菌体CJAUS5株holin基因的克隆与序列分析
2015-04-26蒋依倩齐宇刘文贤姜秀云高云航徐凤宇
蒋依倩齐 宇刘文贤姜秀云高云航徐凤宇∗
(1.吉林农业大学动物科技学院,长春130118;2.吉林农业大学动物生产及产品质量安全教育部重点实验室,长春130118;3.吉林农业大学生命科学院,长春130118)
分枝杆菌噬菌体CJAUS5株holin基因的克隆与序列分析
蒋依倩1,2,齐 宇1,刘文贤1,2,姜秀云1,3,高云航1,2,徐凤宇1,2∗
(1.吉林农业大学动物科技学院,长春130118;2.吉林农业大学动物生产及产品质量安全教育部重点实验室,长春130118;3.吉林农业大学生命科学院,长春130118)
为了研究噬菌体裂解宿主菌的机制,开发噬菌体裂解相关蛋白的应用价值,试验参照GenBank中登录的holin基因序列设计特异性引物,以分枝杆菌噬菌体CJAUS5基因组为模板,经PCR扩增出411 bp的条带。构建重组质粒pMD19-T-holin,经双酶切鉴定呈阳性后进行测序分析。结果显示,克隆出的holin基因与已知分枝杆菌肌尾噬菌体holin序列同源性高达99.03%~99.51%;编码的氨基酸同源性高达99%~100%。对holin基因编码的蛋白进行分析表明,Holin蛋白具有亲水性C端和两个跨膜区域。研究成功克隆了分枝杆菌噬菌体CJAUS5的holin基因并进行了氨基酸序列分析,为进一步研究Holin蛋白的生物学特性及功能奠定了基础。
分枝杆菌;噬菌体;holin;基因克隆;序列分析
Key words:mycobacterium;bacteriophage;holin;gene cloning;sequence analysis
分枝杆菌包括结核分枝杆菌、非结核分枝杆菌和麻风分枝杆菌三大菌群,目前发现的已有150多个种,其中一些种可引起多种动物及人类疾病,包括结核病、麻风病以及副结核病等,给畜牧业带来巨大经济损失的同时还严重威胁着人类健康。随着全球性细菌耐药问题的出现,耐药结核分枝杆菌的数量不断增多,尤其多药耐药结核病(MDR-TB)和超级耐药结核病(XDR-TB)的出现使得对新型抗结核药物的需求更加迫切[1]。
噬菌体是一种能特异性感染细菌、在宿主体内进行复制和繁殖的病毒,是地球上最丰富的物种[2],几乎有细菌生存的环境就存在有相应的噬菌体[3]。噬菌体可以通过在感染周期末编码合成细胞壁水解酶(lysins)来裂解宿主菌释放子代噬菌体[4]。噬菌体裂解酶作为一种新型杀菌制剂,与抗生素相比,它具有使用剂量小,特异性强等优点[5]。然而,噬菌体裂解宿主不仅需要裂解酶还需要另一种蛋白—穿孔素(Holin)。Holin蛋白是噬菌体基因编码的小分子膜蛋白,可以在宿主菌细胞膜上形成跨膜孔,这个“孔洞”是噬菌体裂解酶穿过细胞膜到达细胞壁破坏肽聚糖的通道[6]。Holin蛋白不仅是构成跨膜孔的重要元件,还是触发细菌裂解的“分子定时器”,在噬菌体的裂菌过程中扮演着关键角色[7]。
本研究以分枝杆菌噬菌体CJAUS5基因组为模板,克隆了holin基因,并进行了序列分析,为进一步研究Holin蛋白的生物学特性、功能及探讨其潜在的应用价值奠定了基础。
1 材料与方法
1.1 菌株和质粒 噬菌体CJAUS5由本实验室分离鉴定并保存;E.coliDH5α感受态细胞(由本实验室制备并保存);克隆载体pMD19-T(购于大连宝生物工程有限公司)。
1.2 试剂 限制性核酸内切酶(BamHI、EcoRI)、ExTaq DNA聚合酶、T4DNA连接酶(大连宝生物工程有限公司);Tris、EDTA(BBI公司);氨苄青霉素、琼脂(北京鼎国生物工程公司);7H9液体培养基(BD医疗器械有限公司);质粒小提试剂盒(北京索莱宝科技有限公司);凝胶回收试剂盒(杭州维特洁生化技术有限公司)。
1.3 方法
1.3.1 引物设计与合成 根据GenBank中登录的分枝杆菌肌尾噬菌体Ava3(GenBank:JQ911768.1)和Drazdys(GenBank:JF704116.1)的holin基因序列设计引物,送生工生物工程(上海)有限公司合成,引物序列如下:上游P1:5’-GCAGGATCCAT⁃GAAGTACTCACCCGC-3’,划线部分为BamH I酶切位点;下游P2:5’-CGGAATTCTCATCGCTTCAA⁃ CACGGA-3’,划线部分为EcoR I酶切位点。
1.3.2 PCR反应体系和反应条件 反应体系:CJAUS5噬菌体基因组模板DNA2.0 μL,上、下游引物各0.5 μL,2.5 mmol/L dNTP2.0 μL,ExTaq酶0.3 μL,10×ExTaq buffer 2.5 μL,ddH2O17.2 μL,总体积25 μL。反应条件:94℃预变性10 min,95℃变35 s,64℃退45 s,72℃延40 s,30个循环,72℃再延伸10 min。扩增产物用1.0%琼脂糖凝胶电泳检测,回收目的条带。
1.3.3 PCR产物的克隆与鉴定 按凝胶回收试剂盒说明书回收纯化PCR产物,将其与pMD19-T载体连接,再将连接产物转化至E.coliDH5α感受态细胞中,按索莱宝质粒小提试剂盒说明书提取质粒后,经PCR、双酶切鉴定重组质粒pMD19-T-holin的正确性。
1.3.4Holin基因的测序与分析 将鉴定正确的阳性重组克隆质粒pMD19-T-holin送至生工生物工程(上海)有限公司测序。测序结果应用BLAST软件与GenBank中同源性较高的毒株相应序列进行比对及相关功能分析;利用DNAStar中MegAlign功能建立系统发育树,分析序列之间的同源性;运用DNAStar软件对Holin蛋白进行蛋白特性预测;运用在线分析程序ProtScale分析Holin蛋白的亲疏水性;运用在线工具TMHMM Server 2.0分析Holin蛋白的跨膜区;利用蛋白质三级结构在线预测工具I-TASSER预测Holin蛋白可能形成的三级结构。
2 结果与分析
2.1holin基因的扩增 以分枝杆菌噬holin菌体CJAUS5基因组DNA为模板,以P1和P2为引物进行PCR扩增,经1.0%琼脂糖凝胶电泳检测,可见1条约400 bp左右的DNA片断(图1),与试验预期的目的DNA片断大小相一致。
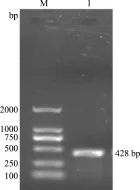
图1 CJAUS5的holin基因PCR扩增结果
2.2 扩增产物的克隆与双酶切鉴定 PCR扩增产物用试剂盒纯化后,与pMD19-T载体连接,转化至E.coliDH5α,少量提取质粒用EcoR I和BamH I进行双酶切鉴定。电泳结果表明,重组质粒分别被酶切成两条带,一条约为2700 bp,与pMD19-T空载体大小吻合,另一条约400 bp左右,与holin基因扩增片段大小一致(图 2)。说明克隆载体pMD19-T-holin构建成功。
2.3holin基因的序列测定与同源性分析 测序结果表明,去除酶切位点和保护碱基后,分枝杆菌噬菌体CJAUS5的holin基因大小为411 bp,可编码136个氨基酸。用BLAST软件对测序结果进行同源性分析发现,所得序列与GenBank中已知分枝杆菌肌尾噬菌体holin序列相似性高达 99.03%~99.51%,编码的氨基酸序列同源性高达 99%~100%,其中 MBP-Ghost(GenBank:JF704096.1)、MBP-Nappy(GenBank:JN699627.1)、MBP-Drazdys(GenBank:JF704116.1、MBP-ArcherS7(GenBank:KC748970.1)的holin基因与 CJAUS5噬菌体的holin基因同源性最高,达99.51%。运用MegAlign软件构建系统发育树(图3)发现,CJAUS5的holin基因与大多数分支杆菌肌尾噬菌体的holin基因处于同一分支,说明CJAUS5的holin基因与它们亲缘关系较近。

图2 阳性重组质粒pMD19-T-holin的双酶切鉴定结果
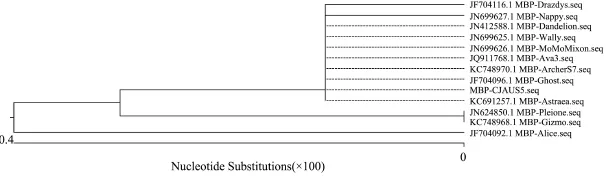
图3 CJAUS5的holin系统进化树
2.4 Holin的蛋白的特性预测 应用DNAStar软件的protean功能对CJAUS5的holin基因编码的蛋白进行蛋白特性预测,结果表明:Holin蛋白相对分子质量为13802.07,等电点为5.77;整个蛋白中酸性氨基酸出现的频率为8.09%,碱性氨基酸出现的频率为7.35%,极性氨基酸出现的频率为18.38%,疏水氨基酸出现的频率为50.74%,蛋白在pH=7.00时带 0.92个单位的负电荷;其二级结构中(Gmier分析方法)α-螺旋占37.50%,β-折叠占58.10%,转角和无规则卷曲占5.15%(图4)。
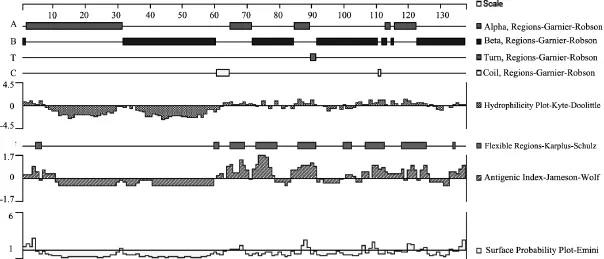
图4 CJAUS5-Holin蛋白特性预测
2.5 CJAUS5-Holin蛋白的亲疏水性分析 运用在线分析程序ProtScale分析Holin蛋白的亲疏水性,结果发现该蛋白大约在11~26、40~58位氨基酸之间含有典型的疏水性区域(图5)。

图5 CJAUS5-Holin蛋白亲疏水性分析
2.6 CJAUS5-Holin的跨膜区分析 Holin蛋白根据其拓扑异构学的不同可划分为三类,最大的两类是第I类和第Ⅱ类,其中第I类有3个跨膜结构域(transmembrance domain,TMD);第Ⅱ类有 2个TMD。第I类和第Ⅱ类众多不相关基因家族中,有一种基因家族的T4穿孔素gpt和与它有亲缘关系的T-偶数噬菌体的相关穿孔素被归为第Ⅲ类,它们只有1个TMD[8]。运用在线网络工具分析TM⁃HMM Server 2.0分析Holin蛋白的跨膜区,结果显示Holin蛋白的1~6、59~136位氨基酸处于胞内部分,27~35位氨基酸处于胞外部分,7~26、36~58位氨基酸之间形成了两个典型的跨膜螺旋区(图6),说明分枝杆菌噬菌体CJAUS5的Holin蛋白属于第Ⅱ类。
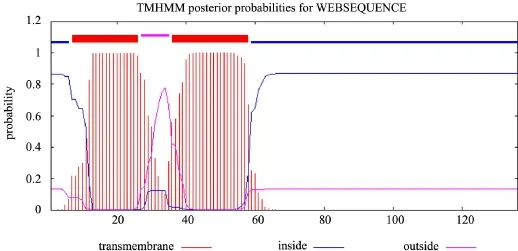
图6 CJAUS5-Holin跨膜区域分析
2.7 CJAUS5-Holin的三级结构预测 利用蛋白质三级结构在线预测工具I-TASSER对CJAUS5噬菌体Holin蛋白进行三级结构的可能性预测,结果见下(图7)。
2.8 CJAUS5-holin的核苷酸保守区域分析 应用NCBI中的BLAST工具对CJAUS5噬菌体holin的核苷酸序列进行保守区域分析,结果显示CJAUS5的holin核苷酸序列含有 PRP38_assoc超家族pfam06495保守区域,该区域为植物和后生动物前体mRNA剪接因子38相关的C端亲水性区域。

图7 CJAUS5-Holin三级结构预测
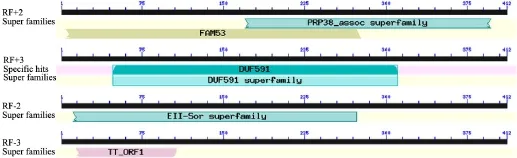
图8 CJAUS5-holin保守区域分析
3 讨论
研究成功克隆了分枝杆菌噬菌体CJAUS5的holin基因,通过BLAST比对软件发现它与GenBank中其它分枝杆菌肌尾噬菌体相关基因的核苷酸及氨基酸序列同源性很高,说明该基因序列非常保守;系统进化分析表明CJAUS5-holin与大多数肌尾噬菌体的holin基因处于同一分支,这说明CJAUS5的holin基因与它们有较近的亲缘关系;对Holin蛋白进行亲疏水性,发现该蛋白大约在11~26、40~58位氨基酸之间含有典型的疏水性区域;跨膜区分析结果显示,Holin蛋白1~6、59~136位氨基酸处于胞内部分,7~26、36~58位氨基酸之间形成了两个典型的跨膜螺旋区,结合其疏水性区域走向,可以看出CJAUS5-Holin蛋白为跨膜蛋白;核苷酸序列保守区域分析结果发现,CJAUS5-Holin核苷酸序列含有植物和后生动物前体mRNA剪接因子38相关的C端亲水性区域(PRP38_assoc超家族),其走向与 Holin蛋白的胞内部分吻合。由此可以说明CJAUS5-Holin蛋白是一个具有保守的亲水性C端和两个跨膜区域的膜蛋白,属于第Ⅱ类Holin蛋白。这一结果与已知的分枝杆菌噬菌体Ms6-Holin样蛋白的分析结果一致[9]。
双链DNA噬菌体普遍采用穿孔素-裂解酶模式(holin-lysin system)降解细菌细胞壁,释放出子代噬菌体。其中能为裂解酶穿过细胞膜到达细胞壁提供“通道”的跨膜蛋白Holin具有非常重要的作用。与传统意义上的跨膜蛋白不同,Holin蛋白是由宿主体内的噬菌体基因编码而成的,噬菌体装配阶段,Holin蛋白分子在宿主细胞膜上积聚并且这一过程不会对宿主造成可察觉的影响,然后在一个特定时间,形成它们的一级结构,从而引发宿主细胞膜局部破裂[10]。许多噬菌体在编码Holin蛋白的同时,还编码一个antiholin蛋白,它可以通过抑制Holin蛋白的作用来控制细菌裂解的时间。有时antiholin由具有数个氨基酸延伸形成的双启动N端的holin基因编码,或者由另一个起始密码子翻译表达[11],有时由一个独立基因编码[12]。
近年来,关于分枝杆菌噬菌体的研究发展迅速。截止目前共有5846株分枝杆菌噬菌体登录在相应网站上,其中有800株进行了全基因测序,登录到GenBank的有428株,而这些噬菌体中39.94%是2013年以来发现的,说明本领域的研究日益受到人们的重视。我国也有研究者从事该方面工作,但对holin基因的具体研究在国内尚未见报道[13]。本研究克隆的分枝杆菌噬菌体holin基因及其基因序列编码的蛋白分析,为进一步研究分枝杆菌噬菌体裂解宿主的机制奠定了基础。
[1]Teng T,Liu J,Wei H.Anti-mycobacterial peptides:from human to phage[J].Cell Physiol Biochem,2015,35(2):452-466.
[2]Keen E C.A century of phage research:Bacteriophages and the shaping of modern biology[J].Wiley Periodicals,2014,37:6-9.
[3]Hugo Oliveira,Luís D R M,Sílvio B S,et al.Molecular Aspects and Comparative Genomics of Bacteriophage Endolysins[J].Journal of Virology,2013,8(87):4558-4570.
[4]Yang H,Yu J,Wei H.Engineered bacteriophage lysins as novel anti-infectives[J].Frontiers in Microbiology,2014,5(542):1-6.
[5]苏胜兵,姜秀云,马红霞,等.分枝杆菌噬菌体CJAUS9LysB基因的克隆与序列分析[J].中国兽药杂志,2013,47(7):1-4.
[6]Maria Joao Catalao,Filipa Gil,Jose Moniz-Pereira,et al.Diversity in bacterial lysis systems:bacteriophages show the way[J].FEMS Microbiol Reviews,2013,(37):554-571.
[7]史一博,孙建和.λ噬菌体穿孔素(Holin)蛋白触发裂菌的分子机制[J].微生物学报,2012,52(2):141-145.
[8]Loeffler J M,Nelson D,Fischetti V A.Rapid killing of streptococcus pneumoniae with a bacteriophage cell wall hydrolase[J].Science 2001,294:2170-2172.
[9]Catalão Maria JoãoGil Filipa,Moniz-Pereira José,Pimentel Madalena.Functional analysis of theholin-like proteins of mycobacteriophage Ms6[J].Journal of bacteriology,2011,193(11):2793-2803.
[10]Angelika Gründling,Michael D Manson,Ry Young.Holins kill without warning[J].Proceedings of the National Academy of Sci⁃ences of the United States of America,2001,98(16):9348-9352.
[11]Vukov Natasa,Moll Isabella,Bläsi Udo,et al.Functional regula⁃tion of the Listeria monocytogenes bacteriophage A 118 holin by an intragenic inhibitor lacking the first transmembrane domain[J].Molecular microbiology,2003,48(1):173-186.
[12]Ramanculov E,Young R A ancient player unmasked:T4 rI encodesat-specific antiholin[J].Mol Microbiol,2001,41:575-583.
[13]樊祥宇.分枝杆菌噬菌体的系统生物学研究[D].重庆:西南大学,2014.
(编 辑:陈 希)
Cloning and Sequence Analysis of Mycobacteriophage CJAUS5 StrainholinGene
JIANG Yi-qian1,2,QI Yu1,LIU Wen-xian1,2,JIANG Xiu-yun1,3,GAO Yun-hang1,2,XU Feng-yu1,2∗
(1.College of Animal Science and Technology,Jilin Agricultural University,Changchun130118,China;2.Key Laboratory of Animal Production,Product Quality and Security,Ministry of Education of the people’s Republic of China,Jilin Agricultural University,Changchun130118,China;3.College of Life Science,Jilin Agricultural University,Changchun130118,China)
In order to further research the mechanisms of phage lysis host bacteria and develop the value of phage lysis related protein.Specific primers were designed based on theholingene sequences of mycobacteriophage deposited in GenBank target segment(about 411 bp in length)was amplified by PCR with Mycobacteriophage CJAUS5 genome as a template.The segment was cloned into pMD19-T vector and sequencing the positive recombinant plasmid pMD19-T-holinafterBamHI andEcoRI digestion.The results show thatholingene was successfully cloned and 99.03%to 99.51%sequence homology with other myoviridae mycobacteriophages’sholingene and 99%to 100%amino acid homology.The analysis results of the protein encoded byholingene show that it is a protein with a hydrophilic carboxy-terminal domain and two potential transmembrane domains.This research successfully cloned theholingene of mycobacteriophage CJAUS5 and analyzed the amino acid sequence which laid the foundation for the futher study of Holin protein.
2015-02-02
A
1002-1280(2015)04-0001-06
Q78
吉林省科技厅项目(20140204069NY)
蒋依倩,硕士,从事动物微生态制剂研究。
徐凤宇。E-mail:Xvfengyv2002@126.com
