煤直接加氢制甲烷研究进展
2015-04-23张天开张永发丁晓阔张静太原理工大学煤科学与技术教育部和山西省重点实验室山西太原030024
张天开,张永发,丁晓阔,张静(太原理工大学煤科学与技术教育部和山西省重点实验室,山西太原030024)
煤直接加氢制甲烷研究进展
张天开,张永发,丁晓阔,张静
(太原理工大学煤科学与技术教育部和山西省重点实验室,山西太原030024)
第一作者:张天开(1989—),男,硕士研究生。E-mail tiankai44763110@163.com。
联系人:张永发,教授,博士生导师。E-mailyongfaz@tyut.edu.cn。
摘要:天然气资源短缺、低阶煤资源利用问题突出,开发新型、高效和对环境友好的低阶煤制甲烷工艺成为研究热点。本文分析讨论了以下几方面:温度、压力、催化剂、煤种和气化剂等因素对煤直接加氢制甲烷过程的影响;煤直接加氢制甲烷的反应机理和动力学;3种典型煤直接加氢甲烷化工艺的优缺点;本文作者课题组正在研究开发的低阶煤炭化脱氧、高活性半焦直接加氢制甲烷工艺及其特点。分析认为:以低阶煤(生物质)为原料进行加氢甲烷化生产代用天然气成为新的研究重点,其中又以新型、廉价煤加氢甲烷化催化剂的研制和新型甲烷化反应器的开发最为关键。
关键词:煤制天然气;甲烷化;加氢气化;气化工艺
据统计,2013年中国天然气表观消费量达1676亿立方米,进口量达530亿立方米,对外依存度为31.6%[1]。随着中国经济的进一步发展,天然气需求量将迅速上升,天然气资源短缺将严重影响中国的经济建设、社会发展以及能源安全[2]。与此相反,我国褐煤、长焰煤等低阶煤储量丰富,已探明储量5610亿吨以上[3-4]。因此,将这些储量丰富但热值低、运输成本高的低阶煤资源进行清洁高效利用成为必然趋势[5-8]。
自高温高压下煤的加氢甲烷化反应被Dent等[9]所发现以来,煤的加氢甲烷化过程被广泛考察,以生产代用天然气为目的的煤加氢甲烷化技术迅速发展。近一个世纪以来,诸多学者在不同反应条件下及多种系统中,对多种含碳原料的加氢甲烷化反应进行了广泛研究。20世纪70—90年代是加氢甲烷化研究的黄金期,Hygas、Hydrane、BG-OG等几种典型煤加氢甲烷化工艺相继进行至中试阶段。由于当时天然气价格较低,加氢甲烷化技术成果更多地作为储备技术而停滞不前,至今未能实现产业化。近年来,随着天然气需求增加和价格上涨,煤制天然气技术成为煤化工领域的研究热点。相比间接煤制天然气技术,煤直接加氢制天然气技术以C+ 2H2—→CH4为主反应,具有流程短、能耗低、工艺简单和投资省等特点,重新引起了人们的广泛兴趣。本文基于文献分析总结了温度、压力、催化剂、煤种和气化剂对煤直接加氢气化制甲烷的影响、煤直接加氢制甲烷反应机理和动力学、3种典型的煤加氢甲烷化工艺(Hygas、Hydrane、BG-OG)以及本文作者课题组正在研究开发的低阶煤炭化脱氧、高活性半焦直接加氢制甲烷工艺。
1 反应条件及煤种对煤加氢制甲烷的影响
1.1反应温度
煤加氢甲烷化反应是一个强放热过程,如式(1),且在高温条件下甲烷容易发生裂解,系统甲烷平衡浓度随温度的升高而明显降低,因而在热力学上,降低系统反应温度有利于煤加氢甲烷化反应的进行[10]。

然而,由于煤中碳结构大多具有较高的加氢反应活化能[11],氢原子和碳原子在低温下能量太低,不足以克服反应能垒完成加氢甲烷化反应,温度的升高使得活化分子数明显增加,活性的氢原子运动更剧烈,与碳原子形成有效碰撞的频率大大增加,这有利于反应速率和甲烷产量的增加。因而系统反应温度要保证煤加氢甲烷化反应具有较快的反应速率的同时,又有较高的平衡转化率。
杨允明等[11-12]研究发现:在高压下,升高温度有利于加氢反应的进行,在流化床加氢气化过程中,较大颗粒的煤料往往具有更高的碳转化率,甚至温度高达1000℃时,甲烷化反应仍处于动力学控制。在一定范围内,温度的升高不仅有利于碳转化率的提高[13],还有利于反应速率的加快和甲烷产量的增加。战书鹏等[14]对褐煤进行了加氢甲烷化研究,在4MPa氢压下,反应温度由700℃增加至850℃,反应平均比气化速率提高至原来的4.7倍;在6MPa氢压下,反应温度从500℃升高至800℃的过程中,烟煤加氢甲烷化产品气中甲烷的含量从5.0%增加到37.6%[15]。
不同温度下,煤加氢甲烷化反应产物的分布具有很大差异,低温下主要产物是液态焦油,气态产物中碳氧化合物所占比例较高,甲烷含量低;在高温下,焦油的裂解和煤中碳的加氢反应速率升高,因而焦油产量下降,甲烷产量明显提高,在此阶段参与反应的碳绝大部分转移至甲烷[11]。此外,不同煤种加氢甲烷化所需的反应温度不同,与低阶煤相比,高阶煤或煤焦需要在更高温度下才能实现更好转化。
1.2反应压力
煤加氢甲烷化反应是体积减小的过程,增加反应压力有利于反应的正向进行[16],且甲烷平衡浓度随着压力的增加而升高[17]。反应压力的增加有利于原料煤中更多的碳转化成甲烷[18-20],常压下,氢气对甲烷的生成影响很小,转化的碳与挥发分中碳含量相当,产品气中含有大量的碳氧化合物,甲烷浓度仅在5%左右;800℃时,系统反应压力从常压增至6MPa时,甲烷产量从8%增加至约37.6%[15]。
反应压力与煤加氢甲烷化反应速率直接相关[18,21],随着反应压力的增加,甲烷化速率增大,这在低压阶段尤其明显。在800℃下,褐煤加氢甲烷化反应在1MPa下的平均比气化速率为常压下的5倍,当压力升高至2MPa时,平均比气化速率升高为常压下的11.6倍[14]。此外,煤焦加氢气化的比气化速率与压力的关系呈朗格缪尔吸附等温线形状[22]。
在不同范围内,系统反应压力对煤加氢甲烷化反应的影响程度不同。在较低压力下,压力的增加导致碳转化率、反应速率及甲烷产量迅速增加,这是因为压力的增大增加了活化分子密度及有效接触时间,利于H原子与C原子更有效地完成碰撞生成甲烷,使得甲烷生成速率成倍增加。然而在较高压力下,压力增加对气化速率和碳的转化率的影响程度逐渐减小,主要原因是反应压力的增加延长了气体停留时间,导致H2分子向甲烷化反应活性中心的扩散及反应生成的CH4分子离开反应活性中心的扩散愈发困难,反应平衡对煤加氢甲烷化反应过程的影响程度增强。
1.3催化剂
人们对煤加氢甲烷化催化剂已进行了广泛的研究[18,23-29],一般认为碱金属尤其是钾盐和钠盐对煤加氢甲烷化反应的催化效果最佳,同时,采用浸渍法可以将这些催化剂很好地分散在煤粒的表面,且催化效果较好。
Wang等[18]考察了不同催化剂对煤加氢甲烷化的催化作用,研究表明催化作用取决于催化剂的金属种类和煤焦的种类,并给出以下催化剂催化活性顺序为K2CO3>Na2CO3>Fe(NO3)2>Ni(NO3)2>FeSO4。陈凡敏等[23]发现K2CO3添加量在0~20%(金属原子质量与原煤质量之比)时,对煤加氢甲烷化催化效果先增加后降低,不同添加量其催化效果顺序为10%>20%>5%>0,这主要是由于K2CO3添加量超过10%以后,过量的K2CO3熔融后包覆在煤粉颗粒表面,阻碍了煤加氢气化反应的进行,造成其催化效果降低。付明等[24]研究发现采用K2CO3催化煤加氢甲烷化反应时,碳含量高的煤其产品气最终组成(CO、CH4和CnHm含量)优于碳含量低的煤,但K2CO3对碳含量低的煤催化作用更明显,碳含量低的煤较碳含量高的煤转化率更高、碳转化速率更快,当采用干混法添加粒径为250~830μm和<75μm两种粒度的K2CO3至原煤(粒度<150μm)时,其催化效果与采用浸渍法添加等量的K2CO3效果相近,这可能是由于采用浸渍法负载催化剂时,K2CO3的负载量达到饱和值,而采用干混法添加粒度较细的K2CO3时,K2CO3与煤粉充分接触,且再升温的过程中K2CO3熔融较快,熔融后的K2CO3包覆在煤粉颗粒表面,进一步促进煤加氢甲烷化反应的进行。
洪冰清等[25]对褐煤催化加氢甲烷化研究发现,催化剂的催化活性顺序为K2CO3>Na2CO3> Ni(NO3)2>Ca(OH)2,其原因在于:碱金属化合物K2CO3、Na2CO3在反应过程中与煤样发生侵蚀开槽作用,改变了煤的孔隙结构并产生大量加氢反应活性位,因此使反应速率明显提高;过渡金属化合物Ni(NO3)2对煤加氢甲烷化反应的催化作用只体现在整个气化反应的前半段,在反应的后半段催化剂迅速失活,因此,Ni基催化剂对煤加氢甲烷化反应的整体催化效果较碱金属弱;碱土金属化合物Ca(OH)2催化剂对煤加氢甲烷化反应的催化作用较弱,这是由于在甲烷化反应的前期Ca(OH)2在高温下失水生成的CaO吸收了部分热解气中的CO2,表观上降低了碳转化率,在甲烷化反应的后半段,Ca(OH)2经过失水和固碳作用后在煤粉表面的分散度发生改变,从而影响了它对煤加氢甲烷化反应的催化作用。
Shiro Matsumoto[26]研究了常压下过渡金属对Yallourn煤焦加氢甲烷化反应的影响,铁、钴、镍含量仅为0.1%(质量分数)时便表现出明显催化活性,活性顺序为钴>镍>铁;此外,Shiro Matsumoto提出了氢溢出机理解释煤焦加氢甲烷化的反应过程:氢气分子被镍催化剂吸附并在其上面进行分解、活化后溢出,溢出的活性氢与周围的碳反应生成甲烷。
Yasuo Ohtsuka等[27]研究发现,前体的类型影响催化剂对煤加氢甲烷化反应的作用效果,前体为Fe(NO3)3、(NH4)3Fe(C2O4)3的催化剂对甲烷化反应作用明显,而前体为FeCl3和Fe2(SO4)3的催化剂对甲烷化反应作用不明显,其主要原因在于:反应过程中Fe(NO3)3、(NH4)3Fe(C2O4)3转化成粒度较细(30nm左右)且分散均匀的α-Fe和Fe3C,其催化作用较好,而FeCl3和Fe2(SO4)3在反应过程中转化成粒度较大(>100nm)且分散不均匀的α-Fe,且在Fe2(SO4)3催化过程中同时生成了没有催化作用的FeS,因此,前体为FeCl3和Fe2(SO4)3的铁催化剂对煤加氢甲烷化作用不明显。
Yasuda等[28-29]研究发现聚乙烯与煤在加氢甲烷化过程中具有协同作用,在1073K、7.1MPa、聚乙烯添加为10%~50%(质量分数)、设定反应时间分别为1s、2s、5s、20s、80s的条件下,两者混合后进行加氢甲烷化反应所获得的产品气体积明显高于它们单独气化时所获得的产品气体积之和。其主要原因在于:在煤的加氢热解阶段(煤加氢甲烷化反应的初始阶段,主要为吸热反应),聚乙烯的加氢热解(吸热反应)和加氢气化(放热反应)两种反应同时发生,聚乙烯加氢气化反应所放出的热量多于其加氢热解反应所需热量,且剩余的热量仍可满足煤加氢热解所需求的热量,因此,在此阶段,煤的加氢热解反应得到增强,甲烷产量提高,煤和聚乙烯组成的混合物在加氢气化过程中表现出协同现象。将此方法进行推广应用,不仅可以促进煤加氢甲烷化的工业化进程、工业化生产,而且提供了一种新的废弃塑料处理方法,可以有效降低由废弃塑料引起的环境污染,提高资源利用率,节约能源。
从催化效果上看,碱金属具有良好的催化活性,但添加量较大,达到8%~15%(质量分数),现有的催化剂回收技术存在较多问题,催化剂损失较为严重,这在很大程度上影响了碱金属催化煤加氢甲烷化技术的经济性;钴、镍催化剂也具有较好的催化效果,但是价格较高,高温易烧结且不耐硫;铁系催化剂用量小,价格便宜,但是在中低温下没有明显效果,温度高于800℃时才表现出催化活性。因此,应当加大对催化煤加氢甲烷化的研究,研制出具有较好催化效果的新型、廉价催化剂以提高原煤转化率和甲烷产率并降低生产成本。
1.4煤种
诸多学者已对不同煤种加氢甲烷化过程进行广泛考察[18-19,29-32],研究表明:随煤化度的增加,煤的加氢反应性下降,碳转化率明显降低,且所需反应温度升高,通过加氢甲烷化反应,褐煤的碳转化率可以达到82%,而无烟煤只有44%,且无烟煤加氢气化温度要比褐煤高100~200℃;气态产物组成及产量也有很大不同,高阶煤气化产物中甲烷含量最高,中阶煤气化得到的乙烷、丙烷含量最高,且中阶煤气体总收率最高。
不同煤阶的煤具有不同的结构:低阶煤结构疏松,富含烷基侧链、脂肪族及含氧官能团等活泼组分,具有很高的加氢反应活性;高阶煤中活泼官能团含量急剧降低,芳香稠环结构致密、尺寸变大,微观表面积降低,活性边缘碳原子比例降低,使得煤加氢反应活性下降[33-34]。此外,煤加氢甲烷化的反应速率还与煤中含氧官能团有关,Blackwood 等[35]认为煤中的氧至少与两种活性中心有关,第一种活性中心可能与煤中存在的内酯结构有关,这种结构负责反应初期甲烷和水的快速形成,但是这种结构在甲烷化反应的最初几分钟内就会被破坏;第二种可能与苯并吡喃等结构有关,这些结构负责甲烷缓慢、平稳的生成,并活化煤中碳微晶结构上面特定的点,为甲烷化反应提供活性位。因此,在一定范围内,氧含量高的煤焦具有更高的加氢反应活性。
Mısırlıoğlu等[36]研究了焦炭的加氢甲烷化过程,结果表明焦的加氢甲烷化反应活性比煤低,且随着碳化温度提高,焦的加氢反应活性降低。主要原因是煤焦制备过程中破坏了煤结构中的活泼组分,导致分子结构重排以及缩合度增加,且随着制焦温度的升高,煤中的化学键逐渐断裂,先后顺序为:煤中不同结构单元之间的键、芳烃/氢化芳烃之间的键、芳香核中的结合键,最后在煤中不同芳香体系之间形成一个高度交联的网,结构趋向稳定,因此,随着碳化温度的升高,由原煤生成的具有芳香族特性的半焦其加氢活性越来越低[12];此外,随着半焦制备温度的升高,煤中的氧含量逐渐下降,导致半焦加氢甲烷化反应活性中心的数量下降,因此半焦的加氢甲烷化效果降低[35]。
Porada[37]以蒿柳、低变质程度烟煤以及两者的混合物为原料进行加氢甲烷化实验并对实验结果进行分析,发现在这3种的加氢反应过程中,甲烷、乙烷和乙烯的析出速率曲线走势基本相同;在烟煤加氢甲烷化过程中,丙烷、丙烯的析出时间较另外两原料的甲烷化过程明显延后;在蒿柳加氢甲烷化过程和热解过程的初始阶段(775K之前),甲烷的析出速率一致,因此推测在这一反应段,氢气气氛对蒿柳中甲烷的析出没有影响,蒿柳的热解和加氢甲烷化两个过程反应机理相同。
此外,诸多学者对生物质的研究还涉及到杨树、橡树、桉树、桦树以及农作物秸秆等[38-43],发现生物质一般具有加氢反应活性高和转化速率快等特点,是优良的加氢甲烷化原料。生物质是重要的可再生资源,对于CO2的减排、环境安全、能源品质的提升等方面具有重要意义[44],因此应当提高对生物质加氢甲烷化研究的认识并深入探究生物质加氢甲烷化过程,以期实现工业化应用。
1.5气化剂的影响
煤的加氢甲烷化反应是一个强放热过程,在气化剂中混入部分水蒸气,通过H2O+C—→CO+H2这一吸热反应,可以更为容易地控制系统温度,并且可以提高碳转化率和系统热效率。
Jeon等[20]在微反应器中考察了松木的加氢甲烷化反应,发现在770℃下,水蒸气的加入使得含碳产品气的析出速率较纯氢气气氛下提高了30倍,这是因为水蒸气的加入促进了松木的分解以及松木加氢反应的液态产物向气态产物的转化。在煤或生物质加氢甲烷化过程中,通过水蒸气的气化反应,可以获得反应性很高的活性氢,这将有利于甲烷的生成,但水蒸气含量超过30%(质量分数)时,将会抑制甲烷化反应的进行而不是起活化作用[18],且随着反应压力的增加,水蒸气气化过程会逐渐减慢。
McKee[45]发现在氢气中引入部分水蒸气会降低铁催化剂的催化效果:在H2、H2O摩尔比为4.3、温度为923K、反应时间为30min的条件下,煤样在加氢反应过程的转化率与热解脱挥发分过程失重率基本相等,低于煤样加氢(无水蒸气)甲烷化过程,这说明水蒸气的加入抑制了铁催化剂对煤加氢甲烷化的催化过程。
2 煤加氢甲烷化反应机理
大多学者认为低阶煤基本结构单元的核都具有较小的环数,且以苯环、萘环和菲环为主,芳香碳环周围包含有烷基自由基、烷基侧链、羟基、羧基等结构。其中,羧基、烷基自由基等活泼基团受热容易断键并形成气态物,但芳香碳环非常稳定,活泼基团与芳香碳环的加氢甲烷化反应活化能存在明显差异,导致煤加氢甲烷化过程分为不同反应阶段。在煤的加氢甲烷化过程中,煤中的活性组分迅速反应使得反应过程进入慢速反应阶段。慢速反应阶段主要是煤/焦中的芳香族化合物及多环结构发生慢速加氢反应,在此过程需要很高的能量,因此升高反应温度、增大氢气分压可以获得更高的甲烷生成速率及碳转化率,此过程需要消耗更多的氢气,随着反应的进行甲烷含量逐渐降低,反应速率更是急剧降低,最终接近于石墨加氢甲烷化反应的过程。
Mısırlıoğlu等[36]认为,褐煤加氢甲烷化过程分为两个阶段:第一阶段为高反应活性部分进行加氢热解反应;第二阶段为煤中加氢活性很低的碳结构发生C+H反应过程。Dent等[9]发现,在煤加氢甲烷化过程中,高反应性阶段是瞬时的,只维持数秒钟。而杨允明等[11,16,46]认为煤和氢气的反应分为3个阶段:第一阶段是煤热解和挥发分析出的过程,整体反应速率受到挥发分析出速率的控制,与氢气分压无关,在此阶段主要发生一些脂肪族侧链、含氧官能团的加氢热解反应;第二阶段是富氢低芳环结构、杂环结构等高加氢活性碳结构加氢生成甲烷的反应;第三阶段是氢与残余低活性碳(贫氢骨架碳结构)的反应,此阶段反应速率较慢,接近于石墨加氢反应速率。在快速升温过程中,第一和第二段部分重合。Lee等[19]发现在煤加氢甲烷化反应初期反应速率较快,这是由于煤的加氢反应和热解反应共同进行,其化学反应过程可表示如式(2)[46]。

此阶段主要发生脂肪侧链和含氧官能团的加氢反应,接近扩散控制,随着反应的进行,主反应变为低活性炭的加氢反应,此时反应转为动力学控制。但是在不同制焦温度下所获得的半焦进行加氢气化反应时,在反应的后期CH4产率相差不大,这主要是由于残碳和氢气反应性很差,所得结果与Mısırlıoğlu等[36]相同。
煤在加氢反应过程中甲烷的生成量明显高于惰性气氛下热解时甲烷的生成量,Blackwood[47]认为过量的气态烃尤其是甲烷来自于挥发分的加氢反应和原煤的加氢热解反应,以及H与C的多相反应。Moseley等[48]认为高活性碳的加氢反应是快速反应段的重要过程,很大部分甲烷是由C与H2反应生成。Karcz等[31]发现在煤加氢气化过程中,甲烷、乙烷、乙烯、丙烷和丙烯先在527~627℃较低温度下形成产物峰,随着温度的升高,甲烷生成速率继续增加并在827℃处形成第二个甲烷峰,而其他烷烃几乎消失,因此,推断出甲烷的生成来源于热解过程和碳加氢反应过程,且后者对甲烷产量影响更大。
步学明等[49-50]对煤加氢甲烷化反应不同阶段的残焦进行了红外光谱(FTIR)分析,发现热解阶段CO和CO2的生成源自于—COOH、>C=O、—O—等含氧活泼官能团的断裂;甲烷的生成主要由—CH3、—CH2及脂肪族中其他官能团的断裂而非芳香族化合物加氢;780~820℃的甲烷峰源于芳香族化合物的加氢裂解。
Ding等[16]通过FT-IR分析研究了褐煤半焦在加氢气化过程中官能团的变化过程:从自反应开始至60min,半焦的红外吸收谱图中C=O伸缩振动基本消失,—CH3、—CH2变形振动和—CH3、—CH2伸缩振动也明显减弱,且羟基伸缩振动也大幅度降低;在快速加氢气化阶段(60~80min),随着反应的进行,半焦红外吸收光谱中羟基伸缩振动和取代芳环C—H变形振动明显减弱,芳环中C—H结构被加氢消耗,且在此阶段主要发生易加氢碳结构的加氢气化反应,反应速率较快;在慢速加氢气化阶段,半焦红外吸收光谱中各吸收峰的强度逐渐减弱,主要发生骨架碳结构的加氢气化反应,主反应为C+2H2—→CH4,且这部分碳加氢甲烷化反应性低,系统反应速率迅速降低。
截至目前,人们对于煤加氢甲烷化反应机理的研究主要局限于高反应性官能团和芳香碳环加氢的过程,且验证性试验较少,大多停留在猜测阶段,没有突破。另外对于氧作为煤加氢甲烷化反应的活性中心的研究较少,现有的观点只要是根据煤中氧元素在反应过程中的含量变化以及含氧官能团数量的变化而推测出氧为甲烷化反应提供活性位,但是这种观点不能解释原煤加氢甲烷化反应活性低于半焦(由同种原煤制得)的情况。
3 煤加氢甲烷化反应动力学
煤中不同结构具有显著差异,这些差异导致煤加氢气化过程分为快速反应和慢速反应两个阶段。Ziock等[13]发现,煤加氢甲烷化反应快速和慢速两个阶段的反应活化能存在很大差异,快速反应阶段活化能仅为20~25kJ/mol,慢速反应段活化能则增加了63~209kJ/mol,这也是引起快慢反应阶段反应速率不同的主要原因。
Wen[51]的相关研究从反应速率角度也说明了快速和慢速两阶段的巨大差异,在927℃、8MPa的条件下,假设反应级数为1,North Dakota褐煤加氢甲烷化过程的快速反应阶段转化速率高达5%/s,慢速反应阶段碳转化速率则突然降至0.3~3%/min,往往需要数小时才能实现煤中碳的完全转化。因此,将煤中反应活性高的部分进行快速加氢转化,反应性低的部分气化制氢或另作他用已成为共识。
基于煤炭在流化床中连续的气化反应,德国莱茵褐煤公司研究开发了HKV煤加氢甲烷化工艺[52],并提出动力学模型,如式(3)。

式中,α为碳转化率;a为第一步快速反应的碳转化率;K1、K2分别为第一步快速反应和第二步慢速反应的反应速率常数;PH2为氢气分压;t为固体平均停留时间。在t为30min,PH2分别为60bar (1bar=1×105Pa)、80bar和95bar,温度为840~950℃的条件下,测得α范围为60%~75%,由式(3)计算得:a=60%,K1=3×10−3/(bar·min),K2=2.5× 10−4/(bar·min)。在反应过程中,随着氢气分压增加,煤加氢甲烷化反应级数从2级向1级转变。Zielke 等[53]的实验结果与上述规律吻合良好。
该模型体现了煤加氢甲烷化不同反应阶段的反应差异,对快速、慢速两个反应阶段的具体情况能同时予以很好的描述,常用的反应速率表达形式如式(4)。

杨允明等[11,22]发现煤焦加氢甲烷化的平均比气化速率与反应压力的关系呈朗格缪尔吸附等温线形状,认为氢气与碳的反应过程中,氢气首先在碳的活性中心吸附,形成中间络合物,然后形成烷烃化合物,最后脱附离开表面。根据这一反应机理采用如下反应模型[式(5)]来描述煤焦加氢甲烷化过程。

式中,R−是平均比气化速率;K1、K2、K3均为动力学参数。杨允明等对沈北煤焦加氢甲烷化的实验结果进行回归分析得到:K1=1.25×10−5,K2=1.506×10−6,K3=3.38×10−2。该模型与试验结果具有很好的相关性(相关系数为0.997),说明氢气压力对煤焦加氢甲烷化反应的平均比气化速率有直接影响。
此外,该模型还可表示原煤加氢甲烷化的转化率X的变化过程,此时,式(5)则变为如下形式,如式(6)。

式中,K1表示在惰性气氛中原煤脱挥发分所得到的碳转化率。杨允明等将此模型用于模拟沈北原煤的加氢甲烷化过程并得到:K1=0.37,K2=1.433,K3=0.0314。模拟结果与实验结果相关性较高,相关系数为0.993。
Tomeczek等[54]用Szczerców褐煤和Janina亚烟煤在1100℃下进行热解获得焦炭,并以此为原料进行加氢甲烷化研究,并提出了动力学模型,如式(7)。

式中,R表示反应速率;mC是指反应起始前焦炭中含碳总量;C(T)、D(T)、E(T)表示与温度、压力有关的反应速率系数。通过此模型发现:在900℃条件下,Janina焦炭的碳转化率曲线显示该反应分为两段,其中第一段基本保持水平,当转化率达到70%后,该曲线迅速下降;Szczerców焦炭的碳转化率曲线与上述结果基本一致,不同点在于Szczerców焦炭反应的第一阶段转化率曲线缓慢上升,这是由于后者焦炭的反应活性高于前者。
Bhatia等[55]提出随机孔模型用以描述气固反应过程中固相反应物孔结构的变化对反应速率的影响,此模型多用于煤焦的燃烧和CO2的气化过程[56-59],具体表达式如式(8)。

式中,A0、x、t分别表示初始反应速率、碳转化率、时间;Ψ表示煤焦的孔结构参数,由式(9)计算得到。

式中,L0、ε0、S0分别为初始孔长度、初始孔隙率、初始比表面积,可由孔径分布函数f(r)计算得到,如式(10)~式(12)。

杨帆等[60]修正了随机孔模型,并将得到的新模型式(13)应用于水蒸气和氢气混合气气化神府煤焦。

式中,n为量纲为1幂指数,是表征煤中芳香结构和氢气对水蒸气气化煤的抑制作用的经验常数。杨帆等通过实验发现神府煤焦的气化反应速率随碳转化率的增加先迅速降低,后降缓慢低,并通过计算得到相关参数,如表1所示,拟合结果较优(拟合优度R2均大于0.996)。
战书鹏等[14]采用缩核模型、均相模型和混合模型3个常用模型分别处理了催化剂存在下褐煤加氢甲烷化动力学数据,发现缩核模型和混合模型能很好的描述反应的动力学过程,并未发现明显的分段情况。造成这一现象原因在于他们使用的固定床反应系统升温速率不及流化床,另外催化剂的加入可能使得煤加氢甲烷化慢速反应阶段的反应性加强,减少了同快速反应阶段的差异。
截至目前,人们对于煤加氢甲烷化过程的动力学研究虽然广泛,但是到目前为止还未建立起更为精确、系统化的模型,因此,还需要对煤加氢气化的动力学进行深入系统研究。且现有关于煤加氢甲烷化反应的动力学研究多是通过热重分析得到的,对于放大反应过程的动力学研究较少,因此,应当减少对热重分析的依赖,加大对放大反应过程中煤加氢甲烷化动力学的研究力度。
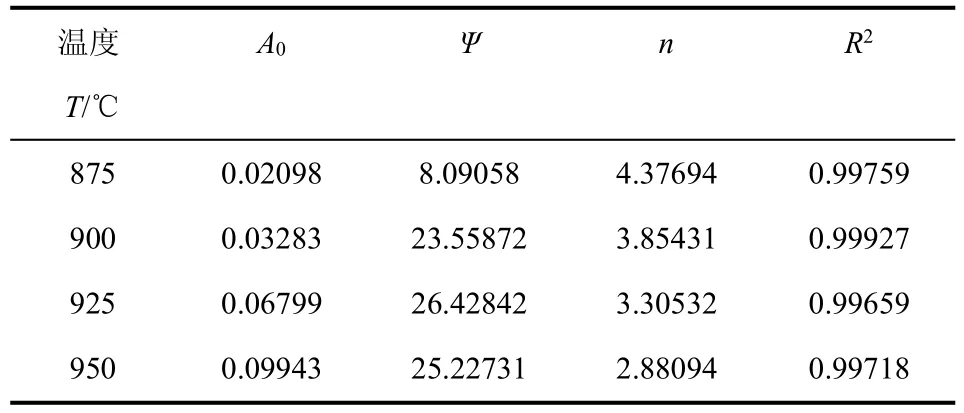
表1 修正随机孔模型拟合神府煤焦的气化参数

图1 Hygas工艺流程
4 典型的煤加氢甲烷化工艺
4.1Hygas煤加氢甲烷化工艺
Hygas煤加氢甲烷化工艺[61-62]由美国芝加哥煤气工艺研究所开发,美国煤气协会和美国内务部煤炭研究局进行了80t/d的中试试验,具体过程见图1。
Hygas工艺在高压流化床气化炉中进行两段加氢气化,该工艺中放热反应(煤的加氢甲烷化)与吸热反应(煤的水蒸气气化)在同一个反应器中耦合发生,产品气中的部分热量被逆行的煤料带回反应器,这不仅提高了系统的热效率(64%~80%),还使得系统氧耗降低了40%。
虽然如此,Hygas中存在煤粒黏结导致的去流态化及细粉带出问题,流化床反应器的结构和操作也比较复杂,且产品气中含有大量CO,二次催化甲烷化负荷大,氢气消耗严重。
4.2Hydrane煤加氢甲烷化工艺
Hydrane煤加氢甲烷化工艺由美国矿务局[63-65]设计开发,并在原煤处理量为4.54kg/h的装置上进行半工业性试验,具体过程见图2。

图2 Hydrant工艺流程
该工艺采用自由沉降稀相段联合流化床的两段加氢气化炉。自由沉降稀相反应段(气化炉靠上部分)的主要作用是把煤转化成多孔半焦并发生部分加氢甲烷化反应。在流化床反应器(气化炉靠下部分)中,主要反应是来自第一段的半焦进一步与氢气反应生成甲烷,以提高产品气中甲烷浓度。
Hydrant工艺具有反应推动力大、产品气中甲烷含量高的特点。但是,该工艺是由两端配合操作,具体操作条件有待改善,且反应时间较长,碳转化率低。
4.3BG-OG煤加氢甲烷化工艺
1986—1993年,英国煤气公司与日本大阪煤气公司联合开发了BG-OG煤加氢甲烷化工艺[66-68],并在日本建立起一个煤处理量为10kg/h的装置进行相关的研究,并给出了商业化生产规划图,具体过程见图3。

图3 BG-OG工艺流程
该工艺的特色之处在于设计了一种带气体循环的气流床反应器MRS,在反应器内部的循环中心管位置,煤粉和经电加热预热的氢气由喷嘴喷入反应器并迅速加热并完成甲烷化反应,生成的富甲烷产品气经侧面出气口离开反应器,反应剩余的焦炭通过反应器底部的煤焦接收器排出。
MRS流化床反应器结构简单,粉煤引射器、氢气喷嘴的设置,实现了煤粉和热氢气的均匀混合和迅速反应。通过设置煤气循环中心管,利用热产品气进一步加热原料气,从而省去了氢气的燃烧升温过程,降低了系统氢耗,提高了热效率。但是,该工艺只进行了小规模试验,放大特性有待于考察。
为分析各工艺的优劣,对以上煤加氢气化工艺进行了对比,结果如表2所示。

表2 煤加氢甲烷化工艺对比

图4 正在研究开发的低阶煤制甲烷工艺流程
5 低阶煤炭化脱氧、高活性半焦直接加氢制甲烷工艺
本文作者课题组正在研究开发低阶煤低温热解—热解半焦加氢甲烷化—甲烷化残渣气化分级转化新工艺[69],流程如图4所示。
这一工艺首先将低阶原料煤干燥,然后送入热解反应器(常压)进行热解,得到热解半焦和含焦油的热解生成气。再将热解半焦送入甲烷化反应器(压力为3~5MPa),热解半焦中容易反应的部分与气化剂H2发生C+2H2—→CH4反应,生成富含CH4的反应生成气,反应剩余的残渣送入气化反应器进行加压气化。含焦油的热解生成气由热解反应器输出,经冷却、分离、净化,得到焦油和热解生成气,再对热解生成气进行CO变换及气体分离,获得甲烷、二氧化碳和富氢气体,其中甲烷作为产品输出,富氢气体作为循环气Ⅰ;将甲烷化反应器输出的甲烷化生成气(500~800℃)送入热解反应器与原料煤进行间接换热,为原料煤热解提供能量;由热解反应器输出的甲烷化生成气再分别与循环氢气和冷水换热得到温度较低的甲烷化生成气,后经净化、分离,获得CH4和循环气Ⅱ;气化反应器输出的气化生成气,送入热解反应器,与原料煤进行间接换热,后经净化、变换、脱碳,获得循环气Ⅲ;将上述步骤获得的循环气Ⅰ、循环气Ⅱ和循环气Ⅲ混合后,得到循环氢气,循环氢气经预热后作为气化剂送入甲烷化反应器。
低阶煤炭化脱氧、高活性半焦直接加氢制甲烷工艺的核心技术在于热解反应器[70],其特色之处是以高温高压甲烷化生成气和高温高压气化生成气通过间接方式与煤料进行热交换,甲烷化生成气、气化生成气和热解生成气三者相互隔离,使得本工艺气体处理过程更为容易,负荷小、效率高。此外,该热解反应器还具有传热温差大、炉墙热导率高和生产能力高等特点。
低阶煤炭化脱氧、高活性半焦直接加氢制甲烷工艺具有热效率高、氢耗低、甲烷化反应速率快等优点,计算表明比传统的“煤制合成气-合成气制甲烷”间接甲烷化工艺,可节约煤、蒸汽和O2分别为19.22%、43.70%和50%,CO2排放量降低25.10%(表3)。

表3 低阶煤制甲烷工艺与传统甲烷化工艺理论能耗比较
6 结语
在过去的几十年里,研究人员对煤直接加氢制甲烷过程进行了诸多研究,发现在一定范围内升高温度有利于煤加氢甲烷化反应的进行,且随着煤阶的升高,煤的加氢甲烷化活性逐渐降低,高阶煤或煤焦需要在较高的温度下才能实现较好的转化;压力在不同范围内对煤加氢甲烷化反应的影响不同,在较低压力范围内,煤加氢甲烷化反应速率随着压力的升高而迅速增大,在较高压力下,甲烷化反应速率随着压力的升高而缓慢上升;碱金属、碱土金属和过渡金属对煤加氢甲烷化反应有催化作用,但是都存在不同程度的问题;在氢气中引入部分水蒸气可以提高煤加氢甲烷化系统的热效率和碳转化率。针对不同反应条件对煤加氢甲烷化过程的影响,提出了多种反应机理并建立起相应的动力学模型,大多学者认为煤加氢甲烷化过程可以分为脂肪族侧链以及含氧官能团等小分子官能团的快速加氢气化阶段和骨架碳结构的慢速加氢气化阶段,此外,德国莱茵褐煤公司基于HKV煤加氢甲烷化工艺提出的模型体现了煤加氢甲烷化过程中快速和慢速反应阶段的差异,较好地描述了煤加氢甲烷化反应的具体过程。
尽管人们对于煤加氢甲烷化反应的研究已经做了许多工作,但仍有许多工作需要深入开展。①开发新型、廉价的催化剂以提高煤加氢甲烷化速率并降低生产成本;②加大对生物质加氢甲烷化反应的研究力度,以提高资源利用率和降低CO2排放;③加大对煤加氢甲烷化新型反应器、新工艺的研发力度,以促进低阶煤资源的高效、环保利用。
参考文献
[1]《2013年国内外油气行业发展报告》课题组.2013年国内外油气行业发展概述及2014年展望[J].国际石油经济,2014(s1):30-39.
[2]曹湘洪.实现我国煤化工、煤制油产业健康发展的若干思考[J].化工进展,2011,30(1):80-87.
[3]王建国,赵晓红.低阶煤清洁高效梯级利用关键技术与示范[J].中国科学院院刊,2012(3):382-388.
[4]石文秀,张玉财,金管会.浅谈褐煤研究的必要性及褐煤的性质[J].化工进展,2012,31(s1):203-207.
[5]王莉萍,张永发.煤制甲烷基础研究和工艺开发进展[J].山西能源与节能,2009(1):51-55.
[6]陈磊,张永发,刘俊,等.低阶煤低温干馏高效采油技术研究进展[J].化工进展,2013,32(10):2343-2351,2534.
[7]刘俊,张永发,王影,等.低阶煤低温干馏炉中低温燃烧室温度场分布模拟及结构优化[J].化工进展,2013,32(9):2112-2119.
[8]张永发,王影,丁晓阔,等.一种制备甲烷化炭材料的方法:中国,102676190A[P].2012-09-19.
[9] Dent F J,Blackburn W M,Millett H C.Investigation of the use of oxygen and high pressure in gasification[J].Trans.Instn.Gas Engrs.,1937,87:231-87.
[10]孙庆雷,王晓,刘建华,等.煤加氢气化过程热力学研[J].山东科技大学学报:自然科学版,2004(4):27-29+38.
[11]杨允明,沙兴中,任德庆.煤的加氢气化研究[J].煤炭转化,1992,15(1):60-67.
[12]杨允明,沙兴中,任德庆.煤和煤焦在压力下加氢气化的动力学研究-Ⅰ.温度的影响[J].华东化工学院学报,1988(4):500-504.
[13] Ziock H J,Anthony E J,Brosha E L,et al.19th Pittsburgh Coal Conference[C].Pittsburgh,USA,2002.
[14]战书鹏,王兴军,洪冰清,等.褐煤催化加氢气化实验研究[J].燃料化学学报,2012,40(1):8-14.
[15]马智华,王欣荣,朱子彬,等.烟煤快速加氢热解的研究Ⅱ.温度和压力影响的考察[J].燃料化学学报,1996(5):40-44.
[16] Ding X K,Zhang Y F,Zhang T K,et al.Effect of operational variables on the hydrogasification of Inner Mongolian lignite semicoke[J].Energy & Fuels,2013,27(8):4589-4597.
[17]刘保林,崔彦亭,何伯述.加氢气化炉内化学反应的热力学研究[J].洁净煤技术,2006(2):67-71.
[18] Wang S C,Baek H I,Jang H T.Hydrogasification of various carbonaceous sources using pressure change properties[J].Korean Journal of Chemical Engineering,2007,24(3):532-536.
[19] Lee S H,Lee J G,Kim J H,et al.Hydrogasification characteristics of bituminous coals in an entrained-flow hydrogasifier[J].Fuel,2006,85(5):803-806.
[20] Jeon S K,Park C S,Hackett C E,et al.Characteristics of steam hydrogasification of wood using a micro-batch reactor[J].Fuel,2007,86(17):2817-2823.
[21] Tomita A,Mahajan O P,Walker Jr P L.Reactivity of heat-treated coals in hydrogen[J].Fuel,1977,56(2):137-144.
[22]杨允明,沙兴中,任德庆.煤和煤焦压力下加氢气化动力学的研究[J].煤气与热力,1989(4):4-10.
[23]陈凡敏,陆泾君,王兴军,等.碳酸钾负载量对煤加氢气化效果的实验研究[J].化学世界,2012(s1):83-84,90.
[24]付明,陈凡敏,张媛媛,等.煤加氢催化气化影响因素的实验研究[J].化学世界,2012(s1):75-76,82.
[25]洪冰清,战书鹏,王兴军,等.不同金属化合物催化呼和浩特煤加氢气化实验研究[J].燃料化学学报,2012(7):782-789.
[26] Shiro Matsumoto.Catalyzed hydrogasification of Yallourn char in the presence of supported hydrogenation nickel catalyst[J].Energy & Fuels,1991,5(l):60-63.
[27] Yasuo Ohtsuka,Yasukatsu Tamai,Akira Tomita.Iron-catalyzed gasification of brown coal at low temperatures[J].Energy & Fuels.1987,l(l):32-36.
[28] Yasuda H,Yamada O,Kaiho M,et al.Effect of polyethylene addition to coal on hydrogasification enhancement[J].Journal of Material Cycles and Waste Management,2013:1-5.
[29] Yasuda H,Yamada O,Zhang A,et al.Hydrogasification of coal and polyethylene mixture[J].Fuel,2004,83(17):2251-2254.
[30] González J F,Ramiro A,Sabio E,et al.Hydrogasification of almond shell chars.Influence of operating variables and kinetic study[J].Industrial & Engineering Chemistry Research,2002,41(15):3557-3565.
[31] Karcz A,Porada S.The influence of coal rank on formation of gaseous hydrocarbons in hydrogasification of coal[J].Fuel,1996,75 (5):641-645.
[32] Schrader L,杨继涛.煤的加氢气化[J].煤炭转化,1981(4):6.
[33]杨景标,郑炯.微观结构对煤焦气化反应性的影响[J].化学工程与装备,2009(5):33-37.
[34] Takarada T,Tamai Y,Tomita A.Reactivities of 34 coals under steam gasification[J].Fuel,1985,64(10):1438-1442.
[35] Blackwood J D.The reaction of carbon with hydrogen at high pressure[J].Australian Journal of Chemistry,1959,12(1):14-28.
[36] Mısırlıoğlu Z,Canel M,Sınağ A.Hydrogasification of chars under high pressures[J].Energy Conversion and Management,2007,48 (1):52-58.
[37] Porada S.A comparison of basket willow and coal hydrogasification and pyrolysis[J].Fuel Processing Technology,2009,90(5):717-721.
[38] Dong Y,Cole E.Evaluation of Biomass Reactivity in Hydrogasification for the Hynol Process[M].US Environmental Protection Agency,National Risk Management Research Laboratory,1996.
[39] Pindoria R V,Lim J Y,Hawkes J E,et al.Structural characterization of biomass pyrolysis tars/oils from eucalyptus wood waste:Effect of H2pressure and sample configuration[J].Fuel,1997,76(11):1013-1023.
[40] Pindoria R V,Megaritis A,Messenböck R C,et al.Comparison of the pyrolysis and gasification of biomass:Effect of reacting gas atmosphere and pressure on Eucalyptus wood[J].Fuel,1998,77 (11):1247-1251.
[41] Suzuki T,Iwasaki J,Tanka K,et al.Influence of calcium on the catalytic behavior of nickel in low temperature hydrogasification of wood char[J].Fuel,1998,77(7):763-767.
[42] Suzuki T,Iwasaki J,Konno H,et al.Effect of demineralization on the hydrogasification reactivity of iron-loaded birch char[J].Fuel,1995,74(2):173-178.
[43]李克忠,张荣,毕继诚.煤和生物质共气化协同效应的初步研究[J].化学反应工程与工艺,2008(4):312-317.
[44]杨伯伦,李星星,伊春海,等.合成天然气技术进展[J].化工进展,2011,30(1):110-116.
[45] McKee D W.Effect of metallic impurities on the gasification of graphite in water vapor and hydrogen[J].Carbon,1974,12(4):453-464.
[46] Zhou Y,Zheng Y,Wang W X,et al.An experimental investigation on hydrogasification of coal chars in a fixed bed reactor under high pressure[J].Advanced Materials Research,2012,524:863-870.
[47] Blackwood J D.Production of methane from carbon[J].Nature.1958,182:1014-1014.
[48] Moseley F,Paterson D.The rapid high temperature hydrogenation of coal chars.Part 1:Hydrogen pressures up to 100 atmospheres[J].J.Inst.Fuel,1965,288:13.
[49]步学明,于涌年,逄进.煤炭加氢气化的研究[J].煤气与热力,1989
(5):4-11+2.
[50] Hong B,Wang X,Zhou Z,et al.A comparison of the gas-product-releasecharacteristicsfromcoal pyrolysisand hydrogasification[J].Energy Technology,2013,1(8):449-456.
[51] Wen W Y.Mechanisms of alkali metal catalysis in the gasification of coal,char,or graphite[J].Catalysis Reviews—Science and Engmeering,1980,22(1):1-28.
[52] Schrader L,Teggers H,Theis K A.Hydrierende vergasung von kohle[J].Chemie Ingenieur Technik,1980,52(10):794-802.
[53] Zielke C W,Gorin E.Kinetics of carbon gasification[J].Industrial & Engineering Chemistry,1957,49(3):396-403.
[54] Tomeczek J,Gil S.The kinetics of coal chars hydrogasification[J].Fuel Processing Technology,2010,91(11):1564-1568.
[55] Bhatia S K,Perlmutter D D.A random pore model for fluid-solid reactions:I.Isothermal,kinetic control[J].AIChE Journal,1980,26(3):379-386.
[56]肖瑞瑞,杨伟,于广锁.生物质半焦的催化气化动力学特性[J].化工进展,2013,32(2):460-465.
[57] Zou J H,Zhou Z J,Wang F C,et al.Modeling reaction kinetics of petroleum coke gasification with CO2[J].Chemical Engineering and Processing:Process Intensification,2007,46(7):630-636.
[58] Feng B,Bhatia S K.Variation of the pore structure of coal chars during gasification[J].Carbon,2003,41(3):507-523.
[59]张永发,谢克昌,凌大琦.显微组分焦样的CO2气化动力学和表面变化[J].燃料化学学报,1991(4):73-79.
[60]杨帆,周志杰,刘海峰,等.氢气存在下煤焦水蒸气气化:Ⅱ.修正随机孔模型的建立[J].燃料化学学报,2009,37(2):156-160.
[61] Schora F C.HYGAS Process[R].Institute of Gas Technology,Chicago,IL(USA),1976.
[62] Hygas法[J].煤炭化工设计,1980(s1):62-70.
[63]吴永宽.现代煤炭化学工艺学[M].北京:煤炭工业出版社,1981:167-170.
[64] Feldmann H F,Yavorsky P M.The hydrane process[C]//5th AGA/OCR Synthetic Pipeline Gas Symposium,Chicago,Illinois.1973.
[65] Hydrane法[J].煤炭化工设计,1980(s1):56-61.
[66] Borrill P A,Noguchi F.IGE Communication[C]//The Institution of gas Engineers,London,1989:1404.
[67]张铱鈖,路兵.煤加氢生产代用天然气技术[J].煤炭转化,1998,21(1):25-29.
[68]李保庆.BG-OG煤加氢气化-城市煤气化新工艺[J].煤气与热力,1995(3):10-15.
[69]张永发,张天开,丁晓阔,等.一种低阶煤制甲烷工艺:中国,102911756A[P].2013-02-06.
[70]张永发,陈磊,武云霞,等.一种载热气体用于煤的热解装置:中国,102911677A[P].2013-02-06.
综述与专论
综述与专论
Research progress of coal hydrogasification to produce methane
ZHANG Tiankai,ZHANG Yongfa,DING Xiaokuo,ZHANG Jing
(Key Laboratory of Coal Science and Technology,Ministry of Education and Shanxi Province,Taiyuan University of Technology,Taiyuan 030024,Shanxi,China)
Abstract:The shortage of natural gas and utilization problems of low rank coal resources make the development of new,efficient and environmentally friendly technology for methane production from low rank coal become the hot topic of research.The issues discussed and analyzed include effects of temperature,pressure,catalyst,coal type and gasification agent on the process of methane production by hydrogenation of coal; reaction kinetics and mechanism of methane production by hydrogenation of coal; merits and drawbacks of three typical techniques for methane production by hydrogenation of coal; and a new technique under development by the authors,that is,methane production from highly activated semi-coke made by carbonation and deoxygenation of low rank coal.In conclusion,production of substitute natural gas through hydromethanation of biomass and low rank coal has become a new research focus,in which research of new and cheap catalyst and development of new methanation reactor and technology for hydromethanation of coal play a vital role.
Key words:coal-based synthetic natural gas;methanation;hydrogasification;gasification technology
基金项目:国家973计划项目(2012CB723105)。
收稿日期:2014-05-26。
DOI:10.16085/j.issn.1000-6613.2015.02.009
文章编号:1000–6613(2015)02–0349–12
文献标志码:A
中图分类号:TQ 546.2
修改稿日期:2014-06-11。
