己内酰胺铑催化合成双-1,3-二羰基化合物 *
2015-04-23赵建平夏热帕提吐孙
赵建平,夏热帕提·吐孙,刘 波
(1.中国科学院新疆理化技术研究所,新疆乌鲁木齐 830011;2.新疆工程学院,新疆 乌鲁木齐 830091)
己内酰胺铑[Rh2(cap)4]是一种典型的二价酰胺铑(Ⅱ)配合物。Rh2(cap)4/TBHP(叔丁基过氧化氢)体系主要用于催化氧化,如:苄位氧化[1]、烯丙位氧化[2-4]、炔丙位氧化[5]、酚的氧化[6]、伯胺的氧化[6]、仲胺的氧化[7]、氧化曼尼希加成[8]等反应。
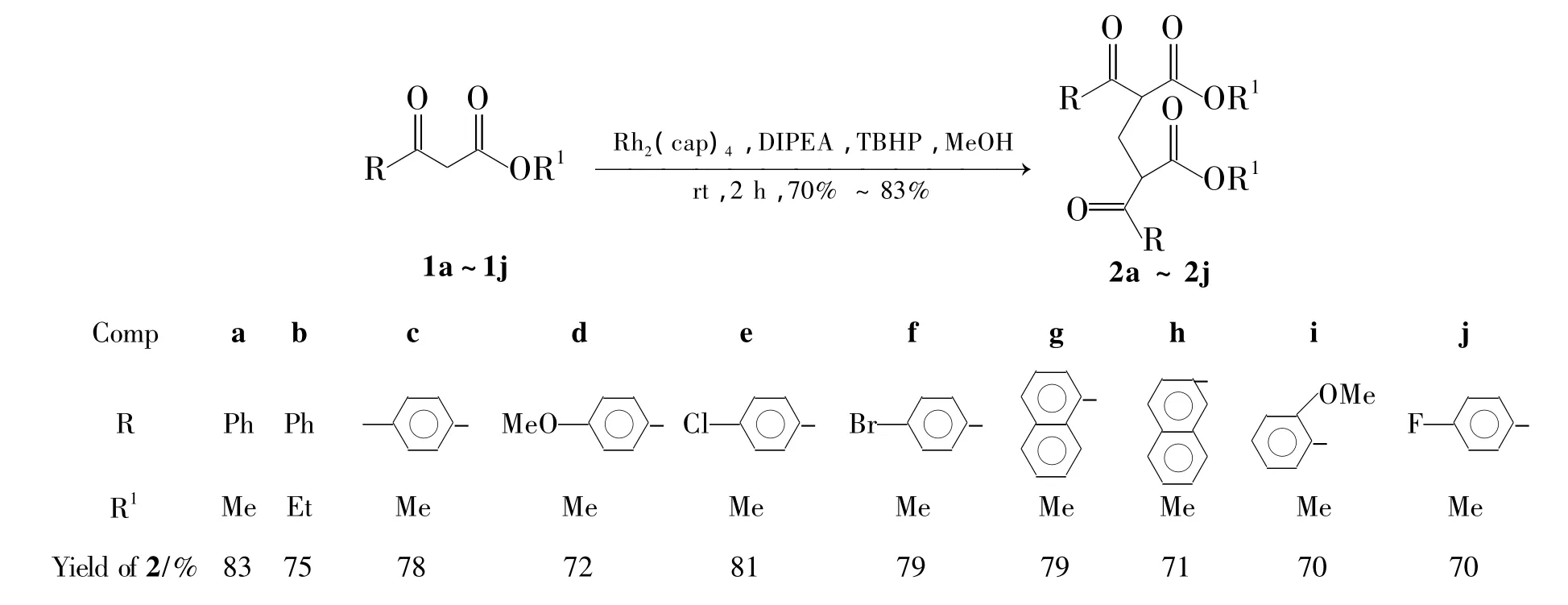
Scheme 1
基于Rh2(cap)4在催化氧化方面的杰出表现,本课题组尝试了用Rh2(cap)4/TBHP体系来对醇进行催化氧化。试验中发现:甲醇在Rh2(cap)4/TBHP体系作用下,可以被氧化成甲醛;加入捕捉试剂1,3-二羰基化合物,则可以发生1,3-二羰基化合物与甲醛的缩合反应,生成含有桥连亚甲基的双-1,3-二羰基化合物[9-10]。双-1,3-二羰基化合物可以用来合成一系列吡唑类衍生物和 1,4-二氢吡啶类衍生物[11]。
本文报道以Rh2(cap)4为催化剂,TBHP为氧化剂,在二异丙基乙(DIPEA)中,甲醇被氧化成甲醛后与1,3-二羰基化合物(1a~1j)经缩合反应合成了一系列双-1,3-二羰基化合物(2a~2j,其中2i和2j为新化合物)(Scheme 1),其结构经1H NMR,13C NMR和HR-ESI-MS表征。并对反应条件进行了优化。
1 实验部分
1.1 仪器与试剂
Varian Inova-400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);MicrOTOF-Q II型高分辨质谱仪。
1a~1j按文献[11]方法制备;70%TBHP 溶液,Alfa;Rh2(cap)4,纯度 99.99%,Alfa;硅胶,青岛海洋化工有限公司;其余所用试剂均分析纯,其中石油醚(60℃ ~90℃)用前经常压蒸馏纯化。
1.2 2a~2j的合成(以2a为例)
在圆底烧瓶中依次加入Rh2(cap)46 mg(0.01 mmol),苯甲酰乙酸甲酯(1a)142.4 mg(0.8 mmol),甲醇 40 mL,DIPEA 168 uL(0.96 mmol)及70%TBHP 溶液 440 uL(2.4 mmol),搅拌下于室温反应2 h(TLC跟踪,碱性高锰酸钾溶液显色)。加入5%NaHSO315 mL~20 mL中和过量的TBHP,搅拌15 min后用二氯甲烷(3×30 mL)萃取,合并有机相,用无水MgSO4干燥,旋干后经硅胶柱层析[洗脱剂:V(石油醚)∶V(乙酸乙酯)=10∶1]纯化得白色固体2a。
用类似的方法合成白色固体2b~2j。
2a:1H NMR δ:8.05(d,J=8.4 Hz,4H),7.59 ~ 7.53(m,2H),7.51 ~ 7.46(m,4H),4.68(t,J=7.3 Hz,1H),4.57(t,J=7.3 Hz,1H),3.75(s,3H),3.64(s,3H),2.78 ~2.54(m,2H);13C NMR δ:195.2,194.8,170.2,170.0,135.9,135.4,133.8,128.8,128.7,128.6,52.5,51.2,50.9,28.2,27.7。
2b:1H NMR δ:8.04(d,J=8.0 Hz,4H),7.60 ~ 7.57(m,2H),7.51 ~ 7.44(m,4H),4.62(t,J=7.3 Hz,1H),4.54(t,J=7.3 Hz,1H),4.24 ~4.21(m,2H),4.20 ~4.06(m,2H),2.78 ~2.54(m,2H),1.21(t,J=7.1 Hz,3H),1.10(t,J=7.1 Hz,3H);13C NMR δ:195.3,195.0,169.8,169.4,136.0,135.6,133.9,129.0,128.9,61.8,61.7,51.7,51.5,28.3,27.8,14.1,14.0。
2c:1H NMR δ:7.85(d,J=8.2 Hz,4H),7.21 ~7.16(m,4H),4.53(t,J=7.3 Hz,1H),4.45(t,J=7.3 Hz,1H),3.65(s,3H),3.54(s,3H),2.67 ~2.43(m,2H),2.34(s,3H),2.31(s,3H);13C NMR δ:194.8,194.4,170.4,170.1,145.0,133.4,133.0,129.7,129.6,129.2,129.1,52.7,51.4,51.1,28.6,28.0,21.8。
2d:1H NMR δ:8.05 ~8.03(m,4H),6.98 ~6.92(m,4H),4.60(t,J=7.1 Hz,1H),4.51(t,J=7.1 Hz,1H),3.88(s,3H),3.86(s,3H),3.74(s,3H),3.63(s,3H),2.74 ~ 2.50(m,2H);13C NMR δ:193.8,193.3,170.6,170.1,164.3,131.5,131.4,128.9,128.4,114.2,55.7,55.6,52.7,51.2,50.9,28.8,28.2。
2e:1H NMR δ:8.05 ~8.04(m,4H),7.58 ~7.45(m,4H),4.66(t,J=7.3 Hz,1H),4.57(t,J=7.3 Hz,1H),3.74(s,3H),3.63(s,3H),2.78 ~2.54(m,2H);13C NMR δ:194.0,193.6,170.1,169.6,140.8,140.7,134.2,133.7,130.5,130.4,129.4,52.9,51.3,51.1,28.3,27.7。
2f:1H NMR δ:7.92 ~7.90(m,4H),7.66 ~7.62(m,4H),4.59(t,J=7.2 Hz,1H),4.50(t,J=7.2 Hz,1H),3.74(s,3H),3.64(s,3H),2.75 ~2.46(m,2H);13C NMR δ:194.2,193.7,170.0,169.5,134.5,134.1,132.3,130.5,130.4,129.5,129.4,52.9,51.2,51.0,28.2,27.6。
2g:1H NMR δ:13.14(s,0.2H),8.62 ~8.58(m,1H),8.04 ~ 7.85(m,6H),7.64 ~7.40(m,7H),4.73(q,J=7.2 Hz,2H),3.82(s,0.7H),3.70(s,2.8H),3.61(s,2.3H),2.94 ~2.72(m,2H);13C NMR δ:198.2,198.0,173.5,172.7,170.1,170.0,169.7,134.7,134.1,134.0,133.8,133.7,133.1,130.6,130.5,130.4,130.3,130.1,128.9,128.6,128.5,128.4,128.1,127.6,127.1,126.8,126.7,126.6,126.4,125.8,125.7,125.1,124.5,124.4,124.2,54.1,54.0,52.8,52.7,52.2,28.7,28.1,26.4。
2h:1H NMR δ:8.62(d,J=8.0 Hz,2H),8.13~ 8.10(m,1H),8.04 ~ 8.02(m,2H),7.95~ 7.91(m,2H),7.89 ~ 7.87(m,3H),7.64 ~7.57(m,4H),4.85(t,J=7.2 Hz,1H),4.79(t,J=7.2 Hz,1H),3.79(s,3H),3.65(s,3H),2.93 ~ 2.70(m,2H);13C NMR δ:195.2,194.8,170.4,170.1,136.1,136.0,133.2,132.8,132.7,132.6,131.4,131.3,130.1,130.0,129.2,129.1,128.9,128.8,127.8,127.1,127.0,124.2,124.1,52.9,52.8,51.5,51.3,28.8,28.2。
2i:1H NMR δ:7.76 ~7.72(m,2H),7.48 ~7.41(m,2H),7.01 ~6.87(m,4H),4.56 ~4.50(m,2H),3.82(s,3H),3.75(s,3H),3.64(s,3H),3.61(s,3H),2.66 ~ 2.49(m,2H);13C NMR δ:196.0,170.6,158.6,134.4,131.2,126.8,126.7,120.9,111.7,111.6,55.8,55.7,55.3,52.2,27.5,27.4;HR-ESI-MS m/z:Calcd for C23H24O8{[M+Na]+}451.135 7,found 451.136 3。
2j:1H NMR δ:8.13 ~8.07(m,4H),7.20 ~7.13(m 4H),4.62(t,J=7.2 Hz,1H),4.52(t,J=7.2 Hz,1H),3.75(s,4H),3.64(s,2H),2.75 ~2.50(m,2H);13C NMR δ:193.7,193.2,170.2,169.7,167.7,165.1,132.3,132.0,131.9,131.8,131.7,116.3,116.1,52.9,51.3,51.1,28.4,27.8;HR-ESI-MS m/z:Calcd for C21H18O6F2[M+Na]+}427.090 6,found 427.096 4。
2 结果与讨论
2.1 反应条件优化
以合成2a为模型反应,对反应条件进行优化。1a 0.8 mmol,于 25 ℃ 反应,考察 Rh2(cap)4,DIPEA,TBHP及MeOH用量对2a收率的影响,结果见表1。由表1可见,不同的碱、催化剂,氧化剂及溶剂用量均对反应有影响。减少催化剂用量,产率有所下降(No.1和No.2);使用有机碱 DIPEA时,效果明显比使用无机碱要好(No.1,No.3和No.4)。减少氧化剂用量,产率有轻微下降,但是时间延长了(No.6 和 No.7)。
合成2a的最佳反应条件为:1a 1.0 mmol,Rh2(cap)41.0 mol%,TBHP 3.0 mmol,DIPEA 1.2 mmol,于室温反应2 h,收率83%。
2.2 底物扩展
在最佳反应条件下对底物进行了扩展,结果见Scheme 1。从Scheme 1中可以看出:不论苯环上连接吸电子取代基或者给电子取代基,对反应的产率没有明显的影响。
3 结论
报道了一种在Rh2(cap)4/TBHP催化体系作用下,甲醇被氧化成甲醛后与 1,3-二羰基化合物发生缩合,制备双-1,3-二羰基化合物的新方法。对反应条件进行了优化,得到中等良好的收率,为合成各种不同取代的双-1,3-二羰基化合物提供了新的途径。
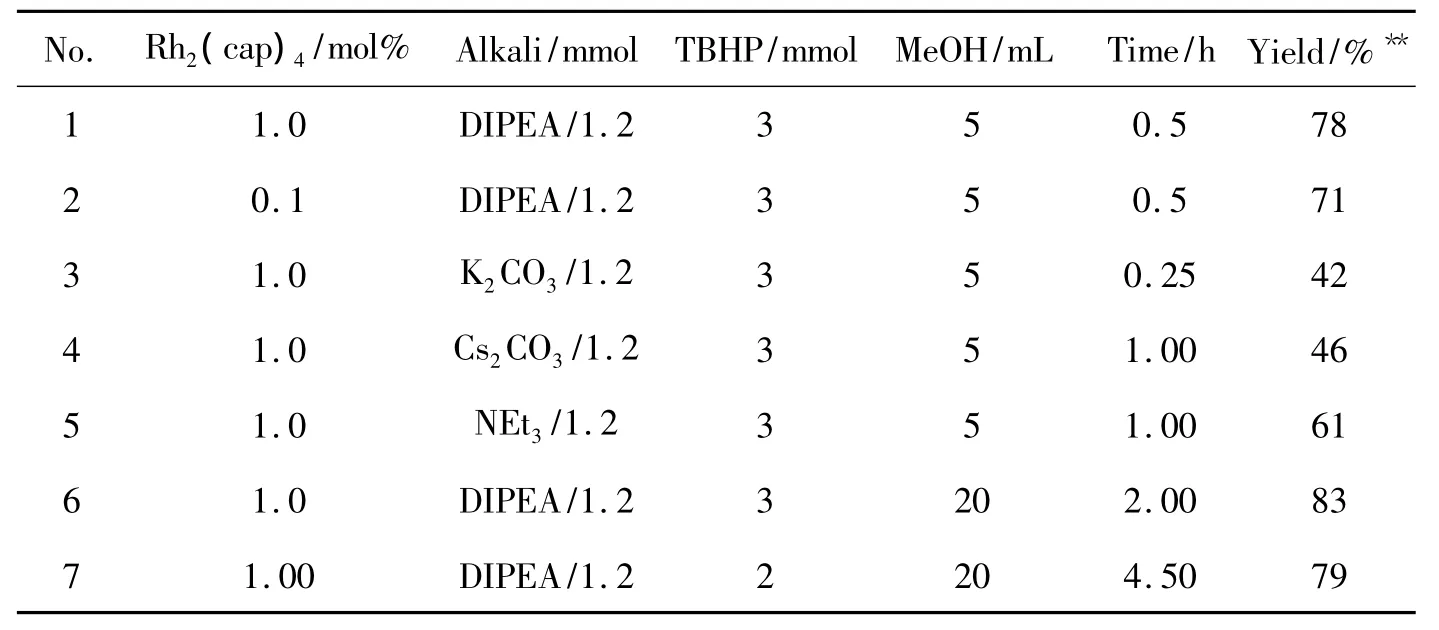
表1 反应条件优化*Table 1 Reaction condition optimization
该方法反应条件温和、操作简单,并扩展了Rh2(cap)4/TBHP催化体系在有机合成中的应用。该方法是首例己内酰胺铑对甲醇的催化氧化反应,而且生成的甲醛可以用1,3-二羰基化合物进行捕捉。
[1]Catino A J,Doyle M P.Benzylic oxidation catalyzed by dirhodium(Ⅱ,Ⅲ)caprolactamate[J].Org Lett,2005,7(23):5167 -5170.
[2]Catino A J,Forslund R E,Doyle M P.Dirhodium(Ⅱ)caprolactamate:An exceptional catalyst for allylic oxidation[J].J Am Chem Soc,2004,126(42):13622-13623.
[3]Choi H,Doyle M P.Optimal TBHP allylic oxidation of Δ5-steroids catalyzed by dirhodiumz caprolactamate[J].Org Lett,2007,9(26):5349 -5352.
[4]McLaughlin E C,Choi H,Wang K,et al.Allylic oxidations catalyzed by dirhodium caprolactamate via aqueous tert-butyl hydroperoxide:The role of the tert-butylperoxy radical[J].J Org Chem,2009,74(2):730 - 738.
[5]McLaughlin E C,Doyle M P.Propargylic oxidations catalyzed by dirhodium caprolactamate in water:Efficient access to α,β-acetylenic ketones[J].J Org Chem,2008,73(11):4317 -4319.
[6]Ratnikov M O,Farkas L E,McLaughlin E C,et al.Dirhodium-catalyzed phenol and aniline oxidations with T-HYDRO.Substrate scope and mechanism of oxidation[J].J Org Chem,2011,76(8):2585 -2593.
[7]Choi H,Doyle M P.Oxidation of secondary amines catalyzed by dirhodium caprolactamate[J].Chem Commun,2007:745 -747.
[8]Catino A J,Doyle M P.The oxidative Mannich reaction catalyzed by dirhodium caprolactamate[J].J Am Chem Soc,2006,128(17):5648 -5649.
[9]Martin D F,Shamma M,Fernelius W C.Bis-(β-diketones).Ⅱ.The synthesis and spectra of compounds of the type [(RCO)R'COCH]2CHR″1,2[J].J Am Chem Soc,1958,80(21):5851 -5856.
[10]Karvembu R,Natarajan K.Synthesis and spectral studies of binuclear ruthenium(II)carbonyl complexes containing bis(β-diketone)and their applications[J].Polyhedron,2002,21(2):219 -223.
[11]Li H J,Li Z P.Iron-catalyzed selective oxidation of N-methyl amines:Highly efficient synthesis of methylene-bridged bis-1,3-dicarbonyl compounds[J].Org Lett,2009,11(18):4176 -4179.
