二氟甲基取代氮杂环丙烷的不对称合成*
2015-04-23杨家林黄焰根
陆 雷,杨家林,黄焰根
(东华大学化学化工与生物工程学院,上海 201620)
含氟化合物得益于氟原子高电负性、低极化率和体积相对较小等独特性能而被广泛地应用于生命和材料科学领域[1]。尤其是含氟亚胺类化合物,是药物合成的一种重要中间体[2]。
CF2是氧原子的等极体和等体体,在有机分子中引入CF2可使其具备独特的生物活性。因此,基于CF2及其类似基团的化学修饰一直是有机氟化学研究的热点之一。
氮杂环丙烷类化合物由于其三元环的高度张力,可拓展为立体或区域选择性的开环和扩环产物,在有机合成中具有重要应用价值[3]。氮杂环丙烷的不对称合成主要路线是:从潜手性烯烃和亚胺出发,在手性催化剂作用下与氮宾或碳宾反应生成光学选择性的氮杂环丙烷[4-5]。
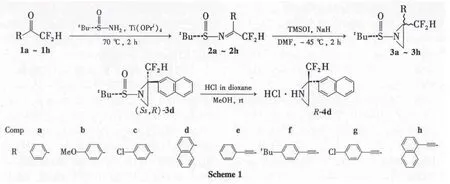
本课题组曾报道了三氟甲基取代氮杂环丙烷的合成[6]。为拓宽氟甲基取代氮杂环丙烷的合成路线,本文以(S)-叔丁基亚磺酰胺和二氟取代酮为原料制得8个二氟甲基取代的叔丁基亚磺酰亚胺(2a~2h);2a~2h与硫叶立德经加成反应不对称合成了12个二氟甲基取代的叔丁基亚磺酰基氮杂环丙烷(3a~3h,Scheme 1),其结构经1H NMR,13C NMR,19F NMR,FT-IR和 HRESI-MS确证。
1 实验部分
1.1 仪器与试剂
Bruker AV 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Nicolet 380 FT-IR型傅立叶变换红外光谱仪(KBr压片)。
所用试剂均为分析纯,其中DMF使用前经干燥处理。
1.2 合成
(1)2a~2h的合成(以2a为例)
在干燥的微波反应管中加入1a 1 mmol,(S)-叔丁基亚磺酰胺 2 mmol和 Ti(OPri)43 mmol,于70℃微波(40 W)辐射2 h。反应液经快速硅胶柱层析(洗脱剂:二氯甲烷)纯化,洗脱液用冰水浴除去溶剂得黄色固体2a(由于2a容易分解,故迅速将其投入下一步反应中)。用类似方法合成2b~2h。
(2)3a~3h的合成(以3a为例)
氮气保护下,在反应瓶中加入三甲基碘化亚砜(TMSOI)660 mg(3 mmol)和 DMF 5 mL,搅拌使其溶解;分批加入NaH 120 mg(3 mmol),加毕,搅拌至反应液澄清、无气泡为止(0.5 h)得硫叶立德A。氮气保护下,于-45℃缓慢滴加新制A至2a(1 mmol)的DMF(5 mL)溶液中,滴毕,反应2 h。升温至室温,加水淬灭反应,用乙酸乙酯(3×5 mL)洗涤;过滤,滤液用饱和食盐水(3×10 mL)洗涤,合并有机相,用无水硫酸镁干燥,经快速硅胶柱层析[洗脱剂A:V(石油醚)∶V(乙酸乙酯)=10∶1]纯化得3a。用类似方法合成了3b~3h。
3a(Ss,R):白色固体,收率53%,m.p.91 ℃ ~99 ℃,+321.33°(c 1.0,CHCl3,下同);1H NMR δ:7.50(d,J=3.6 Hz,2H),7.44 ~7.38(m,3H),6.11(t,J=54.3 Hz,1H),3.10(s,1H),2.32(d,J=6.1 Hz,1H),1.32(s,9H);13C NMR δ:133.15,129.34,128.78,128.21,113.92,58.72,46.80,28.89(d,J=6.4 Hz,1H),22.53;19F NMR δ:- 112.42(dd,J=300.4 Hz,52.4 Hz,1F),-115.96(dd,J=300.6 Hz,54.9 Hz,1F);HR-ESI-MS m/z:Calcd for C13H17NOSF2Na{[M+Na]+}296.089 1,found 296.089 0。
3a'(Ss,S):白色固体,收率31%,3a/3a'=62/38,m.p.93 ℃ ~102 ℃,-426.57°;1H NMR δ:7.46(d,J=17.7 Hz,5H),5.71(t,J=56.0 Hz,1H),3.19(s,1H),2.42(s,1H),1.25(d,J=2.4 Hz,9H);13C NMR δ:130.67,129.67,128.97,128.51,115.58(t,J=245.7 Hz),57.53,46.21 25.18,22.57;19F NMR δ:- 121.14(dd,J=284.5 Hz,56.0 Hz,1F),-122.32(dd,J=284.6 Hz,56.0 Hz,1F);HRESI-MS m/z:Calcd for C13H17NOSF2Na{[M+Na]+}296.089 1,found 296.090 2。
3b(Ss,R):白色固体,收率 46%,m.p.87℃ ~93℃,+497.52°;1H NMR δ:7.42(d,J=8.5 Hz,2H),6.93(d,J=8.5 Hz,2H),6.07(t,J=54.5 Hz,1H),3.84(s,3H),3.06(s,1H),2.30(d,J=6.1 Hz,1H),1.31(s,9H);13C NMR δ:159.92,130.57,125.06,113.98(t,J=241.6 Hz),113.66,58.66,55.30,46.44,29.06,22.53;19F NMR δ:-112.30(dd,J=302.0 Hz,53.3 Hz,1F),- 115.93(dd,J=299.2 Hz,56.8 Hz,1F);HR-ESI-MS m/z:Calcd for C14H19NO2SF2Na{[M+Na]+}326.099 7,found 326.100 7。
3b'(Ss,S):白色固体,收率42%,3b/3b'=52/48,m.p.85 ℃ ~90 ℃,- 280.00°;1H NMR δ:7.40(d,J=8.5 Hz,2H),6.94(d,J=8.6 Hz,2H),5.67(t,J=56.1 Hz,1H),3.82(s,3H),3.16(s,1H),2.39(s,1H),1.24(s,9H);13C NMR δ:160.43,131.94,120.72,115.71(t,J=245.4 Hz),113.99,57.46,55.18,45.70,25.33,22.56;19F NMR δ:- 121.08(dd,J=284.0 Hz,56.2 Hz,1F),- 122.11(dd,J=284.0 Hz,56.1 Hz,1F);HR-ESI-MS m/z:Calcd for C14H19NO2SF2Na{[M+Na]+}326.099 7,found 326.099 5。
3c(Ss,R):白色固体,收率 36%,m.p.56℃ ~61℃,+227.06°;1H NMR δ:7.43(d,J=8.4 Hz,2H),7.38(d,J=8.5 Hz,2H),6.10(t,J=54.2 Hz,1H),3.10(s,1H),2.28(d,J=6.1 Hz,1H),1.31(s,9H);13C NMR δ:134.90,131.69,130.66,128.48,113.71(t,J=242.2 Hz),46.24,28.89(d,J=6.3 Hz),22.52;19F NMR δ:-112.32(dd,J=301.9 Hz,53.2 Hz,1F),-115.94(dd,J=301.2 Hz,54.8 Hz,1F);HR-ESI-MSm/z:CalcdforC13H16NOSF2ClNa{[M+Na]+}330.050 1,found 330.051 1。
3c'(Ss,S):白色固体,收率35%,3c/3c'=51/49,m.p.67 ℃ ~71 ℃,-242.12°;1H NMR δ:7.48 ~ 7.36(m,4H),5.65(t,J=55.8 Hz,1H),3.16(s,1H),2.40(s,1H),1.25(s,9H);13C NMR δ:135.96,132.04,128.87,127.35,115.56(t,J=245.8 Hz),57.68,45.56,25.21,22.54;19F NMR δ: - 120.76(dd,1F),-121.71(dd,J=285.8 Hz,56.0 Hz,1F);HR-ESI-MS m/z:Calcd for C13H16NOSF2ClNa{[M+Na]+}330.050 1,found 330.049 8。
3d(Ss,R):白色固体,收率 43%,m.p.129℃ ~135 ℃,+818.18°;1H NMR δ:7.97(s,1H),7.92 ~7.85(m,3H),7.61(d,J=8.5 Hz,1H),7.54(dd,J=5.9 Hz,2.9 Hz,2H),6.20(t,J=54.3 Hz,1H),3.18(s,1H),2.42(d,J=6.0 Hz,1H),1.34(s,9H);13C NMR δ:133.32,132.82,130.58,129.01,128.14,127.95,127.73,126.68,126.52,126.42,114.06(t,J=242.0 Hz),58.80,47.00,29.04(d,J=6.3 Hz),22.58;19F NMR δ:-112.15(dd,J=301.3 Hz,52.2 Hz,1F),-115.70(dd,J=300.4 Hz,55.0 Hz,1F);HR-ESI-MS m/z:Calcd for C17H19NO2SF2Na{[M+Na]+}346.104 7,found 346.103 4。
3d'(Ss,S):白色固体,收率40%,3d/3d'=52/48,m.p.128 ℃ ~134 ℃,-450.52°;1H NMR δ:7.97(s,1H),7.92 ~7.85(m,3H),7.61(d,J=8.5 Hz,1H),7.54(dd,J=5.9 Hz,2.9 Hz,2H),6.20(t,J=54.3 Hz,1H),3.18(s,1H),2.42(d,J=6.0 Hz,1H),1.34(s,9H);13C NMR δ:133.71,132.90,130.84,128.33(d,J=3.7 Hz),127.83,127.27,126.94,126.42(d,J=3.8 Hz),115.70(t,J=245.9 Hz),57.60,46.37,25.37,22.57;19F NMR δ:- 120.87(dd,J=284.6 Hz,56.0 Hz,1F),-122.09(dd,J=284.6 Hz,56.0 Hz,1F);HR-ESI-MS m/z:Calcd for C17H19NO2SF2Na{[M+Na]+}346.104 8,found 346.105 0。
(3)2-二氟甲基-2-萘基氮杂环丙烷盐酸盐(R-4d)的合成方法

2 结果与讨论
2.1 合成
(1)2a~2h的合成
由于2a~2h非常不稳定,因此2a~2h必须现制现用。实验中发现,在微波条件下,1a~1h和(S)-叔丁基亚磺酰胺于70℃微波(40 W)辐射2 h即可反应完全。反应液经快速柱层析纯化后旋蒸除溶得2a~2h,直接投入下一步反应。
(2)3a~3h的合成
合成3a~3h时,其选择性较低(d/r≈1/1),故尝试通过降低反应温度以提高3a~3h的非对映选择性。
表1为3a和3a'合成条件的优化。由表1可见,反应温度降至-45℃时,以DMF为溶剂,但3a的选择性依旧没有显著提高。随后尝试延长反应时间,3a选择性仍然不佳。但底物为2e时,在No.9的条件反应下,3e选择性却很好(d/r>99/1)。

表1 3a和3a'的合成条件优化Table 1 Optimization of synthesizing 3a and 3a'
合成3a的最佳反应条件为:于-45℃缓慢滴加硫叶立德至2a的DMF溶液中,反应2 h。由表1还可见,3h的非对映选择性(d/r>99/1)远高于3e的非对映选择性(d/r=62/38)。
2.2 表征
为确证3d'的绝对构型,对其进行XRD分析(图1)。由图1可见,3d'的绝对构型为(Ss,S)。

图1 (Ss,S)-3d'的X-射线单晶衍射谱图Figure 1 X-ray spectrum of(Ss,S)-3d'
3 结论
通过硫叶立德和相应亚胺类化合物发生Corey-Chaykovsky反应,合成了一系列二氟甲基取代的叔丁基亚磺酰基氮杂环丙烷;并通过脱保护反应成功合成二氟甲基取代的氮杂环丙烷。该路线为二氟甲基取代的氮杂环丙烷的合成提供了一个简单高效的方法。
[1]Cheng Y,Guo A L,Guo D S.Recent progress in syntheses and applications of fluorinated carbohydrates[J].Curr Org Chem,2010,14:977 -999.
[2]González Gómez J,Medjahdi M,Foubelo F,et al.Stereoselective α-aminoallylation of aldehydes with chiral tert-butanesulfinamides and allyl bromides[J].J Org Chem,2010,75:6308 -6311.
[3]Wu H G J LT,Xia C G,Sun W,et al.Studies on the asymmetric aziridination[J].Pro In Chem,2004,16:767-775.
[4]Zhang Y L,Zhu Z Y.Progress of asymmetric aziridination reaction using metal complex catalysts[J].Chin J Appl Chem,2002,19,205 -211.
[5]Evans D A,Bilodeau M T,Faul M M.Development of the copper-catalyzed olefin aziridination reaction[J].J Am Chem Soc,1994,116:2742 -2753.
[6]Yang Y M,Huang Y G,Qing F L.Asymmetric synthesis of trifluoromethylated aziridines from CF3-substituted N-tert-butanesulfinyl ketimines[J].Tetrahedron Lett,2013,54:3826-3830.
