手性胺拆分法制备雷美替胺*
2015-04-23刘发明苏佳鹏范为正冯柏年
刘发明,苏佳鹏,范为正,冯柏年
(江南大学 药学院,江苏无锡 214122)
雷美替胺{(S)-N-[2-(1,6,7,8-四氢-2H-茚并[5,4-b]呋喃-8-基)]丙酰胺[(S)-1,Chart 1]}[1]是由日本武田公司研发,于2005年7月通过美国FDA批准上市的口服催眠药物。是第一个应用于临床治疗失眠的褪黑激素受体激动剂,主要用于治疗难以入睡型失眠症,对慢性失眠和短期失眠也有确切疗效,是首个不作为特殊管制的非成瘾性失眠症治疗药物。
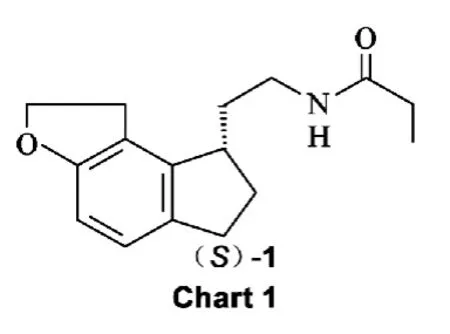
目前,对于(S)-1的合成,主要有不对称催化氢化[2]、生物酶拆分[3]及手性柱色谱分离等。但以上方法都存在一些缺陷,如不对称催化合成需要制备手性催化剂,如 Ru2Cl4[(R)-BINAP]2NEt3,Ru(OAc)2[(S)-BINAP]等。由于这些手性催化剂中过渡金属和手性配体的昂贵,加之反应中需绝对无水无氧和操作繁琐,不易大规模工业化生产,使其应用受到限制。生物酶拆分法的酶催化条件要求较高,酶的稳定性较差,也限制了该方法的应用[4-5]。手性色谱柱分离方法要用到手性柱,手性柱价格昂贵,且不适用于工业化大生产,只适合实验室少量规模的拆分。
化学拆分法是制备手性药物的有效方法。对于1的拆分研究,文献[6]方法采用(R)-苯乙胺[(R)-Ⅰ]为拆分剂对其进行拆分研究。但该方法需经多次重结晶才能得到较高ee值的(S)-1,实验重现性不好,产率不高。
本文以(S)-Ⅰ为拆分剂,对合成雷美替胺(1)的中间体(R,S)-2-{1,6,7,8-四氢-2H-茚并[5,4-b]呋喃-8-基}乙酸[(R,S)-2]进行拆分得(S)-2;(S)-2再经3步反应合成了(S)-1(Scheme 1),ee值为97%。以L-(-)-二苯甲酰酒石酸(Ⅱ)为拆分剂,对(R,S)-2-{1,6,7,8-四氢-2H-茚并[5,4-b]呋喃-8-基}乙胺[(R,S)-3]进行拆分得(S)-3;(S)-3再与丙酰氯反应合成了(S)-1(Scheme 2),ee值为99%。1的结构经1H NMR确证。并对(R,S)-2和(R,S)-3的拆分条件进行了优化。

Scheme 1
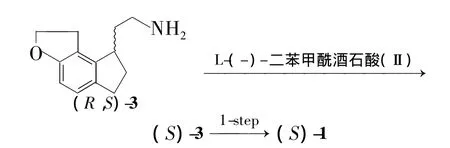
Scheme 2
1 实验部分
1.1 仪器与试剂
BRUKER AVⅢ-400型核磁共振仪(CDCl3为溶剂,TMS为内标);Grace自动过柱机;Waters型高效液相色谱仪(手性OJ柱)。
(R,S)-2[7]和(R,S)-3[6]按文献方法制备;其余所用试剂均为化学纯。
1.2 拆分
(1)(R,S)-2的拆分
在反应瓶中加入(R,S)-2 3 g(10 mmol),异丙醇15 mL和水10 mL,搅拌使其溶解;搅拌下于60 ℃ ~65 ℃慢慢滴加(S)-Ⅰ.2.5 g(20 mmol),滴毕,于60℃ ~65℃反应1 h;于5℃ ~10℃反应至逐渐有固体析出。过滤,滤饼用稀盐酸溶解,用乙酸乙酯(2×20 mL)萃取,合并萃取液,用饱和食盐水洗涤,无水硫酸钠干燥;旋蒸除溶后真空干燥得白色固体(S)-2 1.3 g。
滤液旋蒸除溶得白色固体,搅拌下用混合溶剂[V(丙酮)∶V(水)=15 ∶1]20 mL加热使其溶解;于5℃~10℃慢慢搅拌至逐渐有固体析出。过滤,滤饼用稀盐酸溶解,用乙酸乙酯(2×20 mL)萃取,合并萃取液,用饱和食盐水洗涤,无水硫酸钠干燥;旋蒸除溶后真空干燥得白色固体(S)-2 0.8 g。
合并两次(S)-2,按上述方法进行第二次拆分得白色固体(S)-2 0.8 g 和0.5 g(即1.3 g)。
(2)(R,S)-3的拆分
在反应瓶中加入Ⅱ 11 g(1.2 eq.)和乙腈300 mL,于室温搅拌使其溶解;滴加(R,S)-3 5 g(1.0 eq.)的乙腈(50 mL)溶液(有固体析出),滴毕,于55℃ ~60℃反应3 h。冷却至室温,过滤,滤饼用混合溶剂A[V(乙腈)∶V(甲醇)=10∶3]结晶[先于65℃(浴温)中用A将其溶解,自然冷却至室温,再置冰箱中冷藏结晶过夜]。过滤,滤饼再用A进行重复结晶四次(操作过程同前)。
过滤,滤饼用乙腈洗涤,用二氯甲烷30 mL和1 mol·L-1NaOH溶液20 mL溶解,搅拌2 h。用混合溶剂[V(二氯甲烷)∶V(甲醇)=5∶1]萃取(2×20 mL),合并萃取液,用无水硫酸钠干燥;旋蒸除溶得(S)-3 600 mg,产率12%。
按文献[6]方法制得白色固体(S)-1 0.5 g,收率 78.4%,纯度 99%(HPLC);1H NMR δ:1.14(t,J=7.6 Hz,3H),1.55 ~2.05(m,3H),2.18(q,J=7.6 Hz,2H),2.20 ~ 2.35(m,1H),2.70~ 2.99(m,2H),3.05 ~ 3.50(m,5H),4.48 ~4.60(m,2H),5.46(br,1H),6.61(d,J=8.0 Hz,1H),6.95(d,J=8.0 Hz,1H)。
2 结果与讨论
2.1 2 的拆分
实验中发现,重结晶溶剂对拆分效果有较大影响。考察了溶剂(乙酸乙酯、二氯甲烷、四氢呋喃、异丙醇和丙酮及其与水的混合溶剂)对拆分效果的影响,结果发现混合溶剂对拆分效果最好。为此进一步考察其比例对拆分效果的影响,结果见表1。
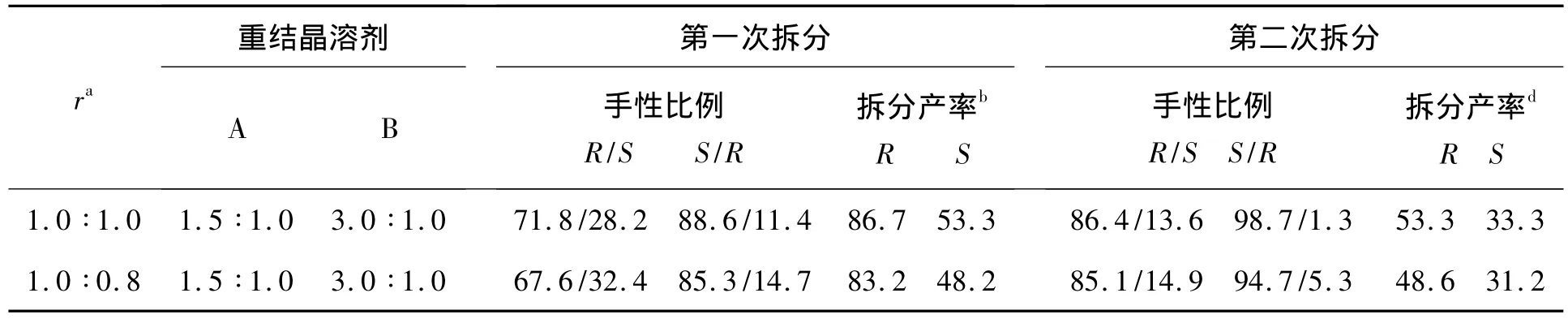
表1 重结晶溶剂和拆分剂用量对2拆分效果的影响*Table 1 Effect of recrystallization solvent and resolution agent amount on resolution efficient of 2
实验中还考察了拆分剂种类对拆分效果的影响,如(S)-或(R)-对甲基苯乙胺,(S)-或(R)-邻甲氧基苯乙胺,(S)-或(R)-间甲氧基苯乙胺,(S)-或(R)-对甲氧基苯乙胺,(S)-或(R)-对氯苯乙胺,(S)-或(R)-间氯苯乙胺以及(S)-或(R)-对溴苯乙胺等等拆分剂对(R,S)-2拆分效果的影响。实验结果表明:以(S)-Ⅰ为拆分剂时,拆分效果最佳。为此,进一步考察了(S)-Ⅰ的用量[r(当量比)=(S)-Ⅰ ∶(R,S)-2]对拆分效果的影响,结果见表1。从表1 可见,当 r=1.0 ∶1.0,重结晶溶剂为 A=V(异丙醇)∶V(水)=1.5 ∶1.0,B=V(丙酮)∶V(水)=3.0 ∶1.0 时,拆分效果最佳。
实验中还发现,(S)-构型的手性胺的拆分效果要比(R)-构型的拆分效果好,且结构越简单,重结晶越容易。在以(S)-Ⅰ为拆分剂拆分时,(R)-构型的雷美替胺中间体较易析出,在对其过滤后,剩下的母液进行二次拆分后即获得 ee值高达97%的光学构型。有效解决了文献[7]方法中以(R)-Ⅰ为拆分剂时需要多次重结晶,拆分产率低下等缺点。
2.2 (R,S)-3 的拆分
以Ⅱ为拆分剂,对(R,S)-3的拆分条件进行优化,结果见表2。从表2可见,以C[V(乙腈)∶V(甲醇)10∶3]为重结晶溶剂时,经过四次重结晶制得的(S)-3;(S)-3再与丙酰氯反应合成的(S)-1,其ee值达98%。与文献[6]方法相比,要想达到同样的ee值,需要四次重结晶,但是,合成路线较短,共11步,而(S)-Ⅰ拆分路线则需要.14步。该拆分方法具有一定的优势。
3 结论
(R,S)-2-{1,6,7,8-四氢-2H-茚并[5,4-b]呋喃-8-基}乙酸[(R,S)-2]的最佳拆分条件为:以(S)-苯乙胺为手性拆分剂,r=1.0 ∶1.0,重结晶溶剂 A=V(异丙醇)∶V(水)=1.5 ∶1.0,B=V(丙酮)∶V(水)=3.0 ∶1.0 时,拆分效果最佳。经过两次重结晶后经3步反应合成的雷美替胺的ee值达97%,而文献[7]方法则需要多次重结晶才能得到同样的ee值的雷美替胺。
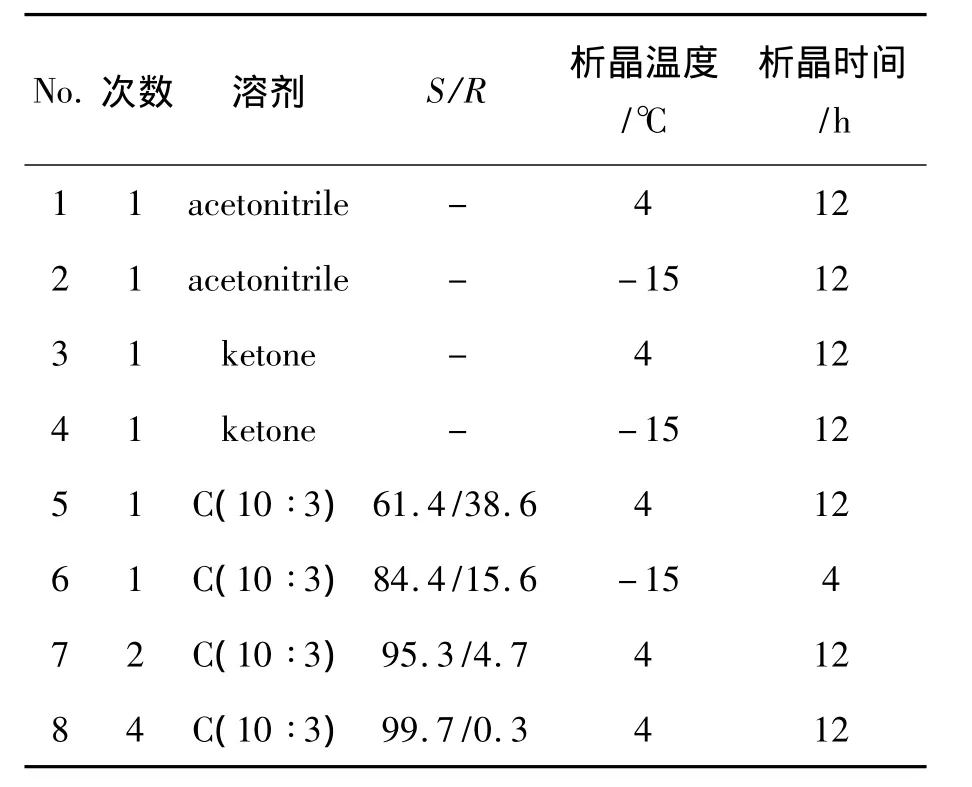
表2 重结晶溶剂对3拆分效果的影响*Table 2 Effect of recrystallization solvent on resolution efficient of 3
(R,S)-2-{1,6,7,8-四氢-2H-茚并[5,4-b]呋喃-8-基}乙胺[(R,S)-3]的最佳拆分条件为:以L-(-)-二苯甲酰酒石酸为手性拆分剂,重结晶溶剂为C=V(乙腈)∶V(甲醇)10∶3。经过四次重结晶后与丙酰氯缩合得到雷美替胺,ee值为99%。
本文报道的化学拆分法避免了昂贵的手性催化剂的使用,具有高效简便、价格低廉、绿色环保等优点。适合工业化大生产。
[1]黄玉凤,唐丽娜.新型催眠药瑞美替昂及其临床研究[J].世界临床药物,2006,27(9):556 -559.
[2]Noyori R.Asymmetric Catalysis in Organic Synthesis[M].John Wiley & Sons:New York,1993.
[3]Wong C H,Whitesides G M.Enzymes in Synthetic Organic Chemistry[M].Pergamon:Oxford,1994.
[4]Judit K,Johan V D E,Antal P,et al.Enzymatic resolution of bicyclic 1,3-amino alcohols in organic media[J].Tetrahedron:Asymmetry,2001,12(4):625 -631.
[5]Kansal V,Mistry D,Vasoya S.Process for the synthesisof ramelteon and its intermediates[P].WO 2 008 151 170,2008.
[6]蒋龙,夏正君,陈再新,等.雷美替胺的合成[J].中国医药工业杂志,2009,40(3):161 -164.
[7]毛化,钟静芬,时惠麟.雷美替胺合成路线图解[J].中国医药工业杂志,2010,41(10):783-785.
