枯草芽孢杆菌BJ3-2 S-腺苷甲硫氨酸脱羧酶基因speD的克隆与序列分析
2015-04-23王亚娟韩忠安罗信旭吴拥军
王亚娟,韩忠安,罗信旭,吴拥军*
(贵州大学 生命科学学院,贵州 贵阳 550025)
生物胺(biogenic amines,BA)是一类主要由氨基酸脱羧或醛和酮氨基化形成的弱碱性低分子质量含氮化合物[1],是人体内的正常生理活性物质,但当体内摄入过量生物胺时会引起头痛、心悸等一系列不良反应。研究发现,生物胺还具有潜在的致癌性,生物胺存在于食品中也会影响食品风味甚至改变其成分风味[2-3]。S-腺苷甲硫氨酸脱羧酶(S-adenosylmethionine decarboxylase,SAMDC 或AdoMet-DC)是多胺合成代谢中的3个关键酶之一[4-5]。其存在于细菌、真菌、古生菌和植物体内,在多胺生物合成过程中起着重要的作用,它以S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)为底物催化形成脱羧S-腺苷甲硫氨酸,为精胺和亚精胺的合成提供氨丙基,是精胺和亚精胺合成的限速酶[6-7]。近年已有人类及多种植物的SAMDC 基因被分离鉴定,并证明其在多胺合成中具有重要作用[8]。食品中主要存在的生物胺包括组胺、腐胺、尸胺、酪胺、色胺、β-苯乙胺、精胺和亚精胺。
豆豉是我国传统发酵豆制品,经微生物发酵以色香诱人、风味独特而深受消费者的喜爱。目前已报道的贵州地区水豆豉主酵微生物是枯草芽孢杆菌(Bacillus subtilis),是细菌型豆豉生产的安全菌株[9]。据报道,与枯草芽孢杆菌同属的纳豆芽孢杆菌发酵过程中检测到了亚精胺、精胺、腐胺、酪胺4种生物胺[10-11],但豆豉发酵过程中是否会产生过量的生物胺还不得而知。枯草芽孢杆菌在发酵过程中分泌的脱羧酶能够将氨基酸经过脱羧反应生成相应的胺类物质[10]。在前期的研究中,实验室已从贵州地区豆豉样品中分离获得了可作为生产应用的菌株BJ3-2[12],以Bacillus subtilisBJ3-2基因组为模板,克隆S-腺苷甲硫氨酸脱羧酶(SAMDC)基因(speD),并与已报道的枯草芽孢杆菌的speD序列进行同源性比对分析,推测SAMDC活性结构域和酶活性位点,研究为SAMDC活性影响因素的进一步研究和豆豉生产中的安全评价奠定了基础。
1 材料与方法
1.1 材料与试剂
枯草芽孢杆菌(B.subtilis)BJ3-2:实验室保藏菌株;E.coliDH5α感受态细胞:本实验室经氯化钙法制备;质粒pGEM-T载体:美国Promega公司。
T4 DNA连接酶、Taq(聚合)酶、DNA Marker、dNTP、10×PCR Buffer等:大连TaKaRa公司;基因组提取试剂盒:北京Promega生物技术有限公司;质粒提取试剂盒、胶回收试剂盒:美国OMEGA生物技术公司;其他试剂均为国产分析纯。
1.2 仪器与设备
MyCycler PCR仪、PowerPac HC电泳仪、Gel Doc XR型UniversalHood凝胶成像系统:美国Bio-Rad公司;DHP-9162型电热恒温培养箱:上海一恒科技有限公司;SKY-2102C型恒温摇床:上海苏坤实业有限公司;SW-CJ-IFD型标准型净化工作台:苏州净化设备工程有限公司。
1.3 方法
1.3.1 引物设计与合成
查询GenBank获得B.subtilis168菌株的speD序列,应用Primer 5.0软件设计speD特异性克隆引物。结果见表1。
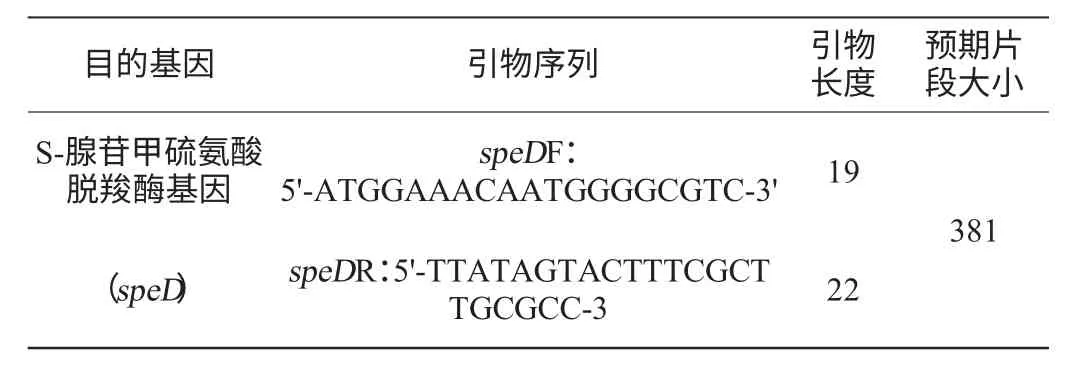
表1 扩增目的基因的名称及引物序列Table 1 Name of target gene amplified and its primer sequence
1.3.2B.subtilisBJ3-2基因组提取、质粒提取
依照试剂盒说明书进行;片段回收、连接、转化参照分子克隆实验指南第三版。
1.3.3 PCR扩增
以B.subtilisBJ3-2的gDNA为模板,引物speDF/speDR进行PCR扩增,反应体系:模板1 μL、dNTP 1.6 μL、10×PCR Buffer 2 μL、上下游引物各0.5 μL、Taq酶0.1 μL、ddH2O 14.3 μL,总体系为20 μL。
1.3.4 重组子鉴定
经菌落PCR和质粒PCR验证,重组质粒送北京诺赛基因组研究中心有限公司测序。
1921年中国共产党成立后就立即研究在各地建立和发展社会主义青年团,并派出许多党员去加强对各地团的早期组织的领导工作。1922年5月,中国社会主义青年团第一次全国代表大会开幕。大会通过的团的纲领确定了中国社会主义青年团为中国青年无产阶级的组织,是为解放无产阶级而奋斗的组织。此后十几年间,共青团组织在党的领导下,带领各地的团员青年相继投身工人运动、改组国民党、北伐战争、反对国民党统治的斗争中去。抗日战争爆发后,为了建立抗日民族统一战线,更广泛地团结各界青年投入抗日救亡的斗争,共产主义青年团响应党的号召,主动改造变身为各种抗日救国的青年团体,为抗战的胜利做出了突出贡献。
1.3.5speD序列分析
用DNAStar和MEGA5生物学软件对speD的核苷酸序列及推导的氨基酸序列进行编辑,与GenBank中已发表的其他speD序列进行同源性分析并绘制SAMDC遗传进化树[14]。使用Clustalw2和GeneDoc生物学软件进行多序列比对分析。
2 结果与分析
2.1 B.subtilis BJ3-2g DNA的提取
提取B.subtilisBJ3-2基因组,样品经琼脂糖凝胶电泳检测,结果见图1。图1显示所提取的B.subtilisBJ3-2 gDNA较完整,无显著降解,可用于目的基因的PCR扩增。

图1 枯草芽孢杆菌BJ3-2基因组Fig.1 Genome of Bacillus subtilis BJ3-2
2.2 speD的PCR扩增
将克隆产物经琼脂糖凝胶电泳检测,结果见图2。由图2可知,目的条带约与预期片段(381 bp)相符。
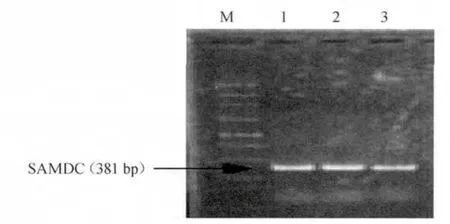
图2 PCR扩增speD基因Fig.2 PCR amplification of speD
2.3 重组克隆质粒的菌落PCR鉴定
挑取单菌落,经菌落PCR检测,结果见图3。由图3可知,2、4、6、7泳道在预期大小处有克隆条带,初步认定为阳性重组菌。
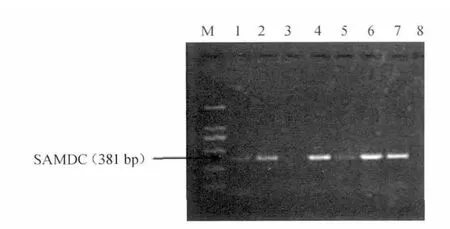
图3 菌落PCR鉴定重组子Fig.3 PCR recombinant identification of colony
2.4 重组质粒PCR鉴定
将鉴定的阳性重组菌落4进行增菌培养,提取质粒,进行质粒PCR检测,结果见图4。由图4可知,在预期大小处出现克隆条带,说明目的基因已正确克隆至pGEM-T 载体中。将提取的重组质粒送生物公司测序,并命名为pGEM-speD。
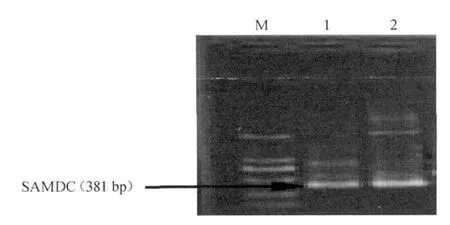
图4 质粒PCR鉴定Fig.4 PCR identification of plasmid
2.5 speD的同源性分析及系统进化树构建
在GenBank数据库中将所克隆基因序列和推导的蛋白序列进行序列同源性比对,分析结果表明,B.subtilisBJ3-2的speD序列与已报道枯草芽孢杆菌的speD基因序列和蛋白序列高度同源,与萎缩芽孢杆菌(Bacillus atrophaeus)的核苷酸序列相似性达96%,与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)达93%以上,与其他芽孢杆菌在85%以上。其氨基酸序列与芽孢杆菌NSP9.1(Bacillussp.NSP9.1)同源性达到97%、与印度芽孢杆菌(Bacillus indicus)LMG 22858同源性达到95%、与索诺拉沙漠芽孢杆菌(Bacillus sonorensis)达到96%,与芽孢杆菌属其他多种菌种的SAMDC氨基酸序列在90%以上。表明所克隆的基因是编码SAMDC的基因。
所有生物的腺苷甲硫氨酸脱羧酶都是依赖丙酮酰基的酶,依据其剪切位点、结构特征和酶活性离子,将之分为两大类:Ⅰ类酶主要存在于细菌和古细菌;Ⅱ类酶主要存在于真核生物中。SAMDC活性酶是从来源于丝氨酸自我剪切而产生的具有催化活性的丙酮酰基修饰产生的,尽管两类酶的形成都是利用丙酮酰基,经历同样的自身成熟过程,但是除了丙酮酰基位点外Ⅰ类和Ⅱ类酶几乎没有序列相似性[15]。
Ⅰ类酶可分为两类,Ⅰ类A型:SAMDC主要包括革兰氏阴性细菌,活性酶的形成需要二价金属离子(如Mg2+)的参与催化形成(αβ)4四聚物;Ⅰ类B型:SAMDC包括革兰氏阳性细菌和古细菌,如杆状菌和詹氏甲烷球菌,形成(αβ)2二聚物,并且不需要镁离子或其他的活性剂参与[16-17]。
Ⅱ类酶主要包括来自于动物、植物、真菌和锥体虫(无脊椎)的腺苷甲硫氨酸脱羧酶。Ⅱ类A包括来自于动物的S-腺苷甲硫氨酸脱羧酶(AdoMetDC),是(αβ)2二聚物和需要腐胺作为激活因子。Ⅱ类B包括来自于植物的AdoMetDC,是(αβ)单体和不需要腐胺作为激活因子。Ⅱ类C包括来自于锥体虫(无脊椎)的AdoMetDC异二聚体,具有αβπ′亚基结构。镰状疟原虫的AdoMetDC 是一种双功能蛋白,C末端具有鸟氨酸脱羧酶活性。
研究发现,枯草芽孢杆菌的SAMDC与古生菌的SAMDC密切相关。B.subtilisBJ3-2与B.subtilis168属于枯草芽孢杆菌,詹氏甲烷球菌(Methanocaldococcus jannaschii)和嗜热泉生古细菌(Aeropyrum pernixK1)属于古生菌,海栖热孢菌(Thermotoga maritima)都属于Ⅰ类B型AdoMetDC,且海栖热孢菌(T.maritima)的AdoMetDC的晶体结构的构建为Ⅰ类B型AdoMetDC(PDB code 1TLU)的酶活性以及结构的分析提供了理论基础[17]。选择这些细菌的SAMDC的氨基酸序列作比对,推测B.subtilisBJ3-2的SAMDC酶原剪切位点及酶活性位点。根据大肠杆菌(Escherichia coli)和人类(Homo sapiens)、拟南芥(Arabidopsis thaliana)的SAMDC氨基酸序列以及同源性较高的芽孢杆菌SAMDC序列构建系统进化树,进一步分析它们之间的进化关系。
ClustalW多序列比对,GeneDoc输出,图5结果显示B.subtilisBJ3-2的SAMDC基因属于丙酮酸依赖型脱羧酶的Ⅰ类B型S-腺苷甲硫氨酸脱羧酶家族,具有酶原剪切结构域:(53 GVSGVVIISESHLTIH 68)结构域,其中ESH三个氨基酸残基高度保守,包括有丙酮酰前体丝氨酸和酶原剪切位点;第二个保守结构域:(82 TCG 84)结构域,在这个结构域中CG两个氨基酸残基高度保守,具有亲核催化作用的半胱氨酸残基,对酶的催化活性具有重要作用。
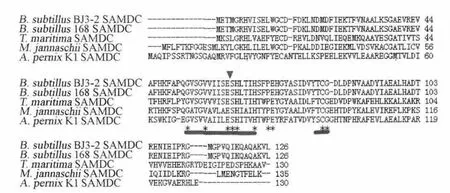
图5 B.subtilis BJ3-2和其他细菌SAMDC的氨基酸多序列比对Fig.5 Multiple alignments between amino acid sequence of B.subtilis BJ3-2 and other bacteria
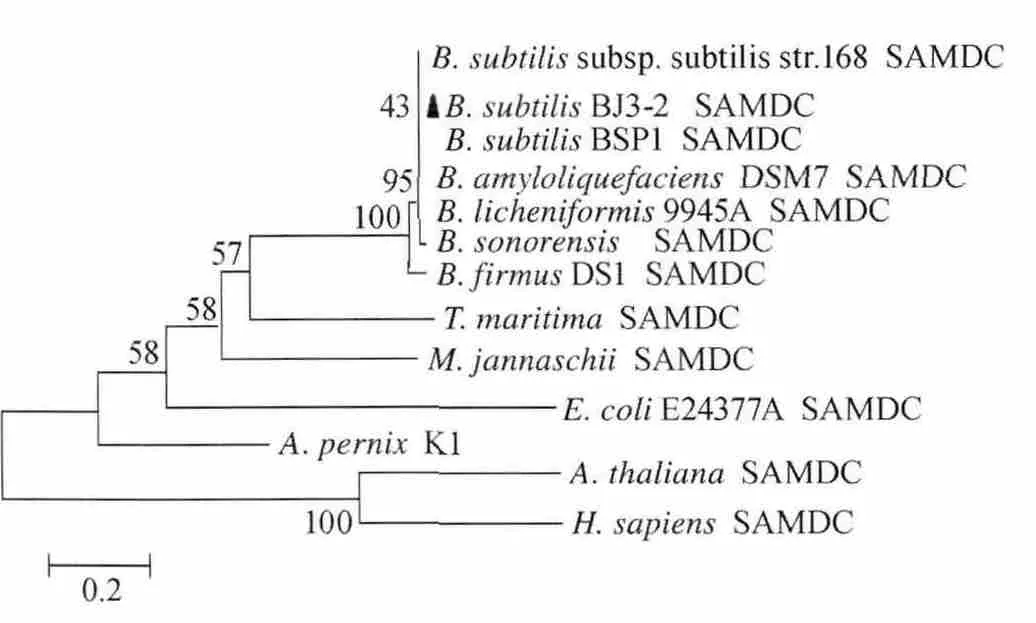
图6 不同类型S-腺苷甲硫氨酸脱羧酶的氨基酸序列遗传进化树Fig.6 Phylogenetic tree constructed with amino acid sequences of different types of S-adenosylmethionine decarboxylase
从图6可以看出,枯草芽孢杆菌(B.subtilis)的SAMDC位于遗传距离较近的同一进化分支,彼此亲缘关系较近,B.subtilisBJ3-2与B.subtilis168和B.subtilisBSP1的SAMDC遗传距离最近,詹氏甲烷球菌(M.jannaschii)、嗜热泉生古细菌(A.pernix)K1 和海栖热孢菌(T.maritima)的SAMDC遗传距离次之,与E.coli[A7ZHK9]的SAMDC位于遗传距离稍远的同一进化分支,与人类(H.Sapiens)[NP_001625]、拟南芥(A.thaliana)[AEE73813]的SAMDC遗传距离最远。以上分析显示B.subtilisBJ3-2 的SAMDC具有丙酮酸依赖型脱羧酶酶原剪切结构域,属于典型的Ⅰ类B型SAMDC家族成员。
3 结论
SAMDC是多胺合成代谢过程中的限速酶,是精胺和亚精胺合成的关键酶,本实验依据GenBank中枯草芽孢杆菌168菌株(登录号为AL009126.3)的speD编码基因序列,设计了特异性引物,通过PCR技术从B.subtilisBJ3-2菌株中扩增得到SAMDC基因序列,与预期大小相吻合。通过序列比对、保守结构域分析,B.subtilisBJ3-2 的SAMDC具有丙酮酸依赖型脱羧酶酶原剪切结构域[53 GVSGVVIISESHLTIH 68]和保守结构域[82 TCG 84],属于典型的的Ⅰ类B型S-腺苷甲硫氨酸脱羧酶家族成员,其关键的活性位点氨基酸残基,即丝氨酸(Ser,S)Ser55、丝氨酸Ser63、组氨酸(His,H)His68、半胱氨酸(Cys,C)Cys83,与底物结合、酶的催化及酶原的加工过程相关。
在革兰氏阳性菌枯草芽孢杆菌中其多胺的合成是始于精氨酸,由精氨酸脱羧酶、胍基丁胺酶、S-腺苷甲硫氨酸脱羧酶以及亚精胺合酶、精胺合酶共同参与作用的。所以应同时对这几个基因进行研究,以进一步了解枯草芽孢杆菌生物多胺的合成途径。在后续实验中可以选择合适的表达载体进行蛋白表达纯化,对其酶活力和酶学性质进行研究。综合细菌型豆豉生物发酵特点,使得氨基酸脱羧酶既能满足豆豉发酵条件的需要又能有效控制豆豉产品中生物胺的含量,为有效保证豆豉产品的生物安全性提供理论指导。
[1]何庆华,吴永宁,印遇龙.食品中生物胺研究进展[J].中国食品卫生杂志,2007,19(5):451-454.
[2]曲映红.发酵食品中生物胺的研究进展[J].食品工业,2012(3):115-118.
[3]刘 景,任 婧,孙克杰.食品中生物胺的安全性研究进展[J].食品科学,2013,35(5):322-326.
[4]汪 天,孟艳琼,谷 凤,等.多胺代谢及其与农产品贮藏保鲜关系的研究[C]//2005 安徽食品安全博士论坛,合肥,2005.
[5]耿卫东,李艳军,张新宇,等.棉花S-腺苷甲硫氨酸脱羧酶基因的克隆及低温下的表达分析[J].作物学报,2012,38(9):1649-1656.
[6]GALSTON A W,SAWHNEY R K.Polyamines in plant physiology[J].Plant Physiology,1990,94(2):406-410.
[7]刘志勇,王孝宣,高建昌,等.番茄S-腺苷蛋氨酸脱羧酶基因SlSAMDC1的克隆与序列分析[J].园艺学报,2008,35(8):1137-1146.
[8]路玉兰,孙艳香,冯 雪,等.百脉根S-腺苷甲硫氨酸脱羧酶基因克隆与表达分析[J].华北农学报,2013,28(2):78-85.
[9]吴拥军,孟望霓,李耀中.纯种强化发酵细菌型豆豉研究[J].中国酿造,2011,30(9):56-60.
[10]苏 悟,郑小芬,徐睿烜,等.1 种细菌型豆豉自然发酵过程中生物胺的变化[J].食品与发酵工业,2014,40(7):40-45.
[11]张建华,沈 翔,于湘莉.纳豆发酵过程中的生物胺[J].上海交通大学学报,2007,25(1):2-5.
[12]贾东旭,吴拥军,李耀中,等.细菌型豆豉发酵芽孢杆菌的筛选与鉴定[J].食品科学,2009,30(5):217-221.
[13]J.萨姆布鲁克,D.W 拉塞尔.黄培堂,等译.分子克隆实验指南(第三版)[M].北京:科学出版社,2002.
[14]张丽娜,荣昌鹤,何 远,等.常用系统发育树构建算法和软件鸟瞰[J].动物学研究,2013,34(6):640-650.
[15]SEKOWSKA A,COPPEE J Y,LE CAER J P,et al.S-adenosylmethionine decarboxylase ofBacillus subtilis is closely related to archaebacterial counterparts[J].Mol Microbiol,2000,36(5):1135-1147.
[16]张佳景,丁淑丽,邹宜静,等.植物腺苷甲硫氨酸脱羧酶研究进展[J].细胞生物学杂志,2008,30(5):622-628.
[17]BALE S,EALICK S E.Structural biology of S-adenosylmethionine decarboxylase[J].Amino Acids,2010,38(2):451-460.
